ВВЕДЕНИЕ
В последние годы представление о роли витамина D в организме человека значительно расширились: сегодня он рассматривается не только как «антирахитический фактор» и регулятор фосфорно-кальциевого обмена, но и как компонент, вовлеченный в регуляцию экспрессии сотен генов и модуляцию активности внутриклеточных сигнальных каскадов, что позволяет считать D-гормон важным и активным элементом D-эндокринной системы [1, 2].
Витамин D в основном синтезируется в коже при воздействии ультрафиолетовых лучей спектра B, тогда как пища обычно служит лишь второстепенным его источником [3]. Для реализации костных и внекостных (плейотропных) эффектов и превращения в активную гормональную форму витамину D необходимо пройти два последовательных этапа гидроксилирования [3–5]. Первая реакция гидроксилирования осуществляется преимущественно в печени при участии микросомального фермента 25-гидроксилазы (CYP3A4) с образованием промежуточной биологически малоактивной транспортной формы — 25(ОН D (25-гидроксивитамин D, кальцидиол), являющейся надежным биомаркером обеспеченности организма витамином D. Кальцидиол имеет длительный период полураспада (2–3 нед) и отражает поступление как экзогенного (пищевого), так и эндогенного (синтезирующегося в коже на фоне инсоляции) витамина D. Последующая реакция 1α-гидроксилирования 25(ОН)D происходит в проксимальных почечных канальцах при помощи фермента 1α-гидроксилазы (CYP27В1) с образованием наиболее важной активной гормональной формы витамина в виде 1,25(OH)2D (1,25-дигидроксивитамин D, D-гормон, кальцитриол) и менее активной в виде 24,25(ОН)2D3. Кальцитриол характеризуется коротким периодом полураспада (4 ч) и не отражает состояние резервов витамина D в организме.
Реализация биологических эффектов витамина D осуществляется посредством связывания кальцитриола с рецепторами витамина D (VDR) и осуществления геномных и негеномных механизмов [1, 3, 5]. Экспрессия VDR почти во всех клетках человека подтверждает важную роль витамина D в лечении и профилактике широкого круга заболеваний [6,7].
Ген, кодирующий VDR, расположен в длинном плече хромосомы 12 (локус 12q12-q14) и состоит из 14 экзонов: 8 белок-кодирующих экзонов (2–9) и 6 нетранслируемых экзонов (1A–1F), расположенных на некодирующей 5’-области, и нескольких промоторных областей, которые представляют собой последовательности ДНК, распознаваемые РНК-полимеразой в качестве стартовой площадки для инициации специфической транскрипции [8–10]. Для гена VDR характерен генетический полиморфизм, т.е. существование различных аллельных вариантов этого гена в популяции [9]. Полиморфизмы гена способны изменять активность белка VDR и связаны с разнообразием физиологических и патологических фенотипов во многих популяциях. Одним из наиболее значимых полиморфизмов гена VDR, модулирующих биологические эффекты витамина D, является однонуклеотидный полиморфизм BsmI (A>G) гена VDR [9, 11]. Показано, что полиморфный вариант BsmI связан с активностью или экспрессией VDR, что может оказывать влияние на прямые и плейотропные эффекты витамина D [11]. Клинические проявления менопаузальных расстройств, фенотип коморбидной патологии могут быть обусловлены влиянием полиморфного варианта BsmI (A>G) гена VDR, что определяет актуальность предлагаемого исследования.
Цель исследования – оценить частоту выявления однонуклеотидного полиморфизма BsmI (A>G) гена VDR и обеспеченность витамином D в популяции женщин поздней постменопаузы, проживающих в г. Екатеринбурге, а также установить возможный генетический вклад в реализацию плейотропных эффектов витамина D после коррекции недостаточности и дефицита уровня 25(OH)D сыворотки крови нагрузочными и поддерживающими дозами колекальциферола.
МАТЕРИАЛ И МЕТОДЫ
В период с октября 2018 по март 2020 г. на базе ГБУЗ СО «Центральная городская клиническая больница № 6» в исследование были включены 100 женщин поздней постменопаузы в возрасте от 57 до 79 лет, самостоятельно проживающих в Екатеринбурге в течение 10 и более лет. Все участницы подписали информированное добровольное согласие на участие в исследовании. Критериями невключения в исследование были психические и когнитивные расстройства, затрудняющие контакт, резекция желудка или проксимальных отделов кишечника в анамнезе, необходимость в постороннем уходе.
У всех пациенток выполнялся унифицированный сбор жалоб и анамнеза, оценивались антропометрические данные: рост, вес, индекс массы тела (по формуле Кетле: ИМТ = масса тела, кг/ рост, м2), окружность талии (ОТ), окружность бедер (ОБ), расчет отношения ОТ/ОБ. ОТ и ОБ измерялись сантиметровой лентой с точностью до 0,1 см.
Концентрация 25(OH)D определялась методом электрохемилюминесцентного иммуноанализа (ECLIA). Интерпретация результатов этого исследования проводилась согласно классификации Российской ассоциации эндокринологов (РАЭ) [4]: адекватным уровнем считали концентрацию 25(OH) D более 30 нг/ мл, недостаточным – от 20 до 30 нг/мл, дефициту 25(OH) D соответствовал его уровень менее 20 нг/мл.
Для коррекции уровня 25(OH)D сыворотки крови применялась мицеллированная водорастворимая форма колекальциферола (препарат АкваДетрим, водный раствор 10 мл (15 000 МЕ/ мл), фирма-производитель Medana Pharma S.A., Польша). Коррекция уровня 25(OH)D сыворотки крови проводилась в соответствии с рекомендациями РАЭ 2015 г. [4]. При уровне 25(OH)D менее 20 нг/мл назначалась стандартная нагрузочная доза колекальциферола 7000 МЕ/сут продолжительностью 8 нед, при уровне от 20 до 30 нг/ мл – длительностью 4 нед. Далее применялась поддерживающая доза колекальциферола 2000 МЕ без перерыва на летние месяцы. Повторная оценка уровня 25(OH) D сыворотки крови выполнялась через 6 мес.
Материалом для молекулярно-генетического анализа служили образцы ДНК, выделенные из периферической венозной крови. Полиморфизм BsmI (rs1544410) гена VDR оценивался методом полимеразной цепной реакции в режиме реального времени с последующим рестрикционным анализом для определения генотипов BsmI (AA, AG, GG).
Оценка коморбидного статуса проводилась с использованием индекса коморбидности Чарлсон [12].
Диагностику артериальной гипертензии (АГ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности, заболеваний артерий нижних конечностей, сахарного диабета (СД) 2-го типа, остеоартрита, остеопороза выполняли по действовавшим в период проведения исследования федеральным клиническим рекомендациям [13–17].
Выраженность менопаузальных расстройств определялась с помощью модифицированного менопаузального индекса (ММИ) [18]. Диагностика когнитивных нарушений осуществлялась с применением краткой шкалы оценки психического статуса MMSE (Mini Mental State Examination) [19]. Выраженность тревоги и депрессии оценивали по шкале HADS (Hospital Anxiety and Depression Scale) [20], качество жизни – по опроснику SF-36v2 [21], валидизированному для использования на русском языке [22].
Статистическая обработка данных проводилась с помощью программного пакета STATISTICA 13.0. Для определения частот аллельных вариантов генов применялся закон Hardy–Weinberg. Учитывая, что характер распределения не соответствует нормальному, для сравнения несвязанных совокупностей использовался критерий Манна–Уитни, для сравнения связанных совокупностей – критерий Вилкоксона. В выборках были рассчитаны медианы, 25-й, 75-й процентили. Значимость различия частот оценивалась посредством точного критерия Фишера, χ2 Пирсона. Для оценки достоверности изменений использовался дисперсионный анализ (ANOVA) с повторными измерениями – метод с одним межгрупповым (генотип) и одним внутригрупповым (повторные изменения в ходе тестирования) факторами. Для внутригруппового сравнения применялся апостериорный метод наименьших значимых различий Фишера (Fisher’s LSD post hoc test), для проверки однородности дисперсии – критерий Ливена (Levene’s Test of Homogeneity of Variances). Различия данных считались статистически значимыми при значениях р <0,05.
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России 19.10.2018.
РЕЗУЛЬТАТЫ
Все пациентки на момент включения в исследование находились в позднем постменопаузальном периоде. Медиана возраста составила 67 лет (65–70), возраста наступления менопаузы – 50,0 лет (46,5–52,0), длительности менопаузы – 18 лет (15–21).
Естественное наступление менопаузы было отмечено у 82 женщин, из которых менопаузальную гормональную терапию (МГТ) получали 42 (51,2%) пациентки. Индуцированная менопауза имела место у 18 женщин, среди них МГТ получали 12 (66,6%) человек.
Медиана роста составила 156,0 см (153,5–159,5), массы тела – 71,8 кг (64,5–80,9), ИМТ – 29,0 кг/м (26,2–32,6), ОТ – 91,0 см (85,0–103,0), ОБ – 105,5 см (100,5–113,0), ОТ/ОБ – 0,86 (0,83–0,91).
Медиана концентрации 25(OH)D сыворотки крови обследованных составила 20,55 нг/мл (16,03–26,38). Адекватный уровень 25(OH)D был установлен в 17%, недостаточность – в 37%, дефицит – в 46% случаев, в том числе тяжелый дефицит у 4% пациенток. Генотип GG полиморфного маркера BsmI гена VDR был выявлен в 40%, AG – в 47%, AA – в 13% случаев. Доля аллеля G равнялась 63,5%, минорного аллеля А – 36,5%. Соотношение генотипов исследуемого полиморфизма соответствовало закону Hardy–Weinberg (χ2= 0,019; р >0,05). Распределение частот выявления генотипов, в зависимости от обеспеченности витамином D, представлено в таблице 1.
Медианы концентрации 25(OH)D составили 16,2 нг/мл (13,9–21,59), 22,3 нг/мл (17,5–29,7) и 20,0 нг/мл (15,1–24,8) у женщин с AA-, AG- и GG-генотипами соответственно. Статистические различия в отношении обеспеченности 25(OH) D были установлены для AA- и AG-генотипов полиморфного маркера BsmI гена VDR (p=0,039, критерий Манна–Уитни).
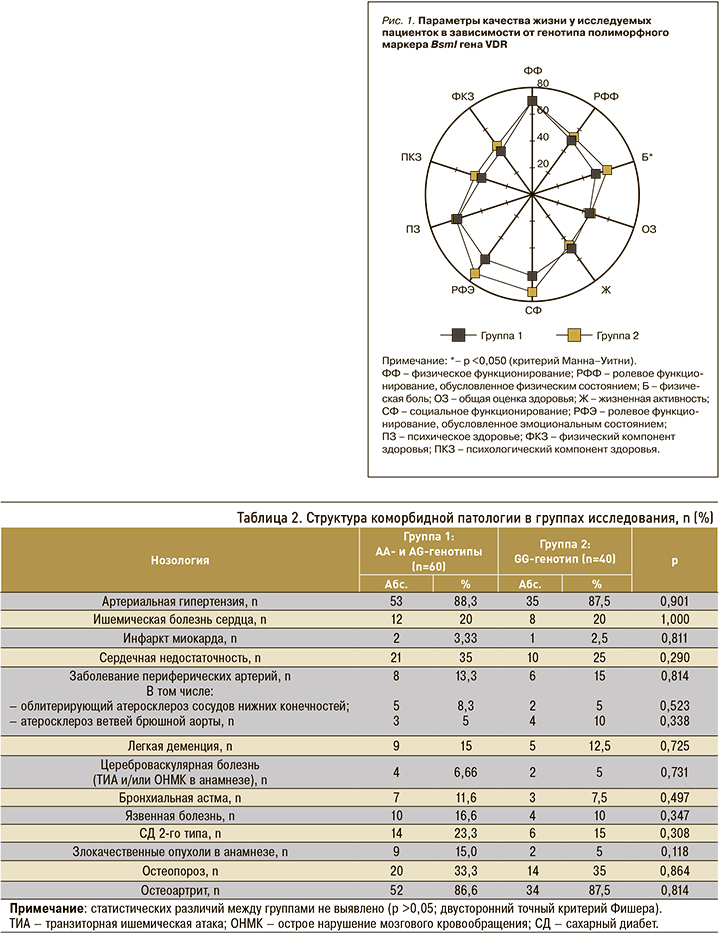
Был проведен сравнительный анализ коморбидности и основных клинических параметров в двух группах: у пациенток с АА- и AG-генотипами (группа 1, n=60) и GG-генотипом (группа 2, n=40). Структура коморбидной патологии исследуемых групп приведена в таблице 2.
Медиана индекса коморбидности Чарлсон в группе 1 составила 4 балла (3–5), в группе 2 – 3 балла (2–4). Различия были статистически значимы (p=0,042, критерий Манна–Уитни).
Группы статистически значимо различались и по выраженности менопаузальных расстройств, но не различались по возрасту, антропометрии, выраженности тревоги и депрессии и когнитивным функциям (табл. 3). Показатели тяжести менопаузальных расстройств по обменно-эндокринным и психоэмоциональным нарушениям были статистически значимо выше в группе 1.
Анализ частоты приливов, суставных, мышечных, головных болей, нарушений сна, утомляемости, раздражительности, нарушений памяти, плаксивости, входящих в оценку ММИ, не установил различий в группах (p >0,05). Рассеянность чаще отмечали пациентки в группе 1 – в 51 случае (85,0%) против 25 (62,5%) в группе 2 (двусторонний точный критерий Фишера; p=0,010).
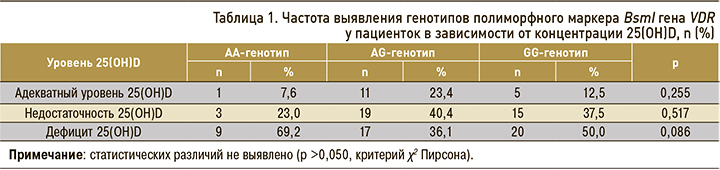
Анализ показателей качества жизни в группах представлен на рисунке 1. Статистически значимые различия были выявлены по шкале физической боли (p=0,025), по остальным шкалам различия не были значимыми (p >0,05).
Пациентки с адекватным уровнем 25(OH)D принимали поддерживающую дозу колекальциферола 2000 МЕ/сут в течение 6 мес. Оценка эффективности коррекции уровня витамина D была произведена у 70 пациенток: у 27 женщин с исходной недостаточностью уровня 25(OH)D и у 43 c его исходным дефицитом. Концентрация 25(OH)D статистически значимо увеличилась в обеих группах исследования (рис. 2).

Коррекция нагрузочными дозами колекальциферола с переходом на поддерживающую дозу 2000 МЕ способствовала достижению через 6 мес адекватного уровня 25(OH)D сыворотки крови у 10 пациенток (37,0%), исходно имевших недостаточность витамина D3, и у 22 пациенток (51,1%), исходно имевших дефицит витамина D3.
Далее была оценен клинический эффект применения нагрузочных и поддерживающих доз колекальциферола в течение 6 мес у 85 женщин позднего периода постменопаузы (у 70 женщин с исходным дефицитом и недостаточностью витамина D3 и 15 женщин с исходным адекватным его уровнем). Дисперсионный анализ ANOVA с повторными измерениями (рис. 3) установил статистические различия в отношении выраженности когнитивных расстройств в зависимости от генотипа полиморфного маркера BsmI гена VDR (ANOVA: F(2,81)=3,533; p=0,033). Парные сравнения выявили значимое повышение показателей теста MMSE после коррекции колекальциферолом среди пациенток, имеющих AA-генотип BsmI полиморфизма гена VDR (p=0,001, Fisher’s LSD post hoc test).
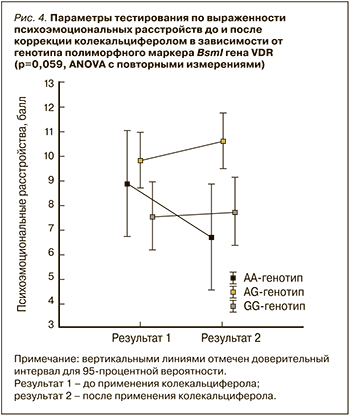
При сравнении между генотипами BsmI гена VDR в отношении психоэмоциональных расстройств (рис. 4) различия были близки к значимым (ANOVA: F(2,82)=2,918, p=0,059). Парные сравнения установили значимое снижение выраженности психоэмоциональных расстройств после коррекции колекальциферолом среди пациенток, имеющих AA-генотип BsmI полиморфизма гена VDR (p=0,027, Fisher’s LSD post hoc test). В отношении AG- и GG-генотипов внутригрупповых различий для повторных измерений выявлено не было (p >0,05, Fisher’s LSD post hoc test).
Параметры нейровегетативных и обменно-эндокринных компонентов ММИ, выраженности тревоги и депрессии, а также качества жизни после применения колекальциферола у пациенток с различными результатами молекулярно-генетического тестирования не различались (p >0,05, ANOVA с повторными измерениями).
ОБСУЖДЕНИЕ
По данным эпидемиологических исследований, высокая распространенность дефицита витамина D продемонстрирована для европейского населения различного возраста: уровень 25(ОН)D сыворотки крови ниже 20 нг/мл обнаружен у 40,4% обследованных, ниже 12 нг/мл – у 13% [23]. Согласно результатам недавнего российского многоцентрового неинтервенционного регистрового исследования лиц в возрасте от 18 до 50 лет, частота D-гиповитаминоза на территории нашей страны в целом составила 72,1% случаев (дефицит и недостаточность 25(OH)D сыворотки крови встречались в 39,3 и 32,8% соответственно), при этом в зависимости от региона этот показатель варьировал в диапазоне от 60,8% (Владивосток) до 86,3% (Кызыл) [24]. В настоящем исследовании D-гиповитаминоз встречался в 83% случаев (в 46% – дефицит, в 37% – недостаточность 25(OH)D в сыворотке крови), однако в отличие от предыдущих исследований в нашу выборку не включались мужчины, а возраст обследованных женщин был старше 50 лет. Такая частота низкой обеспеченности витамином D у женщин в постменопаузе может быть обусловлена следующими особенностями: возрастным уменьшением содержания 7-дегидрохолестерола (предшественника витамина D3) эпидермиса [25], нарушением эстрогензависимой активации 1α-гидроксилазы, участвующей в синтезе кальцитриола [26], снижением экспрессии VDR (из-за снижения активации ERK сигнального пути) [27], а также депонированием витамина D в жировой ткани [28]. Немаловажным фактором выступает также увеличение частоты коморбидных заболеваний и количества принимаемых женщинами препаратов, оказывающих потенциальное влияние на метаболизм витамина D [17, 29].
Проведенные популяционно-генетические исследования жителей России установили варьирование доли минорной A-аллели от 7,3 до 45,7% [30]. В настоящем исследовании популяции пациенток поздней постменопаузы наиболее распространенным оказался AG-генотип (47%), самым редким – AA-генотип (13%), тогда как доля A-аллели составила 36,5%. Полученные данные совпадают с предыдущими результатами, установленными для русских [30] и европейских этнических групп [31–34]. По данным А.Н. Волкова и Е.В. Цуркан, у жителей Кемеровской области (125 мужчин и 107 женщин) GG-генотип полиморфизма BsmI гена VDR выявлен в 40,1%, AG-генотип – в 46,1%, AA-генотип – в 13,8% случаев [30], что соответствует нашим результатам. Похожие данные были получены в выборке 525 женщин постменопаузального периода Донецкой Народной Республики, где на долю GG-генотипа приходилось 38,5%, AG-генотипа – 48,2%, AA-генотипа – 13,3%, а доля A-аллели составила 37% [31]. Обследование 449 жительниц Санкт-Петербурга 35–55 лет установило частоту GG-генотипа в 24,3%, AG-генотипа – в 57,7%, AA-генотипа – в 18%; доля минорной A-аллели равнялась 46,8% [35]. Сравнение распределения генотипов в исследовании Т.Л. Кароновой и соавт. с нашими результатами обнаружило статистические различия (p=0,006; χ2=10,339). Следует отметить, что в указанное исследование включались пациентки до наступления менопаузы, не имевшие патологии эндокринной и сердечно-сосудистой системы, не принимавшие препараты, способные оказывать влияние на метаболизм витамина D. Преобладание GG-генотипа продемонстрировано для жительниц Москвы [36] (n=60 женщин в постменопаузе: частота GG-генотипа – 46,7%, AG-генотипа – 41,7%, AA-генотипа – 11,7%) и для этнических русских – уроженцев европейской части России [37] (n=96: GG-генотип – 51,0%, AG-генотип – 41,7%, AA-генотип – 7,3%).
В нашем исследовании не установлено ассоциаций исследуемых полиморфизмов с коморбидной патологией. В целом подобных продольных исследований, изучающих влияние применения колекальциферола на выраженность менопаузальных, когнитивных расстройств, тревогу, депрессию и качество жизни, не проводилось. Ограничением нашего исследования стало отсутствие данных по двум смежным однонуклеотидным полиморфизмам гена VDR – ApaI (rs7975232) и TaqI (rs731236), которые также актуальны для изучения в отношении фенотипа коморбидной патологии.
ЗАКЛЮЧЕНИЕ
В нашем исследовании продемонстрирована возможная протективная роль G-аллели полиморфного маркера BsmI VDR в отношении индекса коморбидности Чарлсон, менопаузальных расстройств и качества жизни пациенток поздней постменопаузы. У женщин, гомозиготных по минорной A-аллели, выявлено увеличение когнитивных способностей по шкале MMSE и снижение выраженности психоэмоциональных расстройств ММИ после применения стандартных нагрузочных и поддерживающих доз колекальциферола. Полученные данные требуют продолжения исследований в этой области с учетом как этнических факторов, так и генетических детерминант для полноценной реализации плейотропных эффектов D-эндокринной системы.



