1) ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва;
2) ФГБУ «Федеральный центр мозга и нейротехнологий» ФМБА России, г. Москва;
3) ГБУЗ «Госпиталь для ветеранов войн № 3» Департамента здравоохранения г. Москвы;
4) БУЗ ВО «Воронежская областная клиническая больница № 1»
Аннотация. В статье обсуждаются междисциплинарные кардиологические и неврологические аспекты варианта острой гипертонической энцефалопатии – синдрома задней обратимой энцефалопатии (СЗОЭ). Цель обзора – обратить внимание врачей на этот редкий синдром как возможное осложнение гипертонического криза и острой гипертонической энцефалопатии. Быстрое распознавание и лечение способно предотвратить трансформацию СЗОЭ, в основе которого лежит вазогенный отек головного мозга, в тяжелые неврологические осложнения. В материале анализируются клинико-радиологические признаки типичного СЗОЭ и его атипичные проявления, обращено внимание на возможность развития «центрального варианта» синдрома с клинико-радиологической диссоциацией, геморрагической трансформации и иных осложнений. Основное направление лечения при развитии СЗОЭ вследствие гипертонического криза – поэтапное снижение артериального давления (АД). В первые 2–4 ч оптимальным является снижение АД не более чем на 20–25% от первоначальных значений, с последующим доведением до оптимальных показателей на протяжении 24 ч.
синдром задней обратимой энцефалопатии
артериальная гипертензия
гипертонический криз
острая гипертоническая энцефалопатия
отек головного мозга
ауторегуляция мозгового кровообращения
почечная/печеночная недостаточность
компьютерная томография
магнитно-резонансная томография
ВВЕДЕНИЕ
Синдром задней обратимой энцефалопатии (СЗОЭ; posterior reversible encephalopathy syndrome – PRES) – это остро/подостро возникающие клинико-радиологические нарушения, морфологической основой которых является вазогенный отек головного мозга. Термин СЗОЭ был введен в клиническую практику в 1996 г. Hinchey J. et al. [1]. Авторы описали 15 пациентов с разными заболеваниями/патологическими состояниями (эклампсия, волчаночный нефрит, печеночная и почечная недостаточность, применение иммуносупресивной терапии по поводу онкологических процессов или пересадки органов), но с одинаковой клинико-радиологической картиной, включавшей обратимые (при условии адекватного лечения) неврологические и нейровизуализационные симптомы. К настоящему времени установлено, что факторами риска развития СЗОЭ служат различные заболевания, эндогенные и экзогенные токсические воздействия, прием лекарственных средств с цитотоксическим и/или иммуносупрессивным эффектом и др. [2]. Несмотря на многочисленность факторов риска, СЗОЭ в МКБ-10 отнесен к разделу «Болезни системы кровообращения» (I67.83), а в МКБ-11 включен в раздел цереброваскулярных заболеваний (блок 8B22 – «Некоторые уточненные цереброваскулярные болезни», код 8В22.Y), так как в большинстве случаев его развитие происходит вследствие внезапного и значительного повышения артериального давления (АД) – гипертонического криза [1, 3].
КЛИНИЧЕСКИЕ И НЕЙРОВИЗУАЛИЗАЦИОННЫЕ ПРОЯВЛЕНИЯ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ
Ведущими клиническими симптомами СЗОЭ выступают расстройства сознания (снижение его уровня, эпизоды психомоторного возбуждения), эпилептические приступы, интенсивная головная боль, зрительные нарушения (нечеткость зрения, гемианопсия, зрительная агнозия) и др., которые часто развиваются на фоне внезапного подъема АД [2, 4, 5]. При тяжелом течении СЗОЭ в клинической картине доминируют угнетение сознания вплоть до комы и очаговые симптомы [1, 6]. При легкой форме синдрома может наблюдаться только один клинический симптом, например, головная боль или однократный эпилептический приступ [7].
Компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) являются необходимыми методами диагностики СЗОЭ, позволяющими выявить его морфологическую основу – вазогенный отек головного мозга. При классическом варианте СЗОЭ (до 70% всех наблюдений) вазогенный отек мозга локализуется в теменно-затылочных отделах больших полушарий. На КТ он представлен зонами низкой плотности (рис. 1). Методом выбора для окончательной диагностики СЗОЭ служит МРТ. Вазогенный отек головного мозга хорошо визуализируется в режиме МРТ FLAIR (инверсия–восстановление с подавлением сигнала от воды) в виде гиперинтенсивного сигнала (рис. 2) [8, 9].
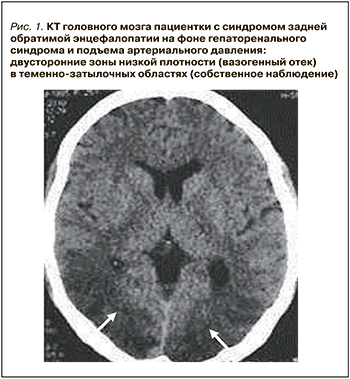
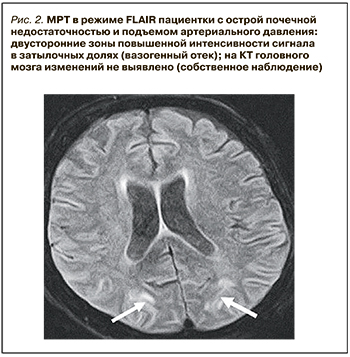
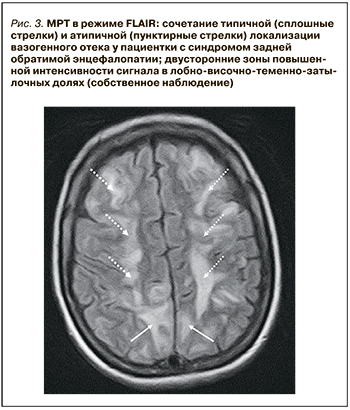
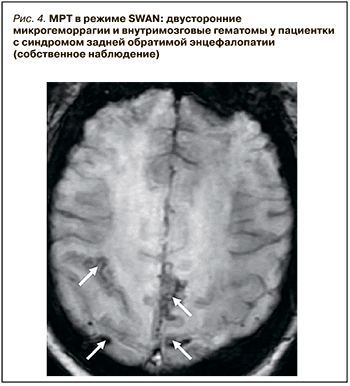
Активное применение КТ и МРТ позволило расширить представления о нейровизуализационных особенностях СЗОЭ. Так, к настоящему времени установлена возможность вовлечения в патологический процесс не только белого (лейкоэнцефалопатия), но и серого вещества головного мозга. Кроме классической локализации, изменения при СЗОЭ могут быть и в других отделах больших полушарий, подкорковых структурах, стволе и мозжечке (рис. 3) [10–12]. Значительно реже наблюдается односторонняя или асимметричная локализация СЗОЭ [13, 14]. Возможно также изолированное поражение ствола головного мозга или подкорковых структур без вовлечения классических зон [15, 16]. Кроме этого, показана возможность развития цитотоксического отека и ишемических изменений [9], микрокровоизлияний, внутримозговых и субарахноидальных кровоизлияний (рис. 4) [17]. Согласно данным Liman T.G. et al. [18], существует положительная связь между обширностью вазогенного отека головного мозга и вероятностью развития геморрагических осложнений.
ПАТОГЕНЕЗ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ
Патогенез СЗОЭ до конца не изучен. Синдром развивается на фоне различных заболеваний/патологических состояний, механизмы действия которых объединены в три гипотезы: вазогенную, токсическую и иммунную [19, 20]. Эти механизмы отдельно или в сочетании друг с другом приводят к эндотелиальной дисфункции мелких сосудов [21] и повышению проницаемости гематоэнцефалического барьера (ГЭБ) с формированием вазогенного отека головного мозга [7].
АУТОРЕГУЛЯЦИЯ МОЗГОВОГО КРОВОТОКА
В физиологических условиях у нормотоников стабильный мозговой кровоток сохраняется в пределах ≈60–150 мм рт.ст. среднего АД. Ниже и выше этих значений в большинстве случаев происходит срыв ауторегуляции, и мозговой кровоток соответственно уменьшается или возрастает. У лиц, страдающих артериальной гипертензией (АГ), нижние и верхние границы ауторегуляции могут смещаться вправо. В основе ауторегуляции мозгового кровотока лежат метаболический, миогенный и нейрогенный механизмы. Изменение АД сначала активирует гладкие мышцы сосудов, которые изменяют сосудистое сопротивление посредством вазодилатации (при снижении АД) или вазоконстрикции (при повышении АД) [22]. При недостаточности этого механизма активируется нейрогенный компонент, чья эффективность зависит от степени симпатической иннервации сосудов [22, 23].
НЕВРОЛОГИЧЕСКИЕ ОСЛОЖНЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
АГ относится к основным факторам риска развития сосудистых осложнений, а головной мозг – это одна из главных мишеней при этом заболевании [24]. Поражение мозга при АГ представлено как хроническими, так и острыми состояниями; последние включают острую гипертоническую энцефалопатию (код МКБ 10 – I67.4), одним из проявлений которой может быть СЗОЭ (рис. 5).
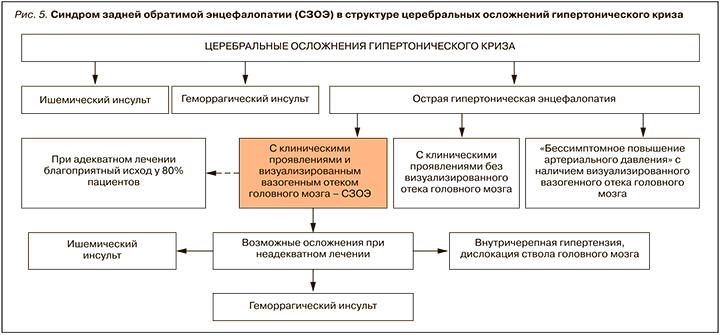
АГ у пациентов с СЗОЭ отмечается в 70–80% наблюдений [1, 2]. Важным как для лечения, так и предупреждения рецидивов СЗОЭ видится выявление и установление причины АГ. Иллюстрацией может служить наблюдение Babici D. et al. [25], в котором рецидив СЗОЭ вследствие высокого и плохо контролируемого АД наблюдался у пациентки со стенозом почечной артерии.
При анализе роли АГ в развитии СЗОЭ также следует учитывать не только абсолютные показатели АД, но и скорость его повышения. У лиц без анамнестических указаний на АГ особое внимание необходимо обращать на впервые в жизни развившийся гипертонический криз. В этих случаях срыв ауторегуляции мозгового кровотока возможен при менее значительном подъеме АД [26].
В ряде исследований указывается на связь между фоновым заболеванием/патологическим состоянием и степенью повышения АД, которое вызывает вазогенный отек головного мозна. Так, по данным Liman T.G. et al. [18], более высокие показатели среднего АД при развитии СЗОЭ регистрируются у больных с инфекционными осложнениями, эклампсией и аутоиммунными нарушениями, по сравнению с пациентами, получающими химио- или иммуносупрессивную терапию. Возможно, это обусловлено тем, что у пациентов на химио- или иммуносупрессивной терапии менее высокое, но индивидуально значимое повышение АД может играть роль триггера, активируя фоновую дисфункцию эндотелия, вызванную токсическими, иммунными и иными процессами.
Обширность отека головного мозга при СЗОЭ может быть в определенной степени связана с показателями АД до развития СЗОЭ. Так, Lee M.K. et al. [27] отмечают, что у пациентов с рабочими значениями среднего АД ≥99,7 мм рт.ст. площадь отека мозга при развитии СЗОЭ была достоверно больше, чем у пациентов с более низким средним АД (<99,7 мм рт.ст.). Также выявляется связь между степенью повышения систолического АД во время развития СЗОЭ, обширностью вазогенного отека головного мозга и последующим регрессом радиологических изменений [18].
МЕХАНИЗМ РАЗВИТИЯ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ ПРИ ГИПЕРТОНИЧЕСКОМ КРИЗЕ
Быстрый и значительный подъем АД приводит к нарушению компенсаторных вазоконстрикторных механизмов и вызывает пассивное растяжение мелких церебральных сосудов [22, 23]. Это способствует повышению проницаемости ГЭБ и развитию вазогенного отека головного мозга [28]. При этом имеется положительная корреляция между быстротой и степенью подъема АД и повышением проницаемости ГЭБ [29]. В тяжелых случаях ГЭБ становится проницаем и для форменных элементов крови, что влечет за собой кровоизлияния.
Согласно результатам ряда исследований [3, 30], быстрое и значительное повышение АД играет роль разрешающего фактора не только при вазогенном, но и при токсико-иммунологическом механизме формирования СЗОЭ. Это подтверждается тем, что снижение АД в большинстве случаев приводит к быстрому регрессу или исчезновению клинических проявлений СЗОЭ, несмотря на сохранение фонового заболевания. В то же время важно отметить, что развитие СЗОЭ, включая геморрагические осложнения, может наблюдаться и у пациентов без повышения АД.
Несмотря на системное повышение АД, различные отделы головного мозгв при СЗОЭ страдают избирательно: изменения выявляются преимущественно в задних отделах больших полушарий, что связывают с особенностями симпатической/парасимпатической иннервации вертебробазилярных сосудов по сравнению с сосудами каротидной системы [31, 32].
ОСНОВНЫЕ НАПРАВЛЕНИЯ ЛЕЧЕНИЯ БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ
При описании первых пациентов с СЗОЭ Hinchey J. et al. [1] подчеркивали, что его лечение должно состоять из выявления и коррекции/устранения факторов риска, а также симптоматической терапии, включая нормализацию АД.
Снижение АД – основное направление неотложного лечения СЗОЭ, развившегося вследствие гипертонического криза (рис. 6). В этом случае рекомендуется снижение среднего АД на 20–25% от исходного уровня в первые 2–4 ч и дальнейшее постепенное его снижение на протяжении 24 ч до оптимальных для пациента показателей [33]. Следует иметь в виду, что более быстрое снижение АД может привести к гипоперфузии и ишемии головного мозга.

До настоящего времени вследствие редкости СЗОЭ не проведено клинических исследований относительно эффективности отдельных групп антигипертензивных средств при этом синдроме. В связи с этим рекомендуются препараты, применяемые для купирования гипертонического криза [33, 34]. Во всех случаях необходимо выполнять поиск причин АГ.
Наряду с этапным снижением АД, чрезвычайно значимы контроль и максимальная коррекция фонового заболевания, приема химиотерапевтических, иммуносупрессивных и иных препаратов. Также обязательно симптоматическое лечение: проведение противосудорожной терапии при эпилептических приступах, купирование головной боли и иных клинических проявлений (см. рис. 6).
Несвоевременная диагностика и неадекватное лечение СЗОЭ может сопровождаться развитием стойких осложнений в виде ишемического или геморрагического инсульта, дислокации ствола головного мозга, а также летального исхода. По данным Hefzy H.M. et al. [17], неблагоприятный исход СЗОЭ отмечается в 20–25% случаев и в большинстве наблюдений обусловлен усугублением фонового заболевания, включая развитие/нарастание полиорганной недостаточности.
ЗАКЛЮЧЕНИЕ
СЗОЭ, выступая проявлением острой гипертонической энцефалопатии, может быть одним из серьезных осложнений гипертонического криза. Морфологической основой этого синдрома служит вазогенный отек головного мозга, который может иметь как типичную, так и атипичную локализацию. Основным направлением неотложной терапии при развитии СЗОЭ на фоне гипертонического криза является этапная нормализация АД. Серьезными осложнениями СЗОЭ могут быть геморрагические и/или ишемические инсульты, внутричерепная гипертензия, выраженный отек с дислокацией ствола головного мозга, усугубление течения основного заболевания и летальный исход.
- Hinchey J., Chaves C., Appignani B. et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med. 1996; 334(8): 494–500. https://dx.doi.org/10.1056/nejm/199602223340803.
- Li K., Yang Y., Guo D. et al. Clinical and MRI features of posterior reversible encephalopathy syndrome with atypical regions: A descriptive study with a large sample size. Front. Neurol. 2020; 11: 194. https://dx.doi.org/10.3389/fneur.2020.00194.
- Богданов Э.И., Хасанов И.А. Синдром задней обратимой энцефалопатии и артериальная гипертензия. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020; 120(6): 17–23.
- Гудкова В.В., Кимельфельд Е.И., Стаховская Л.В. Малоизвестный синдром задней обратимой энцефалопатии, требующий неотложной помощи. Consilium Medicum. 2018; 20(2): 84–89.
- Chen X., Zhao J.G., Gao B. et al. Posterior reversible encephalopathy syndrome with a special focus on seizures. J Clin Neurosci. 2022; 95(1): 38–43. https://dx.doi.org/10.1016/j.jocn.2021.11.009.
- Bartynski W.S. Posterior reversible encephalopathy syndrome, Part 1: Fundamental imaging and clinical. AJNR Am J Neuroradiol. 2008; 29(6): 1036–42. https://dx.doi.org/10.3174/ajnr.A0928.
- Fugate J.E., Rabinstein A.A. Posterior reversible encephalopathy syndrome: Clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. 2015; 14(9): 914–25. https://dx.doi.org/10.1016/s1474-4422(15)00111-8.
- Casey S.O., Sampaio R.C., Michel E. et al. Posterior reversible encephalopathy syndrome: utility of fluid-attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions. AJNR Am J Neuroradiol. 2000; 21(7): 1199–206.
- Kastrup O., Schlamann M., Moenninghoff C. et al. Posterior reversible encephalopathy syndrome: The spectrum of MR imaging patterns. Clin Neuroradiol. 2015; 25(2): 161–71. https://dx.doi.org/10.1007/s00062-014-0293-7.
- Lee V., Wijdicks E., Manno E., Rabinstein A. Clinical spectrum of reversible posterior leukoencephalopathy syndrome. Arch Neurol. 2008; 65(2): 45–46. https://dx.doi.org/10.1001/archneurol.2007.46.
- Stevens C.J., Heran M.K. The many faces of posterior reversible encephalopathy syndrome. Br J Radiol. 2012; 85(2020): 1566–75. https://dx.doi.org/10.1259/bjr/25273221.
- McKinney A.M., Jagadeesan B.D., Truwit C.L. Central-variant posterior reversible encephalopathy syndrome: Brainstem or basal ganglia involvement lacking cortical or subcortical cerebral edema. AJR. 2013; 201(3): 631–38. https://dx.doi.org/10.2214/AJR.12.9677.
- Скворцова В.И., Губский Л.В., Мельникова Е.А. Синдром задней обратимой энцефалопатии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2010; 5: 104–109.
- Ozawa T., Tanaka R., Nagaoka R. et al. Data on characteristics of reported cases of unilateral posterior reversible encephalopathy syndrome (PRES). Data Brief. 2019; 27: 104648. https://dx.doi.org/10.1016/j.dib.2019.104648.
- Liu C., Cao J., Su Z., Xu S. Isolated brainstem involvement in posterior reversible encephalopathy syndrome: A case report and review of the literature. Int J Neurosci. 2019; 129(8): 808–13. https://dx.doi.org/10.1080/00207454.2018.1561452.
- Chaudhari D.M., Renjen P.N., Goyal N., Mishra A. Central variant reversible encephalopathy syndrome. BMJ Case Rep. 2022; 15(2): e245636. https://dx.doi.org/10.1136/bcr-2021-245636.
- 1Hefzy H.M., Bartynski W.S., Boardman J.F., Lacomis D. Hemorrhage in posterior reversible encephalopathy syndrome: Imaging and clinical features. AJNR Am J Neuroradiol. 2009; 30(7): 1371–79. https://dx.doi.org/10.3174/ajnr.A1588.
- Liman T.G., Bohner G., Heuschmann P.U. et al. The clinical and radiological spectrum of posterior reversible encephalopathy syndrome: The retrospective Berlin PRES study. J Neurol. 2012; 259(1): 155–64. https://dx.doi.org/10.1007/s00415-011-6152-4.
- Bartynski W.S. Posterior reversible encephalopathy syndrome, part 2: Controversies surrounding pathophysiology of vasogenic edema. AJNR Am J Neuroradiol. 2008; 29(6): 1043–49. https://dx.doi.org/10.3174/ajnr.A0929.
- Chen Z., Shen G.Q., Lerner A., Gao B. Immune system activation in the pathogenesis of posterior reversible encephalopathy syndrome. Brain Res Bull. 2017; 131: 93–99. https://dx.doi.org/10.1016/j.brainresbull.2017.03.012.
- Marra A., Vargas M., Striano P. et al. Posterior reversible encephalopathy syndrome: the endothelial hypotheses. Med Hypotheses. 2014; 82(5): 619–22. https://dx.doi.org/10.1016/j.mehy.2014.02.022.
- Ainslie P.N., Ashmead J.C., Ide K. et al. Differential responses to CO2 and sympathetic stimulation in the cerebral and femoral circulations in humans. J Physiol. 2005; 566 (Pt 2): 613–24. https://dx.doi.org/10.1113/jphysiol.2005.087320.
- Mayhan W.G., Werber A.H., Heistad D.D. Protection of cerebral vessels by sympathetic nerves and vascular hypertrophy. Circulation. 1987; 75(1 Pt 2): 107–12.
- Maillard P., Seshadri S., Beiser A. et al. Effects of systolic blood pressure on white-matter integrity in young adults in the Framingham Heart Study: A cross-sectional study. Lancet Neurol. 2012; 11(12): 1039–47. https://dx.doi.org/10.1016/S1474-4422(12)70241-7.
- Babici D., Hindi F., Hanafy K.A. Posterior reversible encephalopathy syn-drome due to unilateral renal artery stenosis: A case report. Brain Circ. 2022; 8(2): 108–11. https://dx.doi.org/10.4103/bc.bc_14_22.
- Claassen J.A.H.R., Thijssen D.H.J., Panerai R.B., Faraci F.M. Regulation of cerebral blood flow in humans: Physiology and clinical implications of autoregulation. Physiol Rev. 2021; 101(4): 1487–559. https://dx.doi.org/10.1152/physrev.00022.2020.
- Lee M.K., Cho Y.J., Lee S.K. et al. The effect of presymptomatic hypertension in posterior reversible encephalopathy syndrome. Brain Behav. 2018; 8(8): e01061. https://dx.doi.org/10.1002/brb3.1061.
- Johansson B. Brain barrier pathology in acute arterial hypertension. Adv Exp Med Biol. 1976; 69: 517–27. https://dx.doi.org/10.1007/978-1-4684-3264-0_38.
- Ziylan Y.Z. Pathophysiology of the opening of the blood-brain and blood-cerebrospinal fluid barriers in acute hypertension. Exp Neurol. 1984; 84(1): 18–28. https://dx.doi.org/10.1016/0014-4886(84)90002-5.
- Gowan J.M., Liu A. Isolated pan-pontine posterior reversible encephalopathy syndrome in a patient with uncontrolled hypertension. Clin Case Rep. 2019; 7(1): 32–36. https://dx.doi.org/10.1002/ccr3.1888.
- Beausang-Linder M., Bill A. Cerebral circulation in acute arterial hypertension – protective effects of sympathetic nervous activity. Acta Physiol Scand. 1981; 111(2): 193–99. https://dx.doi.org/10.1111/j.1748-1716.1981.tb06724.x.
- Roloff E.V., Tomiak-Baquero A.M., Kasparov S., Paton J.F. Parasympathetic in-nervation of vertebrobasilar arteries: Is this a potential clinical target? J Physiol. 2016; 594(22): 6463–85. https://dx.doi.org/10.1113/JP272450.
- Cantone M., Lanza G., Puglisi V. et al. Hypertensive crisis in acute cerebrovas-cular diseases presenting at the emergency department: A narrative review. Brain Sci. 2021; 11(1): 70. https://dx.doi.org/10.3390/brainsci 11010070.
- Кобалава Ж.Д., Конради А.О., Недогода С.В. с соавт. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020; 25(3): 149–218.
Михаил Юрьевич Мартынов, д.м.н., профессор, член-корр. РАН, первый зам. директора ФГБУ «Федеральный центр мозга и нейротехнологий» ФМБА России, профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 119415, г. Москва, ул. Лобачевского, д. 42, стр. 6. E-mail:
m-martin@inbox.ru.
ORCID: https://orcid.org/0000-0003-2797-7877
Валентина Владимировна Гудкова, к.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 119415, г. Москва, ул. Лобачевского, д. 42, стр. 6. E-mail:
gudkova.valentina@gmail.com.
ORCID: https://orcid.org/0000-0002-9646-9131
Евгения Александровна Кольцова, к.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 119415, г. Москва, ул. Лобачевского, д. 42, стр. 6. E-mail:
koltsovaevgenia@rambler.ru.
ORCID: https://orcid.org/0000-0001-6459-2656
Ольга Дмитриевна Разинская, ассистент кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 119415, г. Москва, ул. Лобачевского, д. 42, стр. 6. E-mail:
july2000@mail.ru. ORCID: https://orcid.org/0000-0002-6531-0814
Наталья Николаевна Абраменкова, врач-невролог 8-го неврологического отделения для больных с ОНМК ГБУЗ «Госпиталь для ветеранов войн № 3» Департамента здравоохранения г. Москвы. Адрес: 129336, г. Москва, ул. Стартовая, д. 4. E-mail:
vedmochka@mail.ru
Евгений Сергеевич Солнцев, врач-невролог 8-го неврологического отделения для больных с ОНМК ГБУЗ «Госпиталь для ветеранов войн № 3» Департамента здравоохранения г. Москвы. Адрес: 129336, г. Москва, ул. Стартовая, д. 4. E-mail:
solntsev.jenyok21@yandex.ru
Дмитрий Игоревич Ульянов, зав. неврологическим отделением ГБУЗ «Госпиталь для ветеранов войн № 3» Департамента здравоохранения г. Москвы. Адрес: 129336, г. Москва, ул. Стартовая, д. 4. E-mail:
ulan.11n.com@inbox.ru
Светлана Евгеньевна Чуприна, зав. неврологическим отделением для больных с нарушением мозгового кровообращения БУЗ ВО «Воронежская областная клиническая больница № 1». Адрес: 394066, г. Воронеж, Московский проспект, д. 151А. E-mail:
chuprinasveta@mail.ru. ORCID: https://orcid.org/0000-0002-2103-3771









