ИСТОРИЯ ВОПРОСА
Тесная связь между хронической сердечной недостаточностью (ХСН) и заболеваниями почек привлекает пристальное внимание специалистов многих специальностей. Академик Евгений Михайлович Тареев в фундаментальном научном труде «Нефриты» (1958) отмечал при ХСН наличие застойной почки, подчеркивая при этом, что проблема значительно шире, чем только застой в большом круге кровообращения [1]. Dzau V. (2005) сформулировал концепцию сердечно-сосудистого континуума [2], в рамках которого развивается сердечная и почечная недостаточность. Состояние ренин-ангиотензин-альдостероновой системы (РААС) имеет важное значение на всех этапах сердечно-сосудистого континуума [3]. В 2005 г. А.В. Смирнов с соавт. [4] предложили концепцию кардиоренального континуума, где патология почек, с одной стороны, и сердца, с другой, имеют общие факторы риска и взаимно отягощают друг друга. Итальянский нефролог Ronco С. (2018) обосновал выделение кардиоренального синдрома [5], согласно которому не заболевание одного органа приводит к заболеванию другого, а недостаточность приводит к недостаточности. В настоящее время предлагается выделять фенотипы (профили, кластеры) ХСН [6, 7], т.е. ХСН с коморбидностью и особенностями течения, что важно для начала лечения и подбора доз препаратов.
Не вызывает сомнений необходимость учитывать функциональное состояние почек при лечении пациентов с ХСН [8, 9]. Наибольшие проблемы при ведении пациентов с ХСН и хронической болезнью почек (ХБП) возникают при блокаде РААС, что и обсуждается в настоящем обзоре.
РАСПРОСТРАНЕННОСТЬ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
Распространенность ХБП в общей популяции увеличивается с возрастом и сопоставима с распространенностью сердечно-сосудистых заболеваний и сахарного диабета [10–12]. Согласно ежегодному отчету почечного фонда США (USRDS), распространенность ХБП в старшей возрастной группе примерно в 4 раза выше, чем у молодых, и составляет 33,2% в общей популяции пациентов пожилого и старческого возраста. Сердечная недостаточность наблюдается приблизительно в четыре раза чаще в популяции с ХБП по сравнению с пациентами без ХБП. Распространенность ХСН примерно в 1,5 раза выше у пациентов с ХБП 4–5 стадии, чем при 3 стадии [13]. Частота ХБП у пациентов пожилого и старческого возраста с ХСН находится в пределах от 56 до 61,3%, причем у них преобладает СН с сохранной фракцией выброса (СНсФВ) [14, 15].
ДИАГНОСТИКА ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ И ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
Диагностика ХБП основана на выявлении нарушений структуры или функции почек или маркеров повреждения почек, персистирующих 3 и более месяца. C высокой вероятностью наличие ХБП можно предполагать у пациентов с сахарным диабетом, артериальной гипертонией (АГ) и другими сердечно-сосудистыми заболеваниями. Всем таким пациентам рекомендуется определять расчетную скорость клубочковой фильтрации (рСКФ) и альбуминурию (чаще отношение альбумин/креатинин в моче) [12, 16]. Эффективность и рентабельность скрининга доказана на популяции высокого риска развития и прогрессирования ХБП (пациенты с сердечно-сосудистой патологией, сахарным диабетом, отягощенным анамнезом) [17].
В реальной практике у пациентов с сахарным диабетом и АГ определение альбуминурии/протеинурии проводится лишь в половине случаев [13], при этом наличие повышенной альбуминурии/протеинурии у пациентов пожилого и старческого возраста ассоциируется с высоким риском прогрессирования ХБП и летальности [18]. Смертность в популяции увеличивается также при рСКФ более 60 мл/мин/1,73м2 [19]. Принимая во внимание значение альбуминурии как фактора сердечно-сосудистого риска, эксперты Европейской почечной ассоциации в 2022 г. предложили определять этот показатель не только в группе с исходно высоким уровнем кардиоваскулярного риска, но и на начальном этапе его оценки [20]. В то же время рутинный популяционный скрининг на наличие ХБП может приводить к значительным затратам, гипердиагностике и ухудшать качество жизни пациентов [21].
Следует особо подчеркнуть, что для верификации ХБП необходимо подтверждение выявленных изменений на протяжении не менее 3 мес, что в широкой клинической практике не всегда выполняется. По изолированному снижению рСКФ в течение указанного срока наблюдения диагноз «ХБП» возможно установить только при значениях этого показателя менее 60 мл/мин/1,73м2. Для диагностики ХБП 1 и 2 стадии нужны маркеры повреждения почек [12, 16].
При ведении пожилых пациентов, помимо оценки рСКФ и альбуминурии, необходимо учитывать коморбидность и геронтологический статус (старческая астения, когнитивные нарушения, способность к самообслуживанию) [22]. Принимая во внимание сложность и неоднозначность подхода к пациентам старшей возрастной группы при диагностике ХБП, совместная инициатива Европейской почечной ассоциации – Европейской ассоциации диализа и трансплантации (ERA-EDTA) и Европейского союза обществ гериатрической медицины (EUGMS) разработала клинические рекомендации по лечению пожилых пациентов с ХБП стадии 3б и выше: в них предлагается использовать формулу на основе креатинина и цистатина С (CKD-EPIcr-cys) как наиболее приемлемую альтернативу прямому измерению почечной функции у пациентов пожилого возраста [23].
В нашей стране диагностика ХСН проводится согласно клиническим рекомендациям «Хроническая сердечная недостаточность», одобренным Минздравом России в 2020 г. [24]. Для постановки диагноза необходимо наличие характерных жалоб, клинических признаков, систолической и/или диастолической дисфункции, выявление натрийуретических пептидов (мозгового натрийуретического пептида – BNP и N-терминального фрагмента натрийуретического пропептида мозгового – NT-proBNP) [24]. NТ-proBNP – маркер кардиальной дисфункции, концентрация которого зависит от многих факторов, включая гипоксию [25, 26]. NT-proBNP повышается при ХБП, что объясняется как наличием миокардиального повреждения в рамках кардиоренального синдрома, так и метаболизмом этого пептида [27]. При острой декомпенсации СН и ХБП уровень NT-proBNP имеет определенное прогностическое значение [28, 29], однако недостаточно ясны практические аспекты его использования при хроническом кардиоренальном синдроме, особенно у пациентов, получающих лечение диализом [30].
Электрокардиография и эхокардиография рекомендованы всем пациентам с подозрением на СН, в том числе для определения фенотипа ХСН. С целью оценки систолической функции левого желудочка (ЛЖ) рекомендуется использовать ультразвуковой метод дисков (метод Симпсона). Поскольку большинство пациентов с ХСН, в том числе при наличии ХБП, имеет сохраненную фракцию выброса (ФВ), рекомендована корректная оценка диастолической функции ЛЖ не только с расчетом соотношения скоростей его наполнения в раннюю диастолу и в систолу предсердий (Е/А), но и соотношения скорости раннего диастолического наполнения ЛЖ и усредненной скорости подъема основания ЛЖ в раннюю диастолу (Е/e′), а также индексированного объема левого предсердия и максимальной скорости трикуспидальной регургитации [24, 31, 32]. Активно обсуждается применение диастолического стресс-теста при подозрении на СНсФВ, однако в настоящее время этот метод не получил широкого распространения в клинической практике [33].
По-видимому, нет необходимости в диагнозе указывать наличие кардиоренального синдрома или фенотипа ХСН, хотя это, безусловно, должно учитываться при лечении, особенно на начальном этапе терапии при подборе лекарственных препаратов и их дозировок.
ЛЕЧЕНИЕ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ И ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
При выборе тактики лечения пациентов с ХСН и ХБП следует избегать развития не только острой декомпенсации ХСН (ОДХСН), но также острого повреждения почек (ОПП) и острой болезни почек (ОБП), держа в уме «порочный круг» кардиоренальных взаимоотношений, негативно влияющих на прогноз.
В то же время с позиций пациентоориентированного подхода необходимо учитывать качество жизни пациентов с хроническим кардиоренальным синдромом как неотъемлемую цель и идентификатор эффективности лечения. ХБП и ХСН ухудшают качество жизни и социальное функционирование больных, что препятствует формированию удовлетворительной приверженности к терапии [34, 35]. Обратим внимание на разные задачи, которые ставят перед собой врачи и пациенты: для первых приоритетным является прогноз и продолжительность жизни пациентов, для вторых – возможность полноценной жизни и исполнения социальных ролей. Для пациентов крайне важно сохранять полноценную жизнедеятельность, включающую образование, работу, семью, возможность занятий спортом и путешествий, участие в общественной жизни на всех этапах заболевания [36].
Ключевым моментом в лечении как ХСН, так и ХБП, является блокада РААС [37]. Оптимальная терапия СНнФВ предполагает назначение четырехкомпонентной терапии: ингибитор АПФ или антагонист рецепторов ангиотензина II (АРА II) или валсартан + сакубитрил, бета-адреноблокатор, антагонист минералокортикоидных рецепторов (АМКР), ингибитор натрий глюкозного ко-транспортера 2-го типа (дапаглифлозин) в сочетании с диуретиком, если есть признаки застоя. Лечение пациентов с сохраненной и промежуточной (умеренно сниженной) ФВ не обладает большой доказательной базой, однако в этом случае применяются стратегии, используемые при лечении пациентов с СНнФВ [24, 31, 32]. На назначение основных классов препаратов, используемых при терапии СН, в той или иной степени влияет наличие у пациента ХБП («почечный» фенотип ХСН).
ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА И АНТАГОНИСТЫ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II
Ингибиторы АПФ – препараты, улучшающие прогноз и качество жизни больных ХСН со сниженной ФВ [38]. Причем они рекомендованы при отсутствии симптомов (для профилактики развития симптомной ХСН), а также пациентам с сохраненной и промежуточной (умеренно сниженной) ФВ с титрацией до максимально переносимых рекомендуемых доз. Ингибиторы АПФ/АРА II противопоказаны при наличии ангионевротическиого отека в анамнезе, двустороннего стеноза почечных артерий (или стеноза почечной артерии у пациентов с единственной функционирующей почкой, включая реципиентов почечного трансплантата), беременности/планировании беременности, известной специфической аллергической реакции. Алгоритм назначения иАПФ/АРА II представлен на рисунке [37].
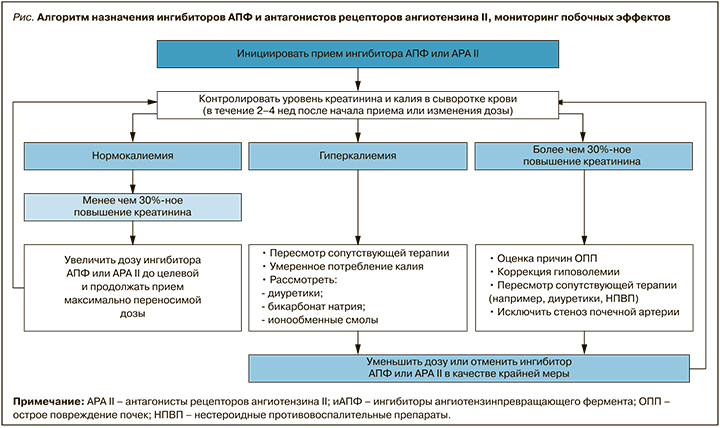
Применение АРА II при ХСН рекомендуется только при непереносимости ингибиторов АПФ, что на практике не всегда выполняется, несмотря на регламентирующие документы. Под «непереносимостью» ингибиторов АПФ эксперты понимают индивидуальную непереносимость (аллергию), развитие ангионевротического отека, кашля. Принципы назначения АРА II, противопоказания, мониторирование функции почек и уровня калия такие же, как и при применении ингибиторов АПФ. К использованию у пациентов с ХСН рекомендованы только три представителя АРА II – кандесартан, валсартан и лозартан. В случае использования сартанов при ХБП коррекция дозы требуется в меньшей степени, чем при приеме ингибиторов АПФ.
Ингибиторы АПФ и АРА II следует назначать с осторожностью при гиперкалиемии (К+ >5,0 ммоль/л,), симптоматической гипотензии или бессимптомной гипотензии (систолическое артериальное давление менее 100 мм рт.ст.), снижении рСКФ менее 30 мл/мин/1,73 м2 или повышении креатинина более 221 мкмоль/л. Необходимо также учитывать лекарственные взаимодействия блокаторов РААС с сопутствующей терапией (препаратами калия, калийсберегающими диуретиками, антагонистами альдостерона, прямыми ингибиторами ренина, НПВП, триметопримом/триметопримом-сульфаметоксазолом, калийсодержащими заменителями пищевой соли).
В амбулаторной практике ингибиторы АПФ и АРА II назначаются стабильным пациентам. Перед назначением необходим контроль функции почек и уровня электролитов. Препараты начинают титровать с низкой дозы с интервалом удвоения не менее двух недель, доводя до целевой или максимально переносимой дозировки. Вследствие механизма действия ингибиторов АПФ/АРА II (избирательная вазодилатация эфферентных артериол клубочков, снижающая внутриклубочковое давление, ингибирование действия альдостерона), возможно некоторое бессимптомное повышение уровня креатинина и калия в сыворотке крови, обычно в течение первых двух недель после начала лечения, со стабилизацией в течение 2–4 нед. при нормальном потреблении натрия и жидкости. Этим объясняется необходимость контроля калия и креатинина спустя 2–4 нед после начала приема или изменения дозы ингибиторов АПФ/АРА II. Пациентам с ХСН и ХБП контроль креатинина и калия проводится через 1–2 нед после начала терапии и через 1–2 нед после изменения дозы, а далее – через 4 мес.
При лечении пациентов с хроническим кардиоренальным синдромом следует корригировать дозу препаратов с учетом функции почек. В рекомендациях KDIGO допустимым уровнем повышения креатинина считается 30%. При его повышении более 30% от исходного, особенно у пациентов с атеросклеротическими ССЗ и курением, следует исключить стеноз почечных артерий (как минимум провести ультразвуковое исследование) [37]. В рекомендациях кардиологов при терапии ингибиторами АПФ/АРА II допустимо повышение уровня креатинина до 50% по сравнению с исходным уровнем (или менее 266 мкмоль/л) или снижение рСКФ до 25 мл/мин/1,73 м2 или увеличение калия до <5,5 ммоль/л [24]. При чрезмерном повышении креатинина необходимо пересмотреть сопутствующую терапию (одновременный прием нефротоксичных перпаратов, НПВП, калийсберегающих диуретиков), вдвое уменьшить дозу ингибиторов АПФ (возможно даже временно отменить препарат) и проконтролировать биохимические показатели в течение 1–2 нед. Необходима консультация нефролога, если не наблюдается улучшения контролируемых показателей, а также при повышении калия более 5,5 ммоль/л или увеличении креатинина более 100% от исходного уровня (или более 310 мкмоль/л). Контроль биохимических показателей проводится до получения стабильных результатов. Использование ингибиторов АПФ/АРА II у пациентов с рСКФ <30 мл/мин/1,73 м2 проводится под тщательным контролем креатинина и уровня калия в сыворотке крови.
Отмена ингибиторов АПФ/АРА II у пациентов с ХБП ведет к повышению как общей, так и сердечно-сосудистой смертности. Отказ от ингибиторов РААС у пациентов с ХСН также ухудшает прогноз. В связи с этим крайне важно соблюдать требование всех современных рекомендаций об использовании целевых или максимально переносимых доз ингибиторов АПФ/АРА II.
ВАЛСАРТАН + САКУБИТРИЛ (АНГИОТЕНЗИНОВЫХ РЕЦЕПТОРОВ И НЕПРИЛИЗИНА ИНГИБИТОР)
Ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ) в настоящее время рекомендуется к применению как препарат первой линии для улучшения прогноза пациентов с СНнФВ (снижения риска смерти и госпитализаций вследствие декомпенсации СН) как отечественными, так и зарубежными рекомендациями [24, 31, 32]. При этом в рекомендациях Американского колледжа кардиологов и Американской ассоциации сердца (АНА/АСС, 2022) АРНИ отдается предпочтение перед ингибиторами АПФ [32]. Валсартан + сакубитрил в исследовании PARADIGM-HF превзошел по эффективности ингибитор АПФ как в улучшении прогноза, так и качества жизни. В исследование включались пациенты с рСКФ ≥30 мл/ мин/1,73 м2, почечные исходы были благоприятными (в группе терапии АРНИ функция почек оставалась сохранной и был меньше риск гиперкалиемии) [39]. Лечение валсартаном + сакубитрилом также может быть рассмотрено у пациентов с сохраненной и промежуточной (умеренно сниженной, улучшенной) ФВ [24, 31, 32].
Валсартан + сакубитрил не назначается при гиперкалиемии (К+ >5,0 ммоль/л), симптоматической артериальной гипотензии (систолическое артериальное давление меньше 95 мм рт.ст.), рСКФ <30 мл/ мин/1,73 м2. Если больной получает ингибитор АПФ, то прием АРНИ допустим только спустя 36 ч после его последнего применения (последняя рекомендация не относится к АРА II). Необходимо также принимать в расчет лекарственные взаимодействия, способные увеличивать риск развития гиперкалиемии или ухудшать функцию почек (препараты калия, антагонисты альдостерона, калийсберегающие диуретики, прямые ингибиторы ренина, НПВП, триметоприм/триметоприм-сульфаметоксазол, калийсодержащие заменители пищевой соли). АРНИ также противопоказан при ангионевротическиом отеке в анамнезе, двустороннем стенозе почечных артерий, беременности/планировании беременности, периоде грудного вскармливания, аллергической реакции на компоненты препарата.
Перед стартом терапии у всех пациентов с ХСН необходимо проверить функцию почек и уровень электролитов. При наличии ХБП 3 стадии (рСКФ 30–59 мл/мин/1,73 м2) возможно начало лечения со сниженной начальной дозы (24/26 мг 2 раза/ сут), так же как и у больных ХСН с систолическим артериальным давлением 100–110 мм рт.ст., и у наивных пациентов (ранее не получавших ингибиторов АПФ/АРА II). Удвоение дозы происходит с интервалом не менее 2 нед до целевой (97/103 мг 2 раза/ сут) или максимально переносимой дозы. Контроль креатинина и калия сыворотки крови проводится через 1–2 нед после начала и через 1–2 нед после титрования очередной дозы, далее через 4 мес. При использовании АРНИ допустимо временное снижение рСКФ до <30 мл/мин/1,73 м2 и повышение калия сыворотки до <5,5 ммоль/л. При лечении АРНИ необходимо оценить сопутствующую терапию и избегать приема нефротоксичных препаратов, минимизировать диуретическую терапию (особенно если пациент принимает ингибиторы натрий-глюкозного ко-транспортера 2-го типа) [27, 35].
В 2021–2022 гг. появились первые публикации о безопасности и эффективности АРНИ у пациентов с СНсФВ на гемодиализе [40] и перитонеальном диализе [41]. Однако использование валсартана + сакубитрила без тщательно спланированных проспективных исследований у пациентов, получающих почечную заместительную терапию, преждевременно.
АНТАГОНИСТЫ АЛЬДОСТЕРОНА (АНТАГОНИСТЫ МИНЕРАЛОКОРТИКОИДНЫХ РЕЦЕПТОРОВ)
В лечении ХСН рекомендуется использование АМКР – спиронолактона или эплеренона. Препараты не назначаются при рСКФ ниже 30 мл/ мин/1,73 м2 (креатинин более 220 мкмоль/л) и гиперкалиемии (K+ >5,0 ммоль/л). Необходимо мониторирование уровня калия и функции почек, особенно при рСКФ менее 45 мл/мин/1,73 м2. Согласно отечественным и европейским рекомендациям, на фоне приема АМКР калий и креатинин рекомендуется контролировать через 1, 4, 8 и 12 нед, 6, 9 и 12 мес, далее – 1 раз в 4–6 мес. Начальная доза спиронолактона и эплеренона составляет 25 мг 1 раз/сут и увеличивается до 50 мг 1 раз/сут через месяц терапии.
Если сывороточный калий повышается более 5,5 ммоль/л или креатинин выше 221 мкмоль/л либо рСКФ снижается ниже 30 мл/мин/1,73 м2, необходимо уменьшить дозу АМКР вдвое (или принимать в режиме через день) либо временно отменить препарат и мониторировать показатели калия и креатинина; при этом необходима консультация кардиолога, нефролога. В случае повышения калия более 6 ммоль/л или креатинина до 310 мкмоль/л и выше либо снижении рСКФ <20 мл/мин/1,73 м2 необходима отмена препарата [24, 31].
Еще более жесткие требования к отмене АМКР содержатся в последней версии американских рекомендаций (AHA/ACC/HFSA): если не удается поддерживать уровень калия <5,5 ммоль/л, препараты должны быть отменены. При рСКФ <50 мл/мин/1,73 м2 доза не должна превышать 50 мг/сут [32]. Следует иметь в виду возможность повышения калия сыворотки из-за дефекта забора и хранения крови (псевдогиперкалиемия). Кроме того, необходимо оценить диету и сопутствующую терапию (прием ингибиторов АПФ, АРА II, калийсберегающих диуретиков, препаратов калия, дигоксина, калийсодержащих заменителей пищевой соли, НПВП), наличие сопутствующей патологии (сахарного диабета, заболеваний почек), проявлять осторожность у больных пожилого возраста. Селективность эплеренона выше, чем у спиронолактона, поэтому на фоне его приема реже развивается гинекомастия и ниже риск генитальных кровотечений. При этом следует помнить, что на концентрацию эплеренона влияют одновременно назначаемые ингибиторы CYP3A4 (кетоканазол, интраконазол, нефазодон, кларитромицин, телитромицин, ритонавир, нелфинавир).
Появление новых синтетических АМКР (финеренона), которые в значительной степени лишены негативных побочных эффектов препаратов предыдущей генерации (ниже риск гиперкалиемии и снижения функции почек), открывает новую эру в использовании этой группы препаратов у пациентов с ХСН и ХБП [42]. Полагают, что финеренон обладает противовоспалительным, антипролиферативным и антифибротическим действием на почки и сердце. Ожидается регистрация финеренона в России.
Опрос российских кардиологов и терапевтов показал, что только 34,6% кардиологов и 25% терапевтов определяют показания для назначения АМКР в соответствии с современными рекомендациями. Каждый третий кардиолог (37,6%) и каждый пятый терапевт (21,1%) некорректно определяют дозу препаратов для достижения нейромодулирующего эффекта [43].
ЗАКЛЮЧЕНИЕ
Диагностика и лечение пациента с хроническим кардиоренальным синдромом – междисциплинарная проблема, требующая от врача терапевта глубоких знаний. Использование алгоритмов контроля безопасности назначаемой терапии позволит сократить возможные побочные явления и улучшить прогноз пациента. Сложности заключаются и в том, что положения инструкций к препаратам не всегда соответствуют клиническим рекомендациям, тем более разных медицинских обществ. При блокаде системы РААС необходима осторожность исходя из ключевого правила «не навреди».



