ВВЕДЕНИЕ
Артериальная гипертензия (АГ) – одна из самых частых причин развития хронической болезни почек (ХБП) и ее прогрессирования в терминальную почечную недостаточность (ТПН) [1]. В высокой частоте формирования ХБП при АГ, кроме снижения массы нефронов, гиперактивности симпатической и ренин-ангиотензин-альдостероновой систем, эндотелиальной дисфункции, определенную роль играет и высокая распространенность АГ среди взрослого населения, которая составляет 25–30% [2]. В России, согласно результатам эпидемиологических исследований, встречаемость этого сердечно-сосудистого заболевания у взрослого населения варьирует в пределах 30–45% [3], при этом, по данным ряда отечественных исследователей, частота эссенциальной АГ еще выше: у женщин – около 40%, у мужчин – 47%. В группе лиц старше 60 лет она и вовсе находится на уровне 60% [4]. У больных с ХБП АГ выявляется в 67–71% случаев, у пожилых пациентов достигает показателя в 82% [5, 6].
Распространенность ХБП во взрослой популяции в соответствии с данными метаанализа последних лет составляет 13,4%, а по результатам популяционных исследований – от 14 до 19%. Встречаемость этой болезни наиболее высока в странах с высокой продолжительностью жизни, что обусловлено значительной долей пожилых людей в структуре населения [2, 7, 8]. В нашей стране распространенность ХБП во взрослой популяции равняется 14,3% [7] и сопоставима по этому показателю с такими социально значимыми заболеваниями, как гипертоническая болезнь (ГБ), ишемическая болезнь сердца (ИБС), сахарный диабет (СД), ожирение и метаболический синдром, которые выступают основной причиной неинфекционной эпидемии и смертности населения в мире.
В группах высокого риска (пациенты с АГ, СД, сердечно-сосудистыми заболеваниями) частота ХБП превышает 36,1% [7]. В России признаки ХБП отмечаются более чем у трети больных с хронической сердечной недостаточностью (ХСН), у 36% пациентов старше 60 лет и 16% лиц трудоспособного возраста [9–12].
Разные данные о распространенности ХБП обусловлены использованием различных методов исследования – эпидемиологических или целенаправленных с применением маркеров этого заболевания. Ранними маркерами ХБП служат скорость клубочковой фильтрации (СКФ) <60 мл/ мин/1,73 м2, определенная по формуле CKD-EPI, и альбуминурия >30 мг/сут или отношение альбумин/креатинин (A/Кр) >30 мг/г или >3 мг/ммоль креатинина в разовой утренней порции мочи, которые сохраняются более 3 мес, несмотря на коррекцию причин и факторов риска ХБП [7, 13].
Так, по результатам одного обследования 584 пациентов с АГ на наличие ХБП, маркеры последней выявлялись у каждого третьего пациента: снижение СКФ <60 мл/мин/1,73 м2 – у 31%, высокая/очень высокая (патологическая) альбуминурия – у 30,5%; при этом хотя бы один маркер ХБП обнаружену 45% пациентов. Авторы считают, что в реальной амбулаторной практике распространенность маркеров ХБП у пациентов с АГ составляет 45%, изолированное снижение СКФ <60 мл/ мин/1,73 м2 и патологическая альбуминурия встречаются в 14,5 и 14% соответственно, а сочетание сниженной СКФ и А/Кр >30 мг/г – в 16,5% [1].
О высокой распространенности маркеров ХБП у больных АГ с сахарным диабетом 2-го типа (СД 2) или без него в России свидетельствуют результаты исследования ХРОНОГРАФ: у 49,4% пациентов было выявлено снижение СКФ <60 мл/ мин/1,73 м2 и/или А/Кр >30 мг/г. Снижение СКФ <60 мл/мин/1,73 м2 было обнаружено у 34,8% пациентов, альбуминурия выше 30 мг/г – у 32,6%, сочетание сниженной СКФ и альбуминурии – у 18%. У 28,5% больных отмечен высокий/очень высокий уровень комбинированного риска прогрессирования ХБП и сердечно-сосудистых осложнений (ССО) [14]. По результатам исследования PREVEND, у 2/3 пациентов с ХБП 3 стадии альбуминурия отсутствует, однако эти пациенты имеют такой же риск развития ССО, как и пациенты с альбуминурией. При снижении СКФ <40 мл/мин/1,73 м2, кроме риска прогрессирования ХБП, значительно возрастает риск ССО для всех возрастных групп [15].
У больных АГ установлены ассоциации длительности этого заболевания, липидных параметров, курения со снижением СКФ и/или высокой/очень высокой альбуминурией, что позволяет стратифицировать пациентов по риску развития ХБП [1]. Увеличение длительности АГ >10,5 лет, повышение уровня триглицеридов >1,98 ммоль/л, снижение уровня холестерина липопротеидов высокой плотности <0,73 ммоль/л, курение ассоциируются со снижением СКФ <60 мл/ мин/1,73 м2 или повышением А/Кр в моче >30 мг/г [1]. Согласно рекомендации KDIGO (Kidney Disease: Improving Global Outcomes – Инициатива по улучшению глобальных исходов заболеваний) свидетельством прогрессирования ХБП является снижение расчетной СКФ на 25% и более от исходного уровня или более чем на 5 мл/ мин/1,73 м2 в год [16–18].
Таким образом, учитывая немногочисленность и различные данные о распространенности ХБП у пациентов с эссенциальной АГ на амбулаторном этапе, недостаточное количество исследований темпов прогрессирования ХБП, особенно при сочетании АГ с коморбидными заболеваниями и/или патологическими синдромами, нами была поставлена цель – изучить распространенность ХБП, коморбидные заболевания и синдромы, факторы риска, темпы прогрессирования ХБП у амбулаторных пациентов с АГ II–III стадии.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования включал 3 этапа: 1) изучение распространенности ХБП у амбулаторных пациентов с эссенциальной АГ; 2) анализ клинико-лабораторных данных, функции почек и темпов прогрессирования ХБП в зависимости от наличия/отсутствия коморбидных заболеваний, факторов риска; 3) оценка клиники, факторов риска, функции почек и темпов прогрессирования ХБП в динамике через 5 лет.
На 1-м этапе было проведено целенаправленное обследование 968 амбулаторных пациентов с эссенциальной АГ II–III стадии на наличие ХБП на базе Клинико-диагностического центра Авиастроительного района г. Казани.
В исследование включали работающих пациентов, обратившихся за медицинской помощью к участковому врачу по различным причинам (повышенное артериальное давление, диспансерные или профилактические осмотры и др.).
В исследование не включали пациентов с первичными заболеваниями почек, cимптоматической АГ, СД и ХСН выше I стадии.
Контрольную группу составили 30 практически здоровых лиц (19 мужчин и 11 женщин), у которых, по данным анамнеза и анализа медицинской документации, артериальное давление (АД) при обращении не превышало 140/90 мм рт.ст., а также отсутствовали коморбидные заболевания. Диагностику ХБП осуществляли по критериям: микроальбуминурия (МАУ) >30 мг/сут и/или A/ Кр в разовой порции мочи >30 мг/г и/или СКФ <60 мл/мин/м2 по CKD-EPI (2009).
На 2-м этапе исследования из 968 пациентов с АГ случайным методом было отобрано 120 человек, подписавших информированное согласие: 74 (61%) мужчины и 46 (39%) женщин, в возрасте 26–70 лет (53,5±0,9). Длительность АГ составила от 2 до 30 лет (M=9,8±0,6). Гипертоническую болезнь (ГБ) II стадии имели 38 (32%) пациентов, III стадии – 82 (68%).
Пациенты были разделены на две группы: 1-я – без ХБП (n=71), 2-я – с ХБП (n= 49). Им было проведено углубленное обследование, включавшее оценку факторов риска ХБП (пол, возраст, длительность АГ, уровень АД, возраст начала АГ, наследственность по АГ и ХБП, наличие ишемической болезни сердца, доля курящих и индекс курения; потребление соли, алкоголя; прием анальгетиков), клиники, индекса массы тела (ИМТ), липидного спектра (общий холестерин, триглицериды, липопротеиды высокой плотности и низкой плотности, индекс атерогенности), функции почек и темпов прогрессирования ХБП, ультразвуковое исследование (УЗИ) почек и ультразвуковую доплерографию (УЗДГ) сосудов почек.
На 3-м этапе исследования (через 5 лет) было выполнено клиническое и инструментальное обследование (по программе 2-го этапа) 43 из 49 пациентов (за прошедший период у 3 пациентов было зарегистрирована сердечно-сосудистая смерть, а по 3 пациентам отсутствовали данные).
Статистическая обработка количественных признаков осуществлялась с использованием t-критерия Стьюдента. Для определения закона распределения в группах использовался критерий распределения χ-квадрат, а для небольших выборок – критерий Фишера. Сравнительная оценка показателей независимых выборок проводилась с помощью рангового дисперсионного анализа Крускала–Уоллиса. В случае нормального распределения и в условиях равенства дисперсий применялся однофакторный дисперсионный анализ с расчетом критерия Ньюмена–Кейлса. Для изучения факторных влияний использовался метод пошаговой множественной регрессии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам 1-го этапа обследования 968 больных с ГБ II–III стадии у 17 пациентов (1,7%) была выявлена альбуминурия >30 мг/г, у 59 (6%) – протеинурия, у 107 (11%) – изолированное снижение СКФ <60 мл/мин/м2. Таким образом, ХБП была верифицирована у 18,7% амбулаторных пациентов: у 7,7% – с альбуминурией и у 11% - по СКФ. Данные о функции почек пациентов в медицинской документации отсутствовали, диагноз ХБП был выставлен впервые. Распространенность ХБП оказалась ниже, чем по данным ряда исследований, в частности, исследования ХРОНОГРАФ, в соответствии с которыми от 1/3 до 1/2 пациентов имеют ХБП по одному из критериев (СКФ или альбуминурия), однако совпала с данными тех же авторов в исследовании пациентов с АГ, согласно которому у работающих пациентов без СД и ХСН II–III стадий изолированное снижение СКФ <60 мл/мин/1,73 м2 и высокая/очень высокая альбуминурия определялись в 14,5 и 14% случаев соответственно [1].
Сравниваемые группы пациентов (табл. 1) – с АГ и ХБП и без ХБП – не различались по возрасту (54,8±1,2 и 51,8±1,4 лет соответственно), полу (в обеих группах преобладали мужчины – 58 и 60%), структуре стадий ГБ. Ишемическая болезнь сердца (ИБС) отмечалась у 62% участников в 1-й группе и у 64% во 2-й (стенокардию напряжения 2–3 функционального класса и постинфарктный кардиосклероз в 1-й группе имели 59,1 и 8% человек соответственно, во 2-й группе – 69,3 и 4%). ХСН I стадии наблюдалась у 44% пациентов в 1-й группе и 45% – во 2-й. Уровень СКФ у пациентов без ХБП составил 90+4,7, с ХБП – 71 мл/мин/ м2. ХБП 1-й стадии имели 19, 2-й стадии – 14, 3-й стадии – 16 пациентов.
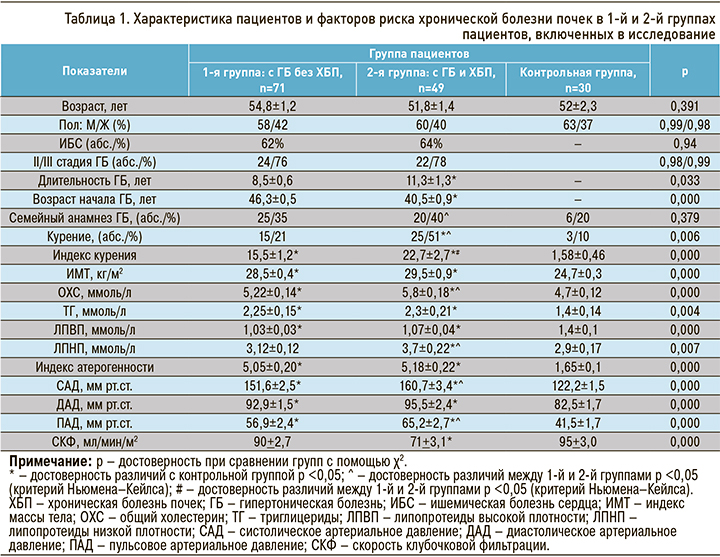
Длительность ГБ у пациентов с ХБП оказалась больше, чем у больных без ХБП, продолжительность АГ до развития ХБП составила в среднем 11,3±1,3 лет. Начало ГБ у пациентов с ХБП пришлось на более ранний возрастной период (40,5 лет) по сравнению с 1-й группой пациентов (46,3 года). Уровень САД, ДАД и ПАД в группе с ХБП был выше, чем в отсутствие ХБП. Бόльшая часть пациентов с ХБП имела АГ III стадии, однако у 22% была АГ 2 стадии, при этом среди них неконтролируемое САД в пределах 1 степени наблюдалось 18%, II степени – 17%, III степени – у 65% человек. Таким образом, ХБП через 11,3 года у 2/3 пациентов развилась при неконтролируемой АГ, а у каждого третьего пациента (35%) – при умеренном повышении АД. В то же время в группе пациентов без ХБП преобладали лица с АГ либо легкой степени (36%), либо умеренной степени (32%); АГ 3 степени имели только 32%. Курящих пациентов в группе с ХБП оказалось больше, а индекс курения у них был выше, чем в 1-й группе.
ИМТ между 1-й и 2-й группами не отличался, но был выше в обоих случаях в сравнении с контролем. В обеих группах уровень общего холестерина (ОХС), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПНП) и индекс атерогенности были значительно выше, а содержание липопротеидов высокой плотности (ЛПВП) ниже по сравнению с контрольной группой. Уровни ОХС и ЛПНП были выше в группе с ХБП по сравнению с группой без ХБП, т.е. можно сделать вывод, что ЛПНП оказывают влияние на формирование ХБП. Гиполипидемическая диета и терапия были назначены всем участникам, однако целевого уровня липидов достигли только 1/3 пациентов в обеих группах.
В результате многофакторного регрессионного анализа факторов риска в группе наблюдения была выявлена регрессионная совокупность факторов, влияющих на развитие ХБП (табл. 2): повышенные уровни ЛПНП в крови, САД, ИМТ, ДАД, индекс курения, возраст начала ГБ, длительность ГБ (приведены в порядке убывания влияния). Вклад факторов, включенных в модель (Regress=18,211), составил 62,8% от общей суммы квадратов отклонений прогнозируемого параметра y (Total=28,991), а 37,2% вклада вносят случайные факторы (Residual=10,779), что свидетельствует об информационной способности модели. По величине F-критерия и уровню значимости p=0,0000 модель можно считать достоверно значимой.
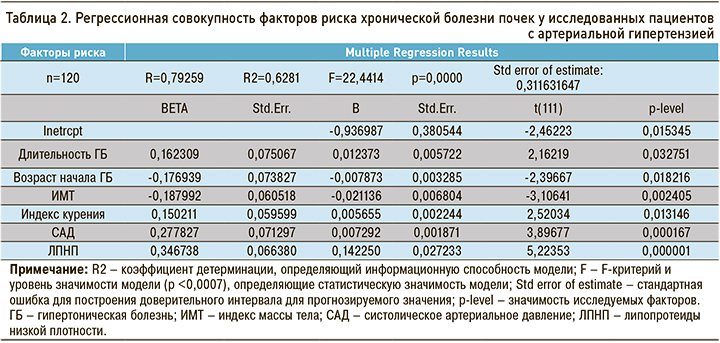
Вероятность развития ХБП в зависимости от величин влияющих факторов риска можно рассчитать по формуле y=b0+b1x1+b2x2+...+bкxк, где y – прогнозируемое значение выходного параметра; b0 – свободный член; b1 b2 ..., bк – коэффициент влияния соответствующего фактора (длительность ГБ, САД и т.д.); x1 x2 ..., xк – показатели соответствующих факторов; b1x1, b2x2 ..., bкxк – линейный эффект факторов.
При изучении степени влияния каждого фактора на параметр y выявлено наибольшее влияние уровня ЛПНП, САД, ИМТ, возраста начала ГБ, длительности ГБ и индекса курения. Степень влияния факторов риска была рассчитана по величине стандартизированных коэффициентов регрессии ВЕТА с помощью формулы (табл. 3):

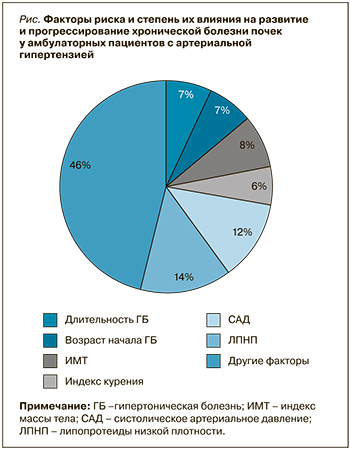
В данном исследовании среди доказанных факторов риска развития ХБП три были связаны с АГ (длительность АГ >11,3±1,3 лет, отсутствие контроля АГ и более раннее начало АГ), два – с нарушением жирового обмена (повышение ИМТ и ЛПНП). Следует отметить также влияние высокого индекса курения на развитие ХБП. Прогрессирование заболевания было связано с влиянием данных факторов риска (рис.). Средняя скорость прогрессирования (∆СКФ) у амбулаторных пациентов с АГ и ХБП составила 12,05 мл/ мин/год.
На 3-м этапе исследования (через 5 лет) уровень САД у участников несколько снизился (с 150,7±3,4 до 142,2±2,1 мм рт.ст.), а ДАД повысился (с 95,5±2,4 до 101,6±0,9 мм рт.ст.), т.е. АД оставалось неконтролируемым. Длительность ИБС составила 9,3±0,8 лет. ИМТ снизился незначительно – с 29,5±0,9 до 28,5±0,25 кг/м2. Доля курящих уменьшилась с 51 до 20,6%. ИБС была диагностирована у 38 из 43 пациентов (88%), и этот показатель оказался выше, чем за 5 лет до этого. Доля пациентов с постинфарктным кардиосклерозом нарастала по мере увеличения стадии ХБП: у 2,9% пациентов с 1 стадией, у 20,9% – с 3-й и у 76,2% с 3–5 стадиями ХБП. АГ II стадии имели 4,8% человек, при этом преобладала III стадия (95,2% случаев). СД был выявлен у 6 исследованных пациентов (13,9%).
Пациенты, имеющие АГ, коморбидную с ИБС, при первом обследовании имели очень высокий сердечно-сосудистый риск, на амбулаторном этапе им назначена гиполипидемическая терапия, однако 56,8% получали эту терапию нерегулярно и не контролировали целевой уровень ЛПНП; 43,2% получали ее регулярно, но лишь 7 пациентов (16,3%) достигли целевого уровня ЛПНП. Уровни ОХС (5,7±0,1 ммоль/л) и ЛПНП (3,5±0,09 ммоль/л) практически не изменились, уровень ТГ снизился с 2,3±0,21 до 1,99±0,09 ммоль/л.
СКФ за 5 лет в группе наблюдения снизилась с 71+3,1 до 45,2±1,6 мл/мин/м2. Увеличилось число пациентов с поздними стадиями ХБП (3–5): ХБП 1-й стадии на 1-м и 3-м этапах исследования отмечалась у 38,8 и 2,6% пациентов соответственно, 2-й стадии – у 21,5 и 28,6%, у 3-й стадии –32,7 и 66,0%, 4–5 стадий – у 0 и 9,9%; эти показатели отражали прогрессирование ХБП. Темпы этого прогрессирования у пациентов с ИБС снизились за счет некоторой положительной динамики факторов риска и составили 5,7 мл/мин/год (3–7,2 мл/мин/год).
ЗАКЛЮЧЕНИЕ
Распространенность ХБП у амбулаторных пациентов работоспособного возраста c АГ в нашем исследовании составила 18,7%, при этом диагноз ХБП всем участникам был выставлен впервые. 64% пациентов с ХБП имели ИБС. Длительность ГБ до развития ХБП составила 11,3±1,3 лет, а начало ГБ у больных с ХБП пришлось на более ранний возрастной период (40,5 лет) по сравнению с группой пациентов без ХБП (46,3 года). Выявлено шесть факторов, оказывающих влияние на развитие ХБП: повышенные показатели ЛПНП в крови, САД, ИМТ, индекса курения, а также раннее начало и длительность ГБ. Темпы прогрессирования ХБП у пациентов с АГ (∆СКФ) составили 12,05 мл/мин/год. Разработана формула прогнозирования риска развития ХБП у больных с АГ. В динамике через 5 лет по всем факторам риска положительная динамика была незначительной, и целевые показатели не были достигнуты. Доля пациентов с ИБС возросла до 88%. Темпы прогрессирования ХБП несколько замедлились – до 5,7 мл/мин/год, но по-прежнему свидетельствовали о прогрессировании ХБП.



