ВВЕДЕНИЕ
Из литературы известно, что мочевая кислота (МК) представляет собой финальный продукт пуринового обмена, а также является значимым метаболитом, который выполняет функции защиты от оксидативного стресса и участвует в окислительно-восстановительных реакциях [1, 2]. Гиперурикемией (ГУ) принято считать повышение уровня МК в сыворотке крови выше 360 мкмоль/л (6 мг/дл) у женщин и 420 мкмоль/л (7 мг/дл) у мужчин [3]. Отмечается, что развитие ГУ – многофакторный процесс, в котором большую роль играют образ жизни, генетические и гендерно-возрастные особенности, а также влияние окружающей среды [4, 5].
Традиционно ГУ рассматривалась только как фактор риска развития подагры и подагрического артрита. Между тем к настоящему времени накоплены сведения о ее ассоциации с развитием инсулинорезистентности, сахарного диабета, дислипидемии, артериальной гипертензии (АГ), а также с риском развития сердечно-сосудистых заболеваний (ССЗ) [6–8]. Актуальной эту проблему делает и то, что в последние десятилетия отмечается значимый рост распространенности ГУ среди населения развитых стран. Например, в США за период с 1960-х по 1990-е гг. частота ГУ удвоилась и составляет на данный момент 20% [9]; в КНР она увеличилась на 10% за последнее десятилетие и достигла 13,3% [10]. По данным крупномасштабных исследований, средняя мировая распространенность ГУ составляет 13,3% [11].
В ходе многих исследований отмечено, что ГУ повышает риск развития и прогрессирования хронической болезни почек [12]. Кроме этого, выявлена обратная зависимость между уровнем МК и скоростью клубочковой фильтрации (СКФ) [13].
Распространенность ГУ среди населения России впервые была оценена в условиях крупной репрезентативной выборки в 2012–2014 гг. в рамках исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации) и на тот момент равнялась 16,8% [14]. Частота ГУ, функциональное состояние почек и их связь с основными факторами сердечно-сосудистого риска среди жителей Нижегородского региона до настоящего времени исследованы недостаточно.
Все вышеизложенное определяет необходимость продолжения исследований в данном направлении. Огромный интерес также представляет изучение связей ГУ с различными компонентами кардиоваскулярного риска.
Цель исследования – оценить распространенность ГУ и ее связь со снижением СКФ и некоторыми кардиоваскулярными факторами риска среди населения Нижегородского региона.
МАТЕРИАЛ И МЕТОДЫ
В ходе исследования нами был обследован 2501 человек в возрасте 35–74 лет, отобранный из городского и сельского населения Нижегородского региона методом стратифицированной многоступенчатой случайной выборки. Оно проводилось в рамках третьего эпидемиологического исследования ЭССЕ-РФ 3 (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации). Протокол исследования был составлен ФГБУ «НМИЦ ТПМ» Минздрава России [15]. Он предполагал обследование населения Нижегородского региона, включенного в выборку, для выявления ССЗ, их факторов риска, других хронических неинфекционных заболеваний и оценку показателей здоровья.
Исследование получило одобрение Независимого этического комитета НМИЦ ТПМ. На каждого респондента оформлялось добровольное информированное согласие на участие в исследовании. Обследуемый опрашивался с целью выявления хронических неинфекционных заболеваний, а также факторов риска их развития. Выполнялось антропометрическое исследование – измерение роста, веса, окружности талии (ОТ) и бедер, артериального давления (АД) и частоты сердечных сокращений (ЧСС). У каждого участника производился забор венозной крови с целью проведения спектра лабораторных исследований, включавший следующие показатели: общий холестерин (ОХС), липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды (ТГ), глюкоза, креатинин, МК, высокочувствительный С-реактивный белок (вчСРБ), фибриноген.
ГУ регистрировалась при уровне МК более 360 мкмоль/л у женщин и более 420 мкмоль/л у мужчин [3].
Индекс висцерального ожирения (ИВО) рассчитывался по формуле Amato [15]: для мужчин – ОТ [см]/(39,68 + (1,88 × ИМТ [кг/м2])) × (ТГ [ммоль/л]/1,03) × (1,31/ЛПВП [ммоль/л]); для женщин – ОТ [см]/(36,58 + (1,89 × ИМТ [кг/м2]) × (ТГ [ммоль/л]/0,81) × (1,52/ЛПВП [ммоль/л]).
СКФ определялась по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [17].
Полученные данные обрабатывались с использованием пакета прикладных программ IBM SPSS Statistics 26 (США). Оценка соответствия распределения количественных показателей закону нормального распределения производилась с использованием критерия Колмогорова–Смирнова. Количественные показатели, распределение которых отличалось от нормального, описывались с помощью значения медианы (Ме), нижнего и верхнего квартилей (Q1-Q3). При сравнении групп применялся U-критерий Манна–Уитни. Статистически значимый уровень различия регистрировался при p <0,05.
Для построения прогностической модели риска ГУ использовался метод бинарной логистической регрессии. В ходе анализа выполнялось последовательное включение следующих переменных, имеющих зависимость с ГУ: наличие у респондента АГ, повышенный уровень ИВО (в возрасте 30–42 года – более 2,23; 42–52 года – более 1,92; 52–66 лет – более 1,93; в возрасте более 66 лет – более 2,00 [18]), уровень СКФ менее 60 мл/мин/1,73 м2, повышенный уровень ОХС (≥5 ммоль/л), повышенный уровень ТГ (≥1,7 ммоль/л), уровень вчСРБ более 1,75 мг/л, уровень фибриногена более 3,14 г/л, возраст более 50 лет, наличие у респондента абдоминального ожирения (ОТ более 94 см у мужчин и более 80 см у женщин), ИМТ более 25 кг/м2. С учетом возможности негативного влияния корреляции между предикторами на качество математической модели многофакторный анализ был проведен с использованием прямого метода пошагового включения переменных.
Вышеуказанные уровни возраста, вчСРБ и фибриногена были получены с помощью анализа ROC-кривых. В ходе него были определены точки отсечения для исследуемых количественных переменных с учетом оптимального сочетания чувствительности и специфичности.
РЕЗУЛЬТАТЫ
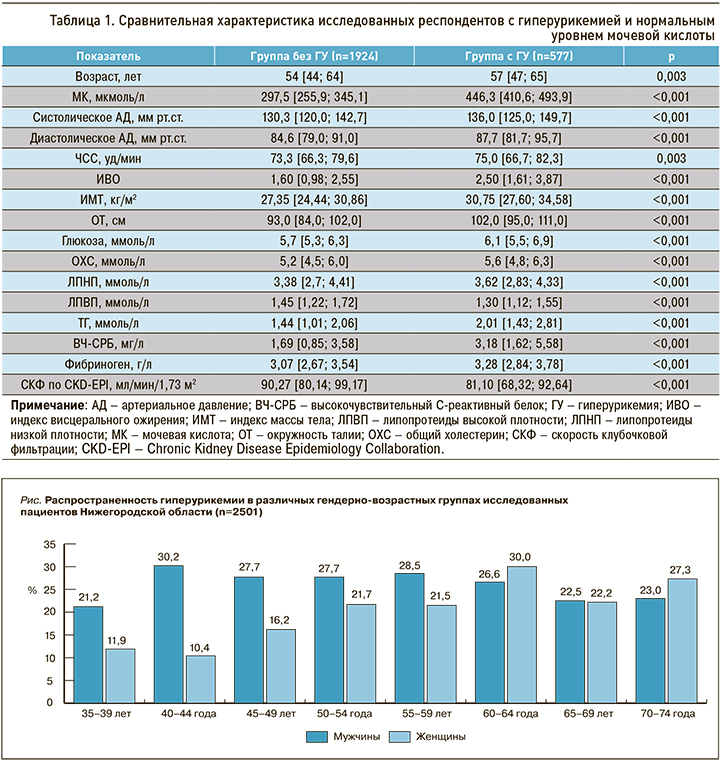
При анализе полученных данных было установлено, что ГУ регистрировалась у 23,1% взрослого населения Нижегородского региона. Отмечена несколько бόльшая распространенность повышенного уровня МК среди городского контингента (23,4%), чем у жителей сельской местности (22,1%). Гендерно-возрастные особенности превалентности ГУ приведены на рисунке. Из него видно, что среди лиц мужского пола ГУ была распространена широко во всех возрастных категориях, несколько больше среди представителей молодого и среднего возраста. Анализируя аналогичный показатель у женщин, можно отметить, что у них молодом возрасте распространенность ГУ оказалась значимо ниже, чем у мужчин. С возрастом у лиц женского пола наблюдалась четкая тенденция к росту частоты ГУ, и в конечном итоге в старших возрастных стратах гендерные различия нивелировались.
Сравнительная характеристика респондентов с выявленной ГУ и нормальным уровнем МК представлена в таблице 1. При анализе приведенных данных можно отметить, что обследуемые с ГУ были значимо старше тех, у которых этого нарушения не наблюдалось: 57 [47; 65] против 54 [44; 64] лет, p <0,0001.
При анализе СКФ было установлено, что у лиц с повышенным уровнем МК этот показатель функции почек был ниже, чем у обследуемых с нормальным ее значением: 81,10 [68,32; 92,64] против 90,27 [80,14; 99,17] мл/мин/1,73 м2, p <0,0001).
Такие факторы риска неблагоприятных сердечно-сосудистых исходов, как уровень систолического и диастолического АД, а также ЧСС оказались более выраженными у лиц с повышенным уровнем МК [19–21].
Известно, что ИВО служит новым интегральным показателем, учитывающим ОТ, ИМТ, уровни ТГ и ЛПВП и характеризующим выраженность влияния висцеральной жировой ткани на метаболические процессы в организме [22]. Повышение показателя ИВО приводит к значительному увеличению риска неблагоприятных кардиоваскулярных событий [23]. При анализе этого показателя было выявлено, что лица с ГУ имели значимо больший ИВО, чем те, у которых уровень МК находился в нормальных пределах: 2,50 [1,61; 3,87] против 1,60 [0,98; 2,55], р <0,0001. При сравнении ИМТ (30,75 [27,60; 34,58] против 27,35 [24,44; 30,86] кг/м2, p <0,0001), ОТ (102,0 [95,0; 111,0] против 93,0 [84,0; 102,0] см, p <0,0001) и уровня глюкозы венозной плазмы (6,1 [5,5; 6,9] против 5,7 [5,3; 6,3] ммоль/л) также получены данные о более неблагоприятном метаболическом профиле у лиц, имеющих ГУ.
Из литературы известно, что сущетвует четкая положительная взаимосвязь между уровнями ОХС, ЛПНП, ТГ и риском развития и прогрессирования ССЗ; ЛПВП, в свою очередь, обладают определенным протективным эффектом в отношении кардиоваскулярных исходов [24–26]. Оценивая различия в липидном спектре лиц с ГУ и нормальным уровнем МК в популяции Нижегородского региона, можно констатировать, что у участников исследования с ГУ были статистически значимо повышены уровни атерогенных фракций: ОХС (5,6 [4,8; 6,3] против 5,2 [4,5; 6,0] ммоль/л, p <0,0001), ЛПНП (3,62 [2,83; 4,33] против 3,38 [2,7; 4,41] ммоль/л, p <0,0001), ТГ (2,01 [1,43; 2,81] против 1,44 [1,01; 2,06], p <0,0001), а также снижен уровень антиатерогенных ЛПВП (1,30 [1,12; 1,55] против 1,45 [1,22; 1,72], p <0,0001).
ВчСРБ является лабораторным показателем, способным различать изменения концентрации СРБ в крови в диапазоне нормальных значений (менее 5 мг/л). Необходимость применения этого метода анализа обусловлена тем, что процесс сосудистого воспаления, связанный с развитием атеросклероза, сопровождается незначительными колебаниями СРБ [27, 28]. В ряде исследований продемонстрирована прогностическая значимость определения вчСРБ и другого маркера острой фазы, фибриногена, для комплексной оценки кардиоваскулярного риска [29, 30]. В ходе анализа имеющихся данных, было обнаружено, что лица с ГУ имели статистически более высокий уровень острофазовых белков, чем респонденты с нормальным уровнем МК: вчСРБ – 3,18 [1,62; 5,58] против 1,69 [0,85; 3,58] мг/л, p <0,0001; фибриноген – 3,28 [2,84; 3,78] против 3,07 [2,67; 3,54] г/л, p <0,0001.
В таблице 2 приведены результаты построения прогностической модели с использованием метода бинарной логистической регрессии. Наиболее выраженным влиянием на риск выявления ГУ обладали такие особенности респондента, как наличие сниженной СКФ (отношение шансов (ОШ) 3,383, 95% 95% доверительный интервал (ДИ): 2,334–4,903; p <0,001), АГ (ОШ 1,767, 95% ДИ: 1,384–2,254; p <0,001) и уровень вчСРБ более 1,75 мг/л (ОШ 1,936; 95% ДИ: 1,546–2,425; p <0,001). Несколько меньший вклад вносили такие факторы риска, как наличие у респондента абдоминального ожирения (ОШ 1,982; 95% ДИ: 1,399–2,808; p <0,001) и повышенный ИВО (ОШ 1,816; 95% ДИ: 1,471–2,241; p <0,001). Стоит отметить, что при включении в анализ ИВО как интегрального показателя, статистическая значимость повышенного уровня ТГ упала, и этот фактор риска выбыл из дальнейших расчетов. Примечательно и то, что на начальных этапах анализа принадлежность респондента к возрастной группе более 50 лет выступала фактором риска ГУ, но при приближении к последнему шагу связь с возрастом стала обратной. Объяснение этому парадоксу можно найти в работе С.А. Шальновой с соавт.: вклад возраста становится гораздо менее значимым при включении в полную регрессионную модель остальных факторов риска ГУ [14].
ОБСУЖДЕНИЕ
Результаты нашей работы свидетельствуют о достаточно широкой распространенности ГУ среди населения Нижегородского региона: почти каждый четвертый житель от 35 до 74 лет имеет нарушение обмена МК. Выявлено, что среди лиц мужского пола встречаемость ГУ с возрастом меняется мало и остается на достаточно высоком уровне, а среди женщин наблюдается тенденция к росту этого показателя при приближении к более старшим возрастным когортам. В литературе причина таких гендерных различий в уровнях сывороточной МК объясняется урикозурическим действием женских половых гормонов, концентрация которых снижается в период менопаузы [31]. При этом Anton F.M. et al. приводят доказательства того, что введение эстрогенов, а именно 17-бета-эстрадиола, значимо не влияло на сывороточные уровни МК [32]. С другой стороны, в работе Jung J.H. et al., посвященной исследованию влияния заместительной гормональной терапии на уровни МК у женщин в период менопаузы, показано, что применение комбинированных (эстроген + прогестаген) препаратов вызывало снижение уровня МК (-0,38 ± 0,29 мг/дл, р <0,001), однако использование исключительно эстрогенов, а также тиболона не приводило к значимым статистическим различиям по этому показателю [33]. Все вышеперечисленное, вероятно, указывает на больший вклад прогестагенов в механизмы снижения сывороточной МК у женщин молодого и среднего возраста.
Найденная ассоциация снижения СКФ у лиц с ГУ может иметь двойственную причину. С одной стороны, ухудшение почечной функции неизбежно влечет за собой нарушение выведения МК и увеличение ее концентрации в крови [34]. С другой же стороны, в литературе есть сведения о повышении риска возникновения и прогрессирования ХБП у лиц с ГУ. Так, в работе Li L. et al. продемонстрировано, что ГУ значимо повышает шанс выявления ХБП у обследуемых, ранее не имевших нарушений функции почек (ОШ 2,35; 95% ДИ: 1,59–3,46) [35]. ГУ также ассоциируется и с повышенным риском острого почечного повреждения (ОПП). В исследовании Kang M.W. et al. было установлено, что в группе госпитализированных пациентов с повышенным уровнем МК (более 6,7 мг/дл у мужчин и более 5,4 мг/дл у женщин) значимо увеличен риск возникновения ОПП (у мужчин – ОШ 3,2; 95% ДИ: 2,55–4,10; p <0,001; у женщин – ОШ 3,1; 95% ДИ: 2,40–4,10; p <0,001), а также неполного восстановления почечной функции (у мужчин – ОШ 2,0; 95% ДИ: 1,32–3,04; p=0,001; у женщин – ОШ 2,4; 95% ДИ: 1,43–3,96; p=0,001) [36].
Было выявлено, что лица с ГУ имели более высокие уровни АД и ЧСС, а также ОХС, ЛПНП, ТГ, что повышает их общий кардиоваскулярный риск. В сравнении с группой, интактной в отношении нарушения обмена МК, у респондентов с ГУ оказались более высокими показатели ИВО, ИМТ, ОТ, глюкозы крови, что свидетельствует о худшем метаболическом профиле у данной категории лиц и может быть связано с повышенным риском развития инсулинорезистентности и нарушений углеводного обмена, а также неблагоприятных кардиоваскулярных исходов [37].
Относительно повышенный уровень острофазовых белков, в особенности вчСРБ, может характеризовать более высокую активность сосудистого воспаления у лиц с нарушением обмена МК, что обусловливает прогрессирование атеросклероза и повышение риска неблагоприятных кардиоваскулярных исходов. В работе Cheng J.M. et al. приводятся данные о статистически более значимом риске MACE (Major Adverse Cardiac Events – основные неблагоприятные сердечные события: смерть от любой причины, острый коронарный синдром, незапланированная коронарная реваскуляризации) в течение следующего года у лиц с вчСРБ более 3 мг/дл, чем у тех обследуемых, среди которых уровень этого маркера составлял менее 1 мг/дл (относительный риск 2,17; 95% ДИ: 1,01–4,67; p=0,046). В том же исследовании было показано, что у группы с более высокими показателями вчСРБ бόльшим оказалось и число атеросклеротических бляшек (p=0,002), а также их объем (p=0,002) [38].
Обнаруженные в ходе регрессионного анализа ассоциации ГУ с такими факторами риска, как ожирение (абдоминальное и по ИМТ), АГ, повышенный уровень ОХС, а также заболевания почек, согласуются с результатами крупномасштабных общероссийских исследований [14].
Учитывая рост распространенности ГУ среди населения развитых стран [39], требуется дальнейшая работа в отношении изучения связей между нарушениями обмена МК и факторами риска и прогрессирования сердечно-сосудистых и других хронических неинфекционных заболеваний. На основании полученных данных должны быть актуализированы программы профилактики ГУ среди населения.
ЗАКЛЮЧЕНИЕ
Значительная доля (23,1%) исследованных жителей Нижегородского региона имела повышенный уровень МК. Наиболее тесно ассоциированными с ГУ оказались такие факторы риска, как сниженная СКФ (ОШ 3,383; 95% ДИ: 2,334–4,903; p <0,001), наличие АГ (ОШ 1,767; 95% ДИ: 1,384–2,254; p <0,001) и повышенный уровень вчСРБ (ОШ 1,936; 95% ДИ 1,546–2,425; p <0,001). Группа респондентов с ГУ обладала худшим метаболическим и клиническим профилем относительно тех лиц, у которых уровень МК находится в пределах нормальных значений. Все это определяет необходимость дальнейшей работы по изучению ГУ, а также актуализации программ профилактики данного нарушения, изучения распространенности ХБП у таких лиц.



