ВВЕДЕНИЕ
Несмотря на значительные усилия, направленные на раннее выявление и профилактику хронической болезни почек (ХБП), в последние годы наблюдается неуклонный рост числа пациентов с ХБП 5 стадии, требующей проведения заместительной почечной терапии (ЗПТ) [1].
По данным диализных центров, до 95% лиц на программном гемодиализе имеют артериальную гипертензию (АГ) [1, 2]. При этом антигипертензивную терапию получают от 60 до 90% из них, а адекватный контроль АГ имеют лишь 38% [3]. Дополнительные трудности в выборе тактики антигипертензивной терапии создают и специфические гемодинамические особенности диализной популяции. Так, для большинства пациентов, получающих лечение гемодиализом, характерна следующая картина изменений артериального давления (АД) в течение интрадиализного и междиализного периодов: прогрессирующее увеличение АД между процедурами ЗПТ и его стремительное снижение во время сеанса гемодиализа. Тем не менее ряд диализных пациентов имеет аномальный гемодинамический ответ на ультрафильтрацию с повышением АД во время или сразу после сеанса гемодиализа [4]. Описанное явление известно как интрадиализная гипертензия (ИДГ).
Важно отметить, что наличие ИДГ не только усложняет контроль АД, способствует прогрессированию гипертрофии левого желудочка [5] и снижает адекватность ЗПТ у диализных пациентов, но и выступает независимым фактором риска общей и сердечно-сосудистой смертности [6, 7].
До настоящего момента предметом дискуссий остаются патофизиологические механизмы ИДГ [8]. Повышение интрадиализного АД может быть связано с неспособностью достичь оптимального «сухого веса» в условиях хронической объемной перегрузки [9], избыточной активностью ренин-ангиотензин-альдостероновой (РААС) и симпатоцадреналовой систем (САС) [10, 11], повышением уровня эндотелина-1 [12] и уменьшением выработки оксида азота [13]. Также в качестве одного из потенциальных механизмов ИДГ рассматривается падение концентрации высокодиализируемых гипотензивных препаратов во время сеанса ГД [14].
Цель исследования – изучить характер проводимой антигипертензивной терапии у пациентов на гемодиализе, оценить частоту ИДГ и выявить наиболее значимые предикторы ее развития.
МАТЕРИАЛ И МЕТОДЫ
Проведено ретроспективное исследование 131 амбулаторной карты пациентов, получавших лечение программным гемодиализом на базе отделения диализа и гравитационной хирургии крови ГБУЗ НО «НОКБ им. Н.А. Семашко».
Фиксировались демографические данные пациентов, диализный стаж, сопутствующие сердечно-сосудистые заболевания, частота ИДГ, проводимая лекарственная терапия с учетом диализируемости используемых препаратов, ряд клинико-лабораторных параметров. Все пациенты получали ЗПТ методом программного гемодиализа: по 3 сеанса в неделю, каждый сеанс длительностью по 4–4,5 ч в день в бикарбонатном режиме. Из исследования исключались пациенты со стажем гемодиализа менее 3 мес, не получавшие антигипертензивные препараты, с эпизодами ИДГ менее чем в 30% сеансов гемодиализа, а также с величиной Kt/V <1,2.
Для оценки способности лекарственных средств проходить через диализные мембраны использовались официальные инструкции к препаратам, а также специализированные рекомендации по диализируемости лекарственных препаратов [15]. К низкодиализируемым препаратам были отнесены рамиприл, хинаприл, фозиноприл, все антагонисты рецепторов ангиотензина II (АРА II) и блокаторы кальциевых каналов (БКК), индапамид, гидрохлоротиазид, хлорталидон, моксонидин, бисопролол, бетаксолол, небиволол и карведилол. Высокой способностью проходить через диализные мембраны обладали метопролол, атенолол, эналаприл, периндоприл и соталол.
Анализ полученных данных выполнялся с использованием пакета прикладных программ IBM SPSS Statistics 26 (США). Нормальность распределения переменных оценивалась с помощью теста Шапиро–Уилка. Для проверки статистической значимости различий данных номинативного характера применялся точный критерий Фишера, количественных данных – U-критерий Манна–Уитни. Также проводился корреляционный анализ с оценкой силы связи между показателями с помощью коэффициента Пирсона для количественных данных и коэффициента Спирмена для данных в ранговой шкале; отношение шансов (ОШ) в многофакторной регрессии рассчитывалось с учетом 95% доверительного интервала (ДИ). При значении р <0,05 различия считались статистически значимыми.
РЕЗУЛЬТАТЫ
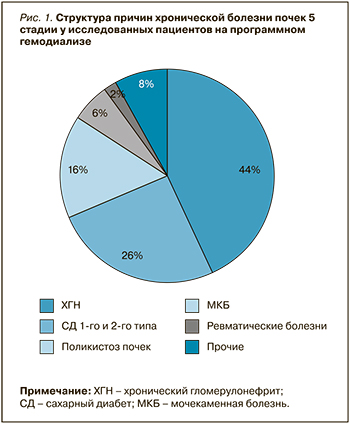
Средний возраст пациентов составил 55,7 [53,5; 58,0] лет, диализный стаж – 59,3 [51,8; 66,8] мес. Соотношение мужчин и женщин было почти равным: 52 % и 48% соответственно. Структура причин ХБП 5 стадии у пациентов на программном ГД представлена на рисунке 1. Обращает на себя внимание высокая доля диабетической нефропатии как причины прогрессирования ХБП – 26%. Среди прочих причин выхода на диализ имели место миеломная нефропатия, ишемическая болезнь почек, 1 случай ВИЧ-ассоциированной нефропатии.
Все пациенты имели артериальную гипертензию (АГ) и получали регулярную антигипертензивную терапию. С этой целью одинаково часто использовались бета-адреноблокаторы (ББ) и БКК – в 75% случаев. 45% пациентов получали АРА II, 19% – ингибиторы АПФ. Широкое применение в лечении АГ в диализной популяции нашел агонист I1-имидазолиновых рецепторов моксонидин, рекомендованный 48% лиц. Диуретики были назначены 6% пациентов с остаточной функцией почек. У 15,5% человек проводилась монотерапия, во всех остальных случаях лечение АГ требовало назначения двух и более препаратов. Частота назначения исследованным пациентам отдельных антигипертензивных средств внутри разных классов приведена на рисунке 2.
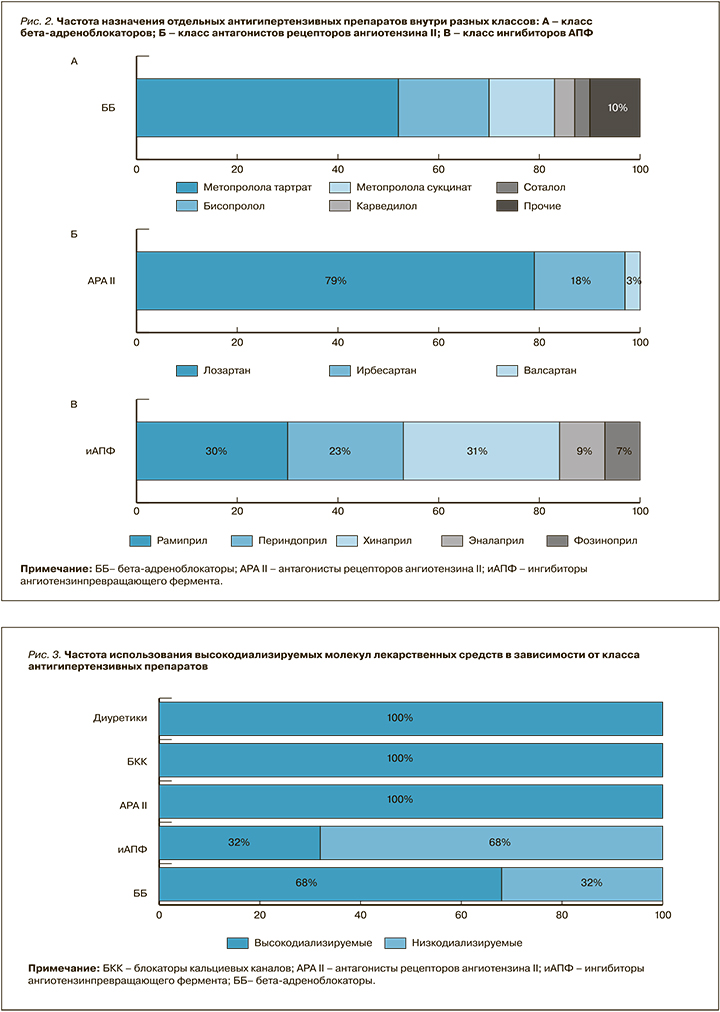
Пациенты с постинфарктным кардиосклерозом в 76% получали ББ, в случае же сопутствующей ХСН частота назначения этой группы лекарственных средств снижалась до 60%. При этом только в одном случае из пяти достигались эффективные терапевтические дозы используемых препаратов. Еще одной особенностью применения ББ было редкое использование пролонгированных форм препаратов – менее чем у 39% диализных пациентов. АРА II и ингибиторы АПФ получали 35 и 13% пациентов с ХСН соответственно. В то время, как прием ингибиторов АПФ характеризовался достижением кардиопротективных доз в 92% случаев, АРА II были оттитрованы до необходимых значений лишь у каждого десятого пациента на гемодиализе.
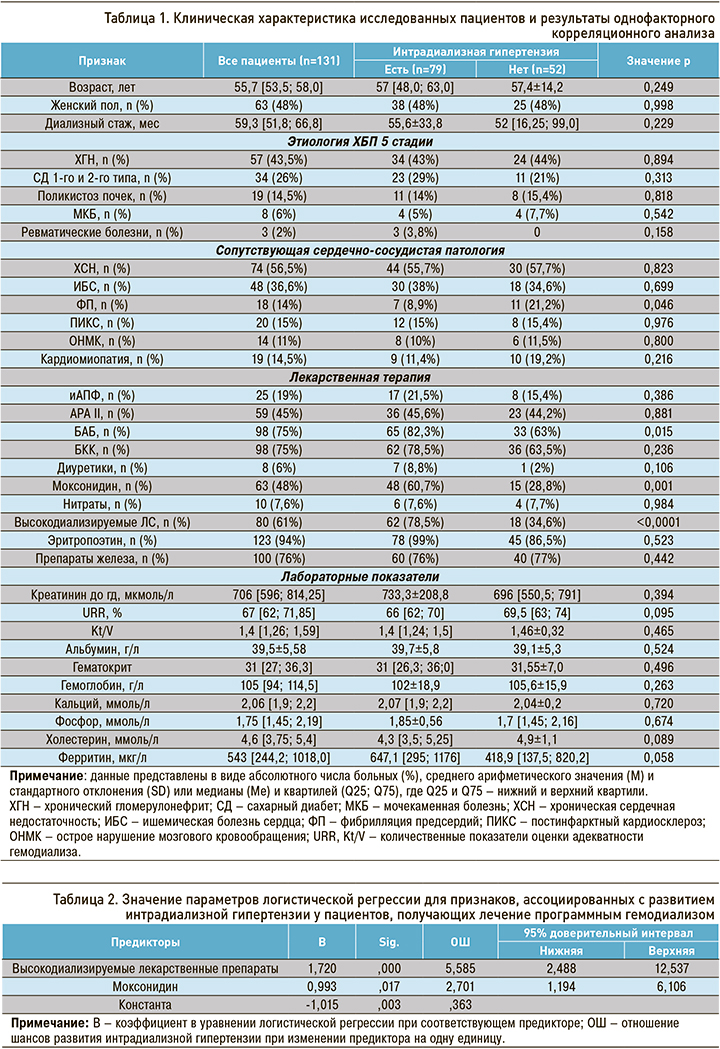
Высокодиализируемые препараты применялись у 61% пациентов: наиболее часто они использовались в группе ББ, реже – среди ингибиторов АПФ (32%). На рисунке 3 наглядно показана частота использования высокодиализируемых молекул лекарственных средств в зависимости от класса антигипертензивных препаратов.
ИДГ встречалась у 60% диализных пациентов и была ассоциирована с использованием ББ (r=0,212, p=0,015), моксонидина (r=0,313, p=0,001) и высокодиализируемых лекарственных препаратов (r=0,440, p <0,0001). В то же время наблюдалась слабая обратная корреляция между ИДГ и фибрилляцией предсердий (r=-0,175, p=0,046). Клиническая характеристика исследованных пациентов, а также данные однофакторного корреляционного анализа, отражающие значимость влияния каждого фактора на развитие ИДГ, отражены в таблице 1.
С использованием выявленных предикторов был проведен многофакторный анализ для оценки вероятности развития ИДГ. С учетом возможности негативного влияния корреляции между признаками на качество математической модели анализ был выполнен с использованием прямого метода пошагового включения переменных. Коэффициенты уравнения логистической регрессии представлены в таблице 2.
Таким образом, были получены два предиктора ИДГ по факторам, связанным с особенностями проводимой лекарственной терапии: использование препаратов с высоким диализным клиренсом (ОШ 5,585; 95% ДИ: 2,49–12,54; p <0,0001) и моксонидина (ОШ 2,701; 95% ДИ: 1,194–6,106; p=0,017).
ОБСУЖДЕНИЕ
Вопрос адекватной коррекции АГ в диализной популяции остается предметом рассмотрения не только клинической практики, но и теоретических работ. Необходимым условием и одновременно методом достижения нормотензии является обеспечение состояния «сухого веса» с помощью процедуры гемодиализа [16]. Однако этот подход оставляет значительную часть пациентов за рамками целевых значений АД [17]. Таким образом, антигипертензивная терапия становится необходимой при стандартной частоте и продолжительности гемодиализа.
Несмотря на очевидные преимущества коррекции АГ у диализных пациентов, в настоящее время отсутствует однозначная позиция в отношении выбора конкретных антигипертензивных препаратов [18]. Прямое использование действующих рекомендаций по лечению АГ не всегда применимо к диализной популяции в силу целого ряда обстоятельств.
При планировании антигипертензивной терапии в диализной популяции всегда возникает проблема корректировки доз назначаемых лекарственных средств и выбора режима терапии. На способность лекарственных веществ проходить через диализные мембраны влияет ряд факторов: технические особенности процедуры гемодиализа и характер диализной мембраны, длительность гемодиализа, размер молекулы лекарственного вещества, его гидрофильность, объем распределения, степень связывания с белками плазмы крови, проникновение лекарственного вещества в эритроциты, а также снижение межкомпартментного клиренса. У пациентов с ХБП 5 стадии, получающих лечение гемодиализом, дозы препаратов должны быть увеличены в том случае, если диализный клиренс составляет 30% и более от суммы почечного и внепочечного клиренсов [19].
Так, имеются определенные противоречия, касающиеся показаний к назначению диуретиков. Большинство европейских экспертов полагает, что они могут ограниченно применяться в случаях сохранения остаточной функции почек [20, 21]. В то же время ряд экспертов считает возможным продолжить назначение петлевых диуретиков, несмотря на утрату остаточной функции почек, с целью контроля волемического статуса, междиализной прибавки веса и уровня калия крови [22]. Блокаторы РААС широко применяются в качестве препаратов первой линии для лечения АГ во всем мире [23]. Однако их эффективность у диализных пациентов не так очевидна, как в общей популяции пациентов с АГ. Три последовательно проведенных в Японии рандомизированных клинических исследования (РКИ), изучавших гипотензивные и кардиопротективные эффекты АРА II, дали противоречивые результаты. Риски развития сердечно-сосудистых событий оказались ниже в группе, получавшей АРА II [24]. Однако данные, полученные в ходе самого масштабного на сегодняшний день РКИ (469 пациентов, срок наблюдения – 3,5 года), эту закономерность не подтвердили. При одинаковой эффективности контроля АД частота встречаемости инфаркта миокарда, инсульта, необходимости реваскуляризации миокарда и общей смертности были примерно одинаковы в леченной и контрольной группах [25]. При практическом применении блокаторов РААС необходимо учитывать также возможность их элиминации в ходе гемодиализа. С этой точки зрения применение АРА II представляется более эффективным, так как большинство препаратов этой группы не диализируются. Дигидропиридиновые БКК обладают мощным антигипертензивным эффектом и широко применяются в диализной популяции, в том числе у пациентов в состоянии перегрузки объемом. В ряде некрупных исследований продемонстрировано их положительное влияние на частоту встречаемости инсультов и коронарных событий по сравнению с плацебо [26]. Важно отметить, что фармакокинетика БКК не зависит от степени тяжести ХБП, и препараты этой группы не элиминируются во время сеанса ЗПТ.
Рациональным обоснованием применения ББ в лечении пациентов на ГД является блокада САС, находящейся в состоянии хронической гиперактивации, и эффективная профилактика кардиоваскулярных осложнений с целью снижения рисков общей и сердечно-сосудистой смертности у данных пациентов [27]. Вместе с тем эффективность ББ существенно зависит от их клиренса в ходе диализной сессии. Так, высокий диализный клиренс некоторых представителей этого класса препаратов способствует не только снижению их эффективности, но и увеличению риска серьезных аритмий и внезапной смерти. Вместе с тем снижение почечной функции у пациентов на гемодиализе уменьшает скорость экскреции гидрофильных агентов, что требует уменьшения их дозы и кратности приема. Weir M.A. et al. в ретроспективном когортном исследовании, включавшем 6588 диализных пациентов, установили связь между приемом высокодиализируемых ББ и риском общей смертности (относительный риск 1,4; 95% ДИ: 1,1–1,8; p <0,01). Стоит отметить, что авторы не обнаружили достоверных различий в частоте желудочковых аритмий между двумя группами (относительный риск 1,3; 95% ДИ: 0,9–2,0; p=0,20). Однако в данном исследовании не оценивалось наличие ИДГ и связь диализируемости ББ с частотой ее развития [28]. В ретроспективном когортном исследовании Assimon M.M. et al. стартовая терапия низкодиализируемым карведилолом была связана с увеличением риска общей (относительный риск 1,08; 95% ДИ: 1,02–1,16; p <0,05) и сердечно-сосудистой (относительный риск 1,18; 95% ДИ: 1,08–1,29; p <0,05) смертности по сравнению с терапией метопрололом [29]. Объяснение полученным результатам авторы нашли в большей частоте случаев интрадиализной гипотензии (относительный риск 1,10; 95% ДИ: 1,09–1,11; p <0,05) в группе карведилола.
В настоящей работе одним из предикторов ИДГ было применение агониста I1-имидазолиновых рецепторов моксонидина. Учитывая отсутствие однозначных данных о степени удаления моксонидина во время процедуры гемодиализа, можно рассматривать полученный результат и как причину ИДГ, и как следствие резистентной АГ, когда препарат был назначен в составе комбинированной трех- и четырехкомпонентной антигипертензивной терапии.
Таким образом, в настоящее время мы располагаем достаточно противоречивым массивом данных об эффективности и безопасности применения отдельных антигипертензивных препаратов в лечении пациентов на программном гемодиализе. Исследования, направленные на изучение диализируемости различных классов лекарственных средств, ограничены фармакокинетическими данными, которые либо являются неполными, либо неприменимыми к современным процедурам гемодиализа.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании ИДГ имела место у 60% диализных пациентов. Анализ особенностей лекарственной терапии продемонстрировал преобладание (61%) высокодиализируемых препаратов в лечении сердечно-сосудистых заболеваний у пациентов на программном гемодиализе. Использование лекарственных средств с высоким диализным клиренсом было связано с увеличением частоты развития ИДГ (ОШ 5,585; 95% ДИ: 2,49–12,54; p <0,0001). В качестве дополнительного предиктора ИДГ выступил моксонидин (ОШ 2,701; 95% ДИ: 1,194–6,106; p=0,017).



