Проблема инфаркта миокарда (ИМ) остается актуальной в связи с высокой заболеваемостью и летальностью. Ежегодно выходят новые рекомендации по ведению пациентов (2016 г. – рекомендации Российского кардиологического общества (РКО), 2017 г. – рекомендации Европейского общества кардиологов (ЕОК), 2018 г. – четвертое универсальное определение инфаркта миокарда, 2018 г. – рекомендации по реваскуляризации ЕОК), в которых представлены усовершенствованные известные методики, а также разработанные новые подходы к лечению.
В настоящее время «золотым» стандартом является тактика раннего чрескожного вмешательства (ЧКВ) по принципу «Чем раньше, тем лучше» [1–3]. Восстановление кровотока по инфарктсвязанной артерии приводит к значительному снижению риска смерти, при этом реперфузия, проведенная в первые 2–3 ч от начала ИМ, может привести к так называемому прерванному инфаркту миокарда, когда наблюдается настолько существенное уменьшение зоны ишемии, что сформированный очаг некроза является незначимым. В последующем применение реваскуляризации миокарда в срок до 12 ч снижает смертность преимущественно за счет уменьшения периинфарктной зоны. Считается, что по истечении 8 ч от начала ИМ формируется максимально возможный очаг некроза, и все поврежденные клетки миокарда погибают. Несколько менее эффективно, но в то же время признано целесообразным проведение реваскуляризации через 12–48 ч от начала ИМ [3–10]. При сроке свыше 48 ч от начала ИМ рутинное применение реваскуляризации миокарда не рекомендуется (основание – результаты исследования DANAMI 3-DEFER), но допустимо в определенных клинических случаях, таких как развитие кардиогенного шока, ранняя постинфарктная стенокардия, нарастание сердечной недостаточности, несмотря на оптимальную медикаментозную терапию [11].
Таким образом, согласно клиническим рекомендациям ЕОК по ведению пациентов с острым инфарктом миокарда с подъемом сегмента ST (2017) и аналогичным рекомендациям РКО (2016), рекомендациям по реваскуляризации миокарда ЕОК (2018), установлены следующие временные рамки проведения чрескожного вмешательства для рутинного открытия инфарктсвязанной артерии как основного метода реперфузии: 0–12 ч от начала ИМ (класс рекомендаций IА), 12–48 ч (класс рекомендаций IIA), свыше 48 ч (класс рекомендаций III) [11–13].
Из классических работ по ИМ известно, что увеличение размеров очага некроза и появление новых очагов в течение первых 72 ч от начала заболевания рассматривается как расширение (растяжение) зоны некроза, но не рецидивирование (Сыркин А.Л. и соавт., 1981; Weisman H., Healy B., 1987). Оно характеризуется появлением «свежих» очагов некроза в зоне кровоснабжения одной коронарной артерии и встречается при естественном течении ИМ в 10–86% случаев.
Это положение позволяет предполагать возможность увеличения зоны некроза как клинически явного (ранняя постинфарктная стенокардия, нарушение ритма сердца, прогрессирование сердечной недостаточности, повышение кардиоспецифических ферментов в поздние сроки ИМ, изменения на ЭКГ), так и скрытого (небольшое расширение зоны некроза, которое на фоне оптимальной медикаментозной терапии протекает малосимптомно либо бессимптомно) у большинства больных. Примером скрытого течения является умеренное повышение электрической нестабильности миокарда на фоне появления низкоамплитудной активности желудочков в результате поздней активации различных зон миокарда в периинфарктной зоне (появление поздних потенциалов желудочков, выявляемые с помощью ЭКГ высокого разрешения). При этом на фоне рутинного применения бета-адреноблокаторов происходит повышение порога возникновения фибрилляции желудочков, в связи с чем данное осложнение профилактируется и расширение зоны некроза остается незамеченным.
Вторым положением ввиду высокой распространенности расширения зоны некроза является упреждающее применение инвазивной тактики при поступлении в стационар больного ИМ вне зависимости от срока начала заболевания. Согласно Четвертому универсальному определению острого инфаркта миокарда под термином «острый инфаркт миокарда» подразумевается сочетание острого миокардиального повреждения с клиническими свидетельствами острой ишемии миокарда [13]. Повреждение кардиомиоцитов наступает спустя 15–20 мин от начала ишемии. Как только повреждение клеток становится необратимым, наступает острейший период инфаркта миокарда. Он длится первые 5–6 (по некоторым данным 8 ч). Именно в эти сроки возможно прервать течение инфаркта миокарда с минимизацией и регрессом произошедших изменений. По истечении 6 ч от начала инфаркта миокарда формируется максимально возможный очаг некроза, и все поврежденные клетки миокарда погибают. Это оптимальное время для успешного выполнения ЧКВ. В этом случае ЧКВ позволяет максимально снизить риски смерти, осложнений и повысить реабилитационный потенциал.
Целью исследования стало изучение исходов и оценка реабилитационного потенциала у больных ИМ, подвергшихся чрескожному коронарному вмешательству в различные сроки от начала заболевания.
Основные задачи:
- исследовать клинические проявления ишемической болезни сердца после ЧКВ в различные сроки острого инфаркта миокарда;
- оценить результаты лечения в конце острого периода инфаркта миокарда;
- оценить реабилитационный потенциал больных после ЧКВ, выполненного в различные сроки инфаркта миокарда.
 МАТЕРИАЛ И МЕТОДЫ
МАТЕРИАЛ И МЕТОДЫ
В исследование включены больные острым инфарктом миокарда I типа (Четвертое универсальное определение инфаркта миокарда, 2018) c элевацией сегмента ST, поступившие в отделение реанимации и интенсивной терапии клинической больницы № 1 Управления делами Президента РФ в различные временные промежутки от первых часов дебюта инфаркта миокарда до 24 ч и свыше этого срока в течение 2016–2017 гг.
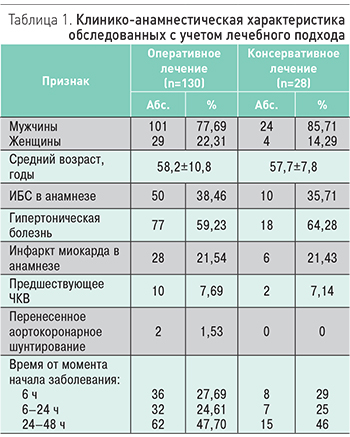
Клиническая картина, данные инструментальных и лабораторных исследований изучены у 158 больных острым инфарктом миокарда в возрасте от 22 до 85 лет (табл. 1).
В первые шесть часов заболевания ЧКВ проведено у 36 госпитализированных (группа 1); позднее шести часов, но в первые 24 ч ЧКВ выполнено у 32 пациентов (группа 2); реваскуляризация миокарда у 62 больных проведена в срок от 24 до 48 ч от начала заболевания (группа 3). У части больных (28 человек) оперативное вмешательство не проводилось, лечение осуществляли консервативными методами. Причинами выбора консервативной тактики лечения были очень высокий риск кровотечения в условиях стабильного состояния пациента (превышение потенциального риска вмешательства над его потенциальной пользой), наличие выраженной почечной недостаточности (невозможность использования рентгеноконтрастного вещества), отказ больного от процедуры (проведена разъяснительная беседа, получен письменный отказ).
Реваскуляризация миокарда трансрадиальным доступом выполнялась в максимально ранние сроки (первый час) после поступления пациента в стационар. Показанием для вмешательства являлись клинические и лабораторно-инструментальные признаки инфаркта миокарда, а также риск летального исхода, оцененный по шкале GRACE (табл. 2).
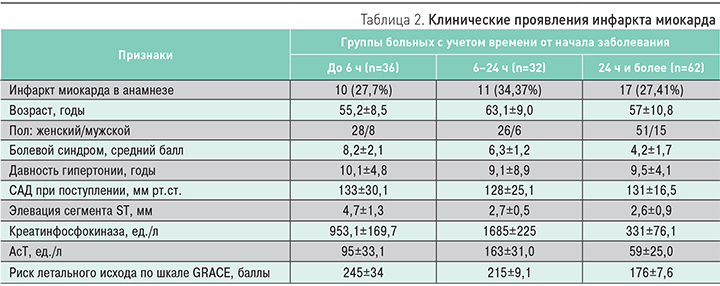
В исследовании проанализированы 104 признака, описывающие пациентов с острым инфарктом миокарда. Среди них демографические (пол, возраст) и антропометрические параметры пациентов, выраженность болевого синдрома, оцененная по шкале от 1 до 10 баллов, кардиологический анамнез, электрокардиографические и эхокардиографические признаки, лабораторные показатели, а также исходы, осложнения и сопутствующая патология. В истории болезни количественные признаки были оценены в абсолютных значениях, качественные подлежали кодировке: 0 – отсутствие признака, 1 – его наличие. Применение формализованного подхода позволило осуществить ввод данных в ЭВМ и выполнить математическую обработку данных.
Всем пациентам перед выпиской проводилась нагрузочная проба (тредмил-тест) [14] и оценка реабилитационного потенциала через 10 дней от начала заболевания.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Традиционно выделяют такие наиболее частые осложнения инфаркта миокарда, как болевой синдром (в том числе ранняя постинфарктная стенокардия), сократительная недостаточность (застойная сердечная недостаточность, отек легких, кардиогенный шок), электрическая нестабильность (различной степени выраженности нарушения ритма и проводимости сердца) и механическая несостоятельность миокарда (разрыв сердца, формирование аневризмы левого желудочка). Перечисленные осложнения можно купировать проведением чрескожного вмешательства, однако в этом случае на смену «инфаркта миокарда традиционного» приходит «инфаркт миокарда модифицируемый», и осложнения будут состоять из «традиционных» (полностью нивелированных или оставшихся в той или иной степени выраженности) и присоединившихся к ним новых, связанных с ЧКВ (реперфузионный синдром, контраст-индуцированная нефропатия и рестеноз стента).
В табл. 3 отражены исходы и осложнения инфаркта миокарда в зависимости от выбранной тактики лечения. У больных, подвергшихся ЧКВ в остром периоде инфаркта миокарда, летальность была ниже, чем в группе консервативного лечения (2,3 vs 10,7% соответственно, р <0,05). Эффективность коронарной ангиопластики составила 95%.
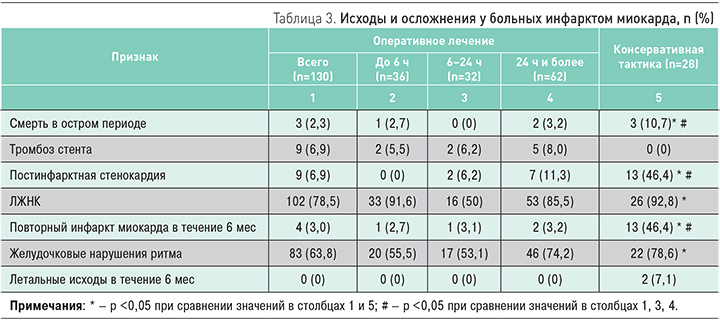
Число осложнений у больных с отсроченным ЧКВ было выше, чем при раннем вмешательстве, однако достоверно более низкая летальность и количество осложнений, по сравнению больными из группы консервативной тактики, позволяют сделать заключение о необходимости выполнения отсроченных ЧКВ при инфаркте миокарда (см. табл. 3).
Пациентам изучаемых групп перед выпиской из стационара выполнен нагрузочный тест [14, 15] и произведен расчет реабилитационного потенциала по оригинальной формуле:
Реабилитационный потенциал = Мощность выполненной нагрузки (Вт) / В + з. Q + ПСт + Ар + ЛЖНК + ПЖНК + АС, где В – возраст; з. Q – наличие патологического зубца Q на ЭКГ; ПСт – постинфарктная стенокардия; Ар – аритмия; ЛЖНК – левожелудочковая недостаточность кровообращения; ПЖНК – правожелудочковая недостаточность кровообращения; АС – аневризма сердца, оцененные в баллах.
Рассчитанные значения реабилитационного потенциала в изучаемых группах представлены в табл. 4.

Наибольшим реабилитационным потенциалом обладали пациенты, которым проведено чрескожное вмешательство в первые сутки от начала заболевания: в 3,2 раза выше, чем в группе консервативного лечения. В группах отсроченной реваскуляризации миокарда реабилитационный потенциал оказался в 1,7 раз выше, чем при консервативной тактике ведения. На основании этого можно сделать вывод, что, несмотря на дороговизну методики и риски возможных осложнений, ЧКВ является более эффективным лечебным подходом, обеспечивающим более полноценную реабилитацию больных острым инфарктом миокарда.
Таким образом, проведение реваскуляризации миокарда даже на поздних этапах острого инфаркта миокарда позволяет существенно повысить реабилитационный потенциал больных.
ВЫВОДЫ
- Проведение ЧКВ в первые 48 ч от начала ИМ (свершившийся инфаркт) ассоциировано с более низким показателем летальности, чем в группе консервативного лечения.
- Выполнение ЧКВ в первые 6 ч от начала ИМ (развивающийся инфаркт) позволяет минимизировать последствия ИМ.
- Реабилитационный потенциал больных ИМ в 3,2 раза выше при ЧКВ в первые сутки заболевания и в 1,6 раз выше при ЧКВ в срок 24–48 ч от начала заболевания по сравнению с консервативной тактикой ведения.



