Множественные интерпопуляционные исследования, проведенные в течение первого десятилетия XXI в., показали, что с нарастанием предопухолевых изменений нарастает и заболеваемость раком.
В 1988 г. Р. Correa постулировал последовательность патологических изменений в слизистой оболочке желудка (СОЖ) при хроническом гастрите (ХГ) от нормального состояния до возникновения рака (рис. 1).
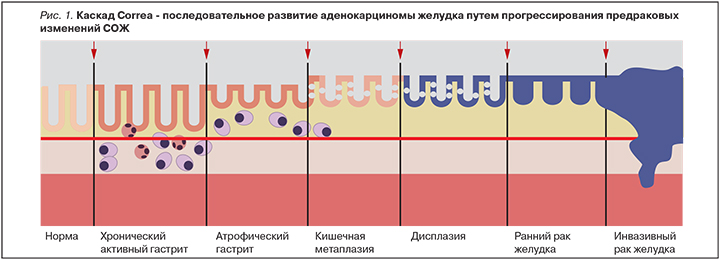
Этапы каскада Correa – атрофия, кишечная метаплазия (КМ) и дисплазия – рассматриваются как предраковые изменения СОЖ. Впоследствии процесс перестройки СОЖ был модифицирован P. Correa с включением роли Н. pylori в начало последовательности патологических изменений.
«Золотым стандартом» диагностики патологических изменений СОЖ на современном уровне развития медицинской науки и практики является эзофагогастродуоденоскопия с применением витальных красителей или использованием режимов увеличительной ZOOM- и узкоспектральной NBI-эндоскопии, что позволяет произвести прицельную биопсию с высокой вероятностью выявления изменений на раннем этапе развития.
В настоящее время под термином «каскад Correa» понимают последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ.
В 2005 г. двое патологов, M. Rugge (Италия) и R. Genta (США), предложили использовать новую систему классификации ХГ, оценки его степени и стадии. Под степенью гастрита понималась выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Данная система получила название международной классификации ХГ (Сиднейская система и ее Хьюстонская модификация [10]).
В 2008 г. была сформирована новая международная группа, включающая ряд известных экспертов-патологов и гастроэнтерологов-клиницистов – Atrophy Club, которая разработала систему определения стадий ХГ под названием OLGA и OLGIM [10, 11, 12]. В ней использован интегральный подход с оценкой гистологической выраженности атрофии в антральном отделе и теле желудка с определением количества баллов в каждом биоптате.
Благодаря разработанным системам оценки состояния СОЖ при ХГ, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе [8, 10].
Согласно предложенной модели, ХГ прогрессирует с развитием атрофии и КМ. А при определенных геномных изменениях у лиц с метаплазированным эпителием происходит развитие дисплазии с возможным прогрессированием в инвазивную опухоль.
ОБСЕМЕНЕНИЕ НELICOBACTER PYLORI
Главной морфологической особенностью хеликобактерного гастрита (синонимы: хронический антральный гастрит, гастрит типа В) является наличие на СОЖ самих Н. pylori, которые выявляются не только в бактериальной форме, но и в виде кокков.
 Первым этапом развития инфекции является колонизация СОЖ бактериями с последующим преодолением кислотного и слизисто-бикарбонатного барьеров желудка. Уреаза хеликобактерий, в отличие от других бактериальных уреаз, находится не только в цитоплазме, но также ферментативно активна на поверхности микробов. Поэтому при поступлении мочевины из плазмы крови путем транссудации происходит ее гидролиз с образованием щелочных продуктов, что приводит к повышению рН и формированию защитного аммиачного облака вокруг микроорганизма, нейтрализующего соляную кислоту.
Первым этапом развития инфекции является колонизация СОЖ бактериями с последующим преодолением кислотного и слизисто-бикарбонатного барьеров желудка. Уреаза хеликобактерий, в отличие от других бактериальных уреаз, находится не только в цитоплазме, но также ферментативно активна на поверхности микробов. Поэтому при поступлении мочевины из плазмы крови путем транссудации происходит ее гидролиз с образованием щелочных продуктов, что приводит к повышению рН и формированию защитного аммиачного облака вокруг микроорганизма, нейтрализующего соляную кислоту.
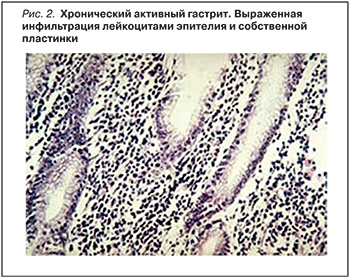
Активный ХГ характеризуется нейтрофильной инфильтрацией СОЖ и повреждениями эпителия. Хроническое воспаление происходит вследствие адгезии микроба на желудочный эпителий. Морфологически такое воспаление характеризуется инфильтрацией собственной пластинки СОЖ нейтрофилами (рис. 2). В настоящее время считается, что в нормальной СОЖ содержится не более 2–5 лимфоцитов, плазматических клеток и макрофагов в поле зрения. Наличие 1–2 плазмоцитов уже свидетельствует о хроническом воспалении [1].
Выраженность нейтрофильной инфильтрации может быть различной, что определяет деление активного гастрита на стадии (рис. 3).

При 1-й стадии имеется умеренная лейкоцитарная инфильтрация собственной пластинки СОЖ, при 2-й – она более выражена и распространяется на эпителий как поверхностный, так и ямочный. При 3-й стадии наряду с выраженной инфильтрацией собственной пластинки и эпителия наблюдаются «внутриямочные» абсцессы, по макроскопическим признакам сходные с крипт-абсцессами в толстой кишке при неспецифическом язвенном колите.
Нейтрофильную инфильтрацию активируют и сами Н. pylori, и цитокины, вырабатываемые эпителием желудка под влиянием хеликобактера. Схожие изменения можно наблюдать в краях язв.
Вовлечение Н. pylori в процесс является пусковым механизмом запуска атрофических изменений СОЖ.
АТРОФИЯ
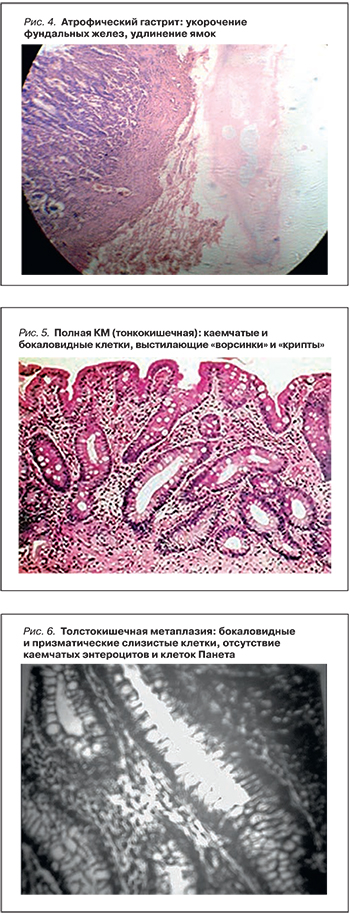 Атрофия СОЖ (рис. 4) – это утрата желудочных желез с замещением их метаплазированным эпителием или фиброзной тканью.
Атрофия СОЖ (рис. 4) – это утрата желудочных желез с замещением их метаплазированным эпителием или фиброзной тканью.
Данное состояние является следствием нарушенного клеточного обновления. При этом принимается во внимание следующее обстоятельство: чем сильнее выражена атрофия и велика площадь поражения СОЖ, тем выше риск развития рака желудка [10].
Атрофия может быть также результатом аутоиммунного гастрита (АМГ) и длительного рефлюкс-гастрита.
АМГ (синонимы: гастрит типа А, диффузный гастрит тела желудка) ассоциирован с пернициозной анемией. Морфологически АМГ характеризуется резко выраженной атрофией фундальных желез с КМ, наличием антител против париетальных клеток и внутреннего фактора. Антитела связываются с микроворсинками париетальных клеток и блокируют соединение витамина В12 с внутренним фактором. Следствием этого является дефицит внутреннего фактора, вырабатываемого париетальными клетками, что ведет к нарушению абсорбции витамина В12 и развитию пернициозной анемии. Признаком АМГ является гиперплазия G-клеток, проявляющаяся гипергастринемией. В норме функция G-клеток регулируется по принципу отрицательной обратной связи. Она усиливается при повышении рН желудочного сока и тормозится при секреции кислоты. Атрофия фундальных желез, свойственная АМГ, ведет к ахлоргидрии и постоянной стимуляции G-клеток с развитием гипергастринемии. Высокий уровень циркуляции гастрина, в свою очередь, является причиной гиперплазии ECL-клеток вплоть до развития карциноидов, а также гиперплазии Р-клеток. Карциноиды, развивающиеся на фоне АМГ, более чем в 88% случаев характеризуются доброкачественным течением и малыми размерами, чем отличаются от карциноидов, возникающих на фоне гастритов других типов. При АМГ СОЖ инфильтрирована мононуклеарными клетками. Однако имеются определенные особенности: в фундальном отделе отмечается шестикратное повышение содержания В-лимфоцитов, а также Т-хелперов.
Наиболее частыми причинами рефлюкс-гастрита (синонимы: гастрит типа С, химический гастрит) являются рефлюкс желчи, приводящий к атрофии в результате повреждения СОЖ желчными кислотами, а также применение нестероидных противовоспалительных препаратов [1, 6].
КИШЕЧНАЯ МЕТАПЛАЗИЯ
КМ представляет собой переход от желудочного эпителия к тонко- или толстокишечному эпителиальному фенотипу. КМ может быть полной и неполной. Полную или тонкокишечную метаплазию к предраковым изменениям не относят (рис. 5).
Это связано с высокой степенью дифференцировки эпителия и низким коэффициентом злокачественности. Морфологически полная тонкокишечная метаплазия (тип I) характеризуется появлением клеток Панета и бокаловидных клеток.
Большим коэффициентом злокачественности обладает неполная или толстокишечная метаплазия (рис. 6).
Клетки толстокишечной метаплазии содержат сульфомуцины, предохраняющие клетки от повреждения пепсином и желчными кислотами. Неполная толстокишечная метаплазия (тип II и III) характеризуется также появлением призматического эпителия и бокаловидных клеток, свидетельствующих о наиболее выраженных нарушениях дифференцировки клеток эпителия желудка. Эти изменения и являются маркерами более высокого риска малигнизации, особенно в сочетании со значительной площадью замещения ими желудочного эпителия [1, 10].
ДИСПЛАЗИЯ
Дисплазия – это замещения желудочного или кишечного эпителия клетками с различной степенью атипии, утратой полярности. Дисплазия отличается от гиперплазии тем, что при последней нет качественных изменений эпителия. Локализуется дисплазия чаще всего в антральном отделе (64–74%), реже в теле (14–15%) и дне желудка (10–15%). О дисплазии СОЖ говорят при наличии клеточной атипии, дисдифференцировки эпителия в пределах собственной пластинки слизистой оболочки.
Первоначально выделяли 3 типа дисплазии:
- слабая дисплазия (1-я степень) встречается наиболее часто. Связана с усиленным клеточным обновлением и является пограничным состоянием между гиперплазией и истиной дисплазией; характеризуется удлинением ямок, увеличением диаметра и гиперхроматозом ядер;
- при умеренной дисплазии (2-я степень) выраженность этих изменений нарастает;
- тяжелая дисплазия (3-я степень) характеризуется клеточной атипией, анизокариозом, гиперхроматозом ядер.
Границ между слабой и умеренной степенями дисплазии нет, и диагностика их субъективна. В связи с этим был введен термин «интраэпителиальная неоплазия» (ИЭН) низкой и высокой степени. ИЭН низкой степени характеризуется анизокариозом, гиперхроматозом ядер с отчетливыми ядрышками. При ее выявлении необходим пересмотр двумя морфологами и динамическое наблюдение в виде повторных эндоскопий через 1, 3, 6 мес. При сохраняющемся уровне изменений в дальнейшем рекомендуется эндоскопический осмотр с забором биопсии 1 раз в год.
ИЭН высокой степени характеризуется гиперхроматозом и полиморфизмом ядер и считается облигатным предраком. При генетических исследованиях определяются нарушения экспрессии генов р53 и АРС, выявляется мутация генов-супрессоров опухоли (PCNA, Ki-67, p53), снижается апоптоз (bcl-2, Bax), повышается экспрессия онкопротеинов C-erb B2 и муцина Muc-2, снижается экспрессия Muc-5АС. [2]
При ИЭН высокой степени необходимо провести множественные повторные биопсии и морфологическое исследование биопсийного материала двумя независимыми морфологами с целью доказательства отсутствия рака в исследуемом материале. При подтверждении диагноза проводится курс интенсивной консервативной терапии в течение 1 мес (применяются ингибиторы протонной помпы в двойной дозе). Сохраняющаяся ИЭН высокой степени через 1 мес после проведенной терапии требует эндоскопического внутрипросветного, а возможно, и хирургического лечения [1, 3, 9].
Эрадикационная антихеликобактерная терапия пациентов с предопухолевыми изменениями СОЖ позволяет снизить риск развития рака желудка. Ряд исследователей получили данные, что после ее проведения происходит регресс молекулярно-биологических изменений: снижается мутация генов-супрессоров опухоли (PCNA, Ki-67, p53), увеличивается апоптоз (bcl-2, Bax), снижается экспрессия онкопротеинов C-erb B2 и муцина Muc-2, увеличивается экспрессия Muc-5AC. [2]. Однако индуцированные H. pylori морфологические изменения могут сохраняться и после проведенного курса лечения. Такой группе пациентов необходимо динамическое эндоскопическое наблюдение с использованием уточняющих методик и прицельной биопсией СОЖ не реже 1 раза в год для контроля риска гастроканцерогенеза.
ЗАКЛЮЧЕНИЕ
Эрадикационная терапия у больных с предопухолевыми изменениями СОЖ позволяет снизить риск развития рака желудка. Пациентам с запущенным H. pylori гастроканцерогенезом необходимы динамическое наблюдение и лечение в зависимости от уровня выявленных морфологических изменений.



