На сегодняшний день известно, что заболевания почек вносят значимый вклад в ухудшение состояния здоровья населения, а также общую смертность наряду с такими заболеваниями, как сахарный диабет, гипертоническая болезнь и ожирение. Показано, что в популяции распространенность хронической болезни почек (ХБП) составляет более 13,4%, при этом у лиц старше 70 лет достигает 35% [1, 2]. Рост патологии почек, наблюдающийся в последние десятилетия, ассоциируется с увеличением больных ХБП терминальной стадии, численность которых в настоящее время составляет более 100 на миллион населения [3]. Наиболее оптимальным методом лечения терминальной стадии ХБП является трансплантация почек.
Несмотря на то что трансплантация почек показывает высокую эффективность лечения терминальной стадии ХБП, остается ряд трудностей, связанных с прогрессирующей хронической дисфункцией трансплантата с исходом в терминальную ХБП и особенно в отдаленный период после проведенного вмешательства [4]. Так, через год после выполнения оперативного вмешательства число функционально активных трансплантатов составляет 90%, тогда как через 5 лет – 70%, а по истечении 10–15 лет лишь 50% функционирующих трансплантатов [5, 6]. Основной причиной падения функциональной способности трансплантата является эндотелиальная дисфункция в сосудах почки и системном кровотоке. Триггерным фактором в возникновении дисфункции эндотелия является операционная травма, связанная с трансплантацией органа и сопровождающаяся развитием ишемии и реперфузии, что индуцирует появление изменений в донорском органе. Наиболее значимым патогенетическим фактором, индуцирующим прогрессирование гломерулярных поражений почек, является нарушенная эндотелиальная функция и главным образом эндотелий-зависимая вазоконстрикция [7].
Известно, что вазоконстрикция, обусловленная поврежденным эндотелием, в наибольшей мере зависит от экспрессии эндотелина-1 (ЭТ-1), синтез которого инициируется ангиотензином-II, тромбоксаном А2, норадреналином, растяжением сосудистой стенки, различными факторами роста и тромбином. В нормальных условиях синтез ЭТ-1 происходит только при стимуляции эндотелия. Со степенью эндотелиальной дисфункции также коррелируют содержание в крови С-реактивного белка (СРБ) и ингибитора активатора плазминогена 1 типа (PAI-1) [8, 9]. СРБ является центральным белком острой фазы воспаления, его экспрессия способна стимулировать захват липопротеидов низкой плотности макрофагами и усиливать продукцию различных цитокинов, активируя систему комплемента, а также потенцируя адгезию лейкоцитов сосудистым эндотелием.
Нарушение баланса между релаксирующими и констрикторными факторами, антикоагулянтами и прокоагулянтами, факторами роста и их ингибиторами является пусковым моментом в формировании каскада патологических процессов, приводящих к нарушению функции почечного трансплантата. Ассоциативная связь между нарушением функции эндотелия и органическим поражением почек представляется закономерной, но недостаточно изучена, что является перспективным направлением, особенно в аспекте уточнения связи между эндотелиальной дисфункцией и снижением скорости клубочковой фильтрации (СКФ).
 Целью нашего исследования стало изучение взаимосвязи нарушений функции эндотелия у пациентов в позднем периоде после трансплантации почки.
Целью нашего исследования стало изучение взаимосвязи нарушений функции эндотелия у пациентов в позднем периоде после трансплантации почки.
МАТЕРИАЛ И МЕТОДЫ
Для решения поставленной цели на базе клиник Самарского государственного университета выполнено одномоментное проспективное наблюдательное исследование. В период с января 2011 по август 2014 г. в него были включены 79 пациентов (женщины – 54,4%) с терминальной почечной недостаточностью, которым выполнена первичная трупная аллотрансплантация почки.
Терминальная почечная недостаточность чаще была обусловлена неуточненной морфологической формой хронического гломерулонефрита (n=68), реже в исходе мочекаменной болезни (n=5), аномалиями развития мочеполовой системы и дисфункции мочевого пузыря, сопровождающейся рефлюкс-нефропатии (n=4); синдромом Альпорта (n=2). Возраст посмертных доноров составил 19–64 года (средний возраст 41,5±3,5 года). Основная причина смерти доноров – черепно-мозговая травма (55%) и острое нарушение мозгового кровообращения (45%). Период холодовой ишемии трупной почки составил 12,5–23 ч; медиана – 17,7 ч.
 К критериям невключения в исследование относились сахарный диабет, онкологическое заболевание, текущие инфекционные заболевания в стадии обострения, значимое атеросклеротическое поражение, острое отторжение, тромботические осложнения, чрезмерно высокие концентрации такролимуса, а также наличие в послеоперационном анамнезе хирургических осложнений.
К критериям невключения в исследование относились сахарный диабет, онкологическое заболевание, текущие инфекционные заболевания в стадии обострения, значимое атеросклеротическое поражение, острое отторжение, тромботические осложнения, чрезмерно высокие концентрации такролимуса, а также наличие в послеоперационном анамнезе хирургических осложнений.
Все обследованные пациенты получали стандартную трехкомпонентную базисную иммуносупрессивную терапию, которая включала микофеноловую кислоту (720 мг/сут), метилпреднизолон (2 мг/сут) и обязательно пролонгированную форму такролимуса (6–5 нг/мл). Сопутствующую терапию принимали все пациенты, а именно: антагонисты кальция (амлодипин по 5 мг/сут), ингибиторы АПФ (эналаприл в дозе 10 мг/сут), статины (аторвастатин по 20 мг/сут). Для оценки функционального состояния почечного трансплантата использовался показатель СКФ. Все обследованные больные были разделены на две группы в зависимости от критерия СКФ, использованного для оценки функционального состояния почечного трансплантата. У пациентов 1-й группы (n=52) показатель СКФ был меньше 60 мл/мин, у 2-й группы (n=27) – от 60 мл/мин и больше.
 Расчет СКФ выполнятся с применением почечного калькулятора в соответствии с формулой CKD-EPI (2012). Хроническая дисфункция трансплантата предполагалась по особенностям клинического течения. В 30% случаев отсутствие острого отторжения подтверждено с помощью морфологического метода диагностики – протокольной биопсии трансплантата.
Расчет СКФ выполнятся с применением почечного калькулятора в соответствии с формулой CKD-EPI (2012). Хроническая дисфункция трансплантата предполагалась по особенностям клинического течения. В 30% случаев отсутствие острого отторжения подтверждено с помощью морфологического метода диагностики – протокольной биопсии трансплантата.
Оценка показателя уровня эндотелина (ЭТ-1) производилась с помощью иммуноферментного анализа тест-системой Biomedical ENDOTELIN (1-21) ЗАО «БиоХимМак», оценка уровня ингибитора активатора плазминогена (PAI-1) на анализаторе Antigen PAI-1 ELISA, определение CРБ по стандартной общеклинической методике.
Для определения различий по анализируемому признаку использован непараметрический критерий Манна–Уитни (U). Корреляционные связи между признаками оценивались с помощью коэффициента корреляции Спирмена (Rs). Достоверность полученных результатов констатировалась при вероятности ошибки p <0,05.
Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом Самарского государственного медицинского университета
 РЕЗУЛЬТАТЫ
РЕЗУЛЬТАТЫ
Обследованные группы пациентов были сопоставимы по полу и возрасту. Средний возраст больных 1-й группы составил 39,4±11,7 года, 2-й группы – 41,6±8,5 года. Соотношение мужчин и женщин в 1-й группе составило 44/56%; во 2-й – 48/52%. Пациенты обеих групп не имели статистически значимых различий по показателям протеинурии (1-я группа – 0,45±0,09 г/л, 2-я группа – 0,51±0,06 г/л; p=0,089) и уровню систолического артериального давления (САД) (1-я группа – 145±8,2 мм рт.ст., 2-я группа – 137±5,6 мм рт. ст.; р=0,094) и диастолического артериального давления (ДАД) (1-я группа– 82±4,3 мм рт.ст., 2-я группа – 87±5,1 мм рт.ст., р=0,135).
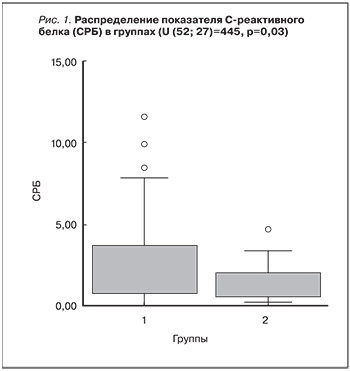
Проведенный анализ различий по уровню СРБ (рис. 1), показал, что в 1-й группе больных медиана концентрации СРБ составила 1,9 мг/л (1,1–6,2), разброс – от 0 до 37 мг/л. Во 2-й группе больных медиана концентрации СРБ была равна 0,9 мг/л (0,7–2,3) мг/л, разброс – от 0,2 до 67,8 мг/л. Различия между двумя группами больных были статистически значимыми: U (52;27)=445, р=0,03.
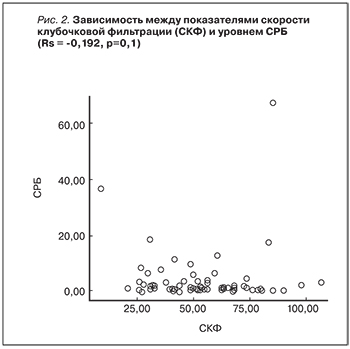
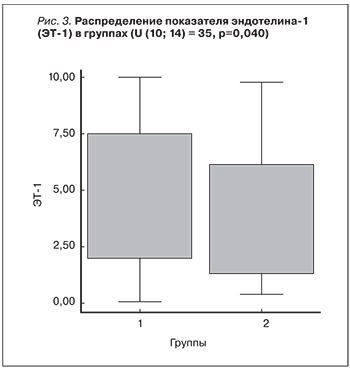
 При анализе взаимосвязи показателей СКФ и уровня СРБ (рис. 2) статистически значимой линейной корреляционной связи выявлено не было (Rs=-0,192; р=0,1). Нами установлено, что в 1-й группе пациентов наблюдались значительно более высокие показатели концентрации ЭТ-1. Так, в 1-й группе медиана концентрации ЭТ-1 составила 6,8 нг/мл [6, 9], разброс – от 1,6 до 9,9 нг/мл. При этом во 2-й группе медиана концентрации ЭТ-1 была равна 2,4 нг/мл [1, 3, 6, 8], разброс – от 0,1 до 9,7 нг/мл. Значимость различий по концентрации ЭТ-1 в группах пациентов (рис. 3) подтверждалась критерием Манна–Уитни U (10–14)=35; р=0,04. При анализе взаимосвязи показателей СКФ и уровня ЭТ-I статистически значимой корреляционной связи не выявлено: Rs=-0,358; р=0,09.
При анализе взаимосвязи показателей СКФ и уровня СРБ (рис. 2) статистически значимой линейной корреляционной связи выявлено не было (Rs=-0,192; р=0,1). Нами установлено, что в 1-й группе пациентов наблюдались значительно более высокие показатели концентрации ЭТ-1. Так, в 1-й группе медиана концентрации ЭТ-1 составила 6,8 нг/мл [6, 9], разброс – от 1,6 до 9,9 нг/мл. При этом во 2-й группе медиана концентрации ЭТ-1 была равна 2,4 нг/мл [1, 3, 6, 8], разброс – от 0,1 до 9,7 нг/мл. Значимость различий по концентрации ЭТ-1 в группах пациентов (рис. 3) подтверждалась критерием Манна–Уитни U (10–14)=35; р=0,04. При анализе взаимосвязи показателей СКФ и уровня ЭТ-I статистически значимой корреляционной связи не выявлено: Rs=-0,358; р=0,09.
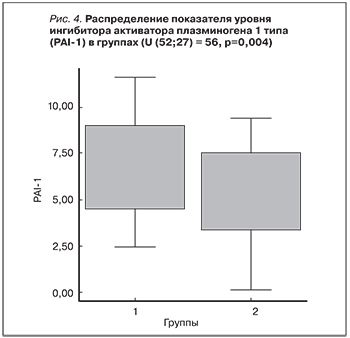
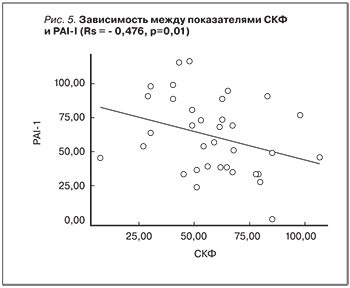
Анализ различий концентрации PAI-1 в сыворотке крови показал достоверность различий между группами: критерий Манна–Уитни (52–27)=56; р=0,004. В 1-й группе больных медиана концентрации PAI-1 в сыворотке крови составила 85,6 нг/ мл (58,8–98,9), разброс от 38,9 до 117 нг/ мл. Во 2-й группе медиана концентрации PAI равнялась 48,7 нг/мл (33,4–73,0), разброс от 0 до 94,2 нг/мл. Данные сравнительного анализа по PAI в обеих группах представлены на рис. 4. При анализе взаимосвязи показателей СКФ и уровня PAI-I выявлена отрицательная статистически значимая корреляционная связь: Rs=-0,476; р=0,01 (рис. 5).
ОБСУЖДЕНИЕ
Высокий риск дисфункции трансплантата ассоциируется с низкой СКФ. Результаты настоящего исследования согласуются с данными других авторов, где выявлена тесная корреляционная связь между уровнем высокочувствительного СРБ и выраженностью дисфункции эндотелия, определяемой с помощью оценки изменения диаметра плечевой артерии по стандартной методике у пациентов после трансплантации почки [7]. Наши результаты согласуются с данными предыдущих исследований. Так, показано, что одним из факторов прогрессирования ХБП является эндотелий-зависимая вазоконстрикция, преимущественно обусловленная экспрессией ЭТ-1. Продукция ЭТ-1 инициируется различными факторами, такими как норадреналин, ангиотензин-II, аргинин, вазопрессин, тромбоксан А2, инсулин, брадикинин, растяжение сосудистой стенки, гипоксия, интерлейкин-1 (ИЛ-1), глюкокортикостероиды, трансформирующий фактор роста, эндотоксины, внеклеточный калий [10]. Трансплантация почки сопровождается активацией иммунной системы и экспрессией провоспалительных факторов. Эндотелий также участвует в развитии воспаления посредством экспрессии провоспалительных молекул, таких как E-селектин, PAI-I, ЭТ-1, ИЛ-8, ИЛ-1β [7].
Эндотелий способен регулировать процесс воспаления, гемореологию, тромбообразование, сосудистый тонус и обусловливает защиту целостности сосудистой стенки. Эндотелий также принимает участие в атерогенезе [7]. Эндотелиальные клетки кровеносных сосудов в норме обладают антиагрегационной, фибринолитической активностью, обеспечивают сохранение баланса антикоагулянтного и протромбогенного потенциала. Прокоагуляционная функция эндотелия регулируется тромбоспондином, ЭТ-1, фактором активации тромбоцитов, фибронектином, фактором Виллебранда, ангиотензином IV, PAI-1, СРБ, тромбоцитарным фактором роста. При этом антикоагуляционная функция такими факторами, как тромбомодулин, простациклин 2, тканевой активатор плазминогена и оксид азота.
В этом исследовании, а также в проведенных ранее показано, что у пациентов 1-й группы, имеющих СКФ <60 мл/мин, наблюдается достоверное увеличение концентрации прокоагулянтных факторов ЭТ-1, СРБ, PAI-I [11]. Этот факт свидетельствует о наличии эндотелиальной дисфункции, и соответственно можно предполагать повышение склонности к тромбообразованию в почечных капиллярах у таких пациентов, что создает условия для прогрессирования ХБП.
ЗАКЛЮЧЕНИЕ
В группе пациентов после аллогенной трансплантации почки с СКФ <60 мл/мин между показателями PAI-1 и СКФ выявлена статистически значимая отрицательная корреляционная связь. Установлено, что в этой группе больных имеют место высокий риск дисфункции трансплантата и худшие показатели функции эндотелия, что можно рассматривать как прогностически неблагоприятный признак в позднем послеоперационном периоде.



