Глобальное бремя сахарного диабета (СД) продолжает возрастать. На сегодняшний день СД страдает более 463 млн человек во всем мире, и, согласно прогностическим моделям, к 2045 г. количество больных может увеличиться до 700 млн [1]. По данным Государственного регистра сахарного диабета, в России это заболевание диагностировано у 4 584 575 человек, при этом СД 2 типа выявлен у 92,4% (4,24 млн) пациентов [2].
Основной причиной смерти пациентов с СД 2 типа являются атеросклеротические сердечно-сосудистые заболевания (ССЗ) [3]. Также общеизвестно, что пациенты с СД 2 типа имеют в 2–4 раза более высокий риск сердечной недостаточности, чем пациенты без СД [4]; у них отмечается раннее развитие диастолической дисфункции левого желудочка. Кроме того, заболеваемость и смертность при сердечной недостаточности выше у больных СД 2 типа, чем у пациентов без него. Сообщается, что распространенность диабета у пациентов с сердечной недостаточностью составляет от 25 до 40% [5]. При сердечной недостаточности уровень летальности обратно пропорционален скорости клубочковой фильтрации (СКФ), которая выступает таким же значимым прогностическим фактором, как и величина фракции выброса левого желудочка или функциональный класс сердечной недостаточности по NYHA.
Диабетическая нефропатия – один из самых частых этиологических факторов хронической болезни почек (ХБП), в 30% случаев она может прогрессировать до терминальной почечной недостаточности (ТПН) [6]. На фоне выраженных нарушений функции почек ускоряется развитие сердечно-сосудистой патологии, повышается риск внезапной смерти, в связи с чем многие пациенты не доживают до развития ТПН [7, 8]. Так, по данным исследований, пациенты с СД 2 типа и ХБП имели очень высокий риск развития инфаркта миокарда и смерти от сердечно-сосудистых причин, при этом у 40% пациентов сердечно-сосудистые осложнения возникали в течение 5 лет [9].
При поражении одного из органов, почек или сердца, вследствие активации ренин-ангиотензиновой и симпатической нервной системы, развития эндотелиальной дисфункции и хронического системного воспаления формируется порочный круг – патофизиологическое состояние, при котором сочетание кардиальной и почечной дисфункции приводит к быстрому снижению функциональной способности каждого из органов. Таким образом, между функциональным состоянием почек и сердечно-сосудистыми осложнениями имеется тесная взаимосвязь [10].
Понимание последовательности и исходов патологических процессов сердечно-сосудистой системы и почек позволяет рассмотреть кардиоренальные взаимоотношения как цепь непрерывных событий – кардиоренальный континуум (рис.).
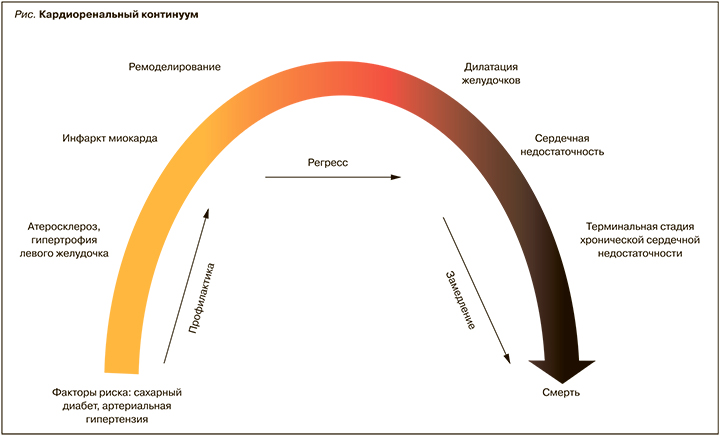
Кардиоренальный континуум включает последовательное развитие сопутствующих ССЗ и поражение почек, которые возникают в результате влияния факторов риска, системных заболеваний и связанных с ними нейрогормональных, воспалительных, иммунологических и фиброзных изменений. Общие патофизиологические пути могут приводить к различным клиническим проявлениям: например, в сердце – к развитию сердечной недостаточности, в почках – острому повреждению почек или ХБП.
Следует напомнить, что ССЗ и ХБП имеют схожие, если не сказать единые, этиопатогенетические факторы риска, такие как артериальная гипертензия (АГ), ожирение, дислипидемия, нарушения метаболизма глюкозы, курение и др. Представленные факторы риска действуют двунаправленно и придают всей кардиоренальной системе патогенетическую устойчивость [11].
Также нельзя отрицать существование тесной связи кардиоренальных и метаболических нарушений. Нарушения углеводного обмена тесно связаны с развитием как сердечно-сосудистой патологии, так и почечной дисфункцией, что обусловлено сочетанием гипергликемии с другими нарушениями обмена и АГ.
На основании общности факторов риска и патофизиологических механизмов развития этих заболеваний, подходов к первичной и вторичной профилактике некоторые авторы предлагают ввести совершенно новое понятие – кардиоренометаболический синдром [12]. А на недавнем конгрессе Американской диабетической ассоциации (ADA, 2020) даже рассматривался вопрос о необходимости создания новой субспециальности – кардиометаболической медицины [13].
Очевидно, что ранняя профилактика сердечно-сосудистых осложнений, воздействие на множественные факторы риска представляют собой очень важную задачу. Изменение образа жизни является ключевым шагом в оказании помощи пациентам с СД 2 типа. Модификация факторов риска открывает перспективы первичной профилактики не только ССЗ, но и ХБП. Однако большинству пациентов в конечном итоге требуется и медикаментозная терапия.
Сейчас в связи с последними достижениями эндокринологии кардинально изменились представления о патогенезе и лечении СД 2 типа. В управлении этим заболеванием необходимо применение мультидисциплинарного и многофакторного подходов. Обсуждаются не только стратегии контроля гликемии при СД, хотя это, безусловно, важно, но и вопросы кардио- и нефропротекции, лечение дислипидемии, ожирения, неалкогольной жировой болезни печени. Вместо исключительно глюкозоцентрического подхода следует использовать стратегии, которые могут снизить риск сердечно-сосудистых и почечных событий, используя новые препараты и осуществляя комплексный контроль всех факторов риска ССЗ. Клинические исследования показали, что ингибиторы натрий-глюкозного котранспортера-2 (НГЛТ-2) успешно справляются с этой задачей.
НОВЫЙ КЛАСС – НОВЫЕ ВОЗМОЖНОСТИ
Ингибиторы НГЛТ-2 – относительно новый класс пероральных сахароснижающих препаратов, которые воздействуют на переносчиков глюкозы, расположенных в проксимальных извитых почечных канальцах [14]. Механизм действия этих лекарственных средств заключается в подавлении активности натрий-глюкозного транспортера 2 типа, в результате чего блокируется реабсорбция глюкозы в почках и увеличивается ее выведение с мочой. Вместе с глюкозурией усиливается и натрийурез, приводящий к незначительному осмотическому диурезу [14]. Соответственно антигипергликемическое действие ингибиторов НГЛТ-2 не связано с увеличением секреции инсулина и сопровождается низким риском развития гипогликемии [15].
В дополнение к снижению уровня глюкозы ингибиторы НГЛТ-2 продемонстрировали негликемический плейотропный эффект. Их прием ингибиторов способствует снижению массы тела на 2–3 кг, вероятно, из-за осмотического диуреза и связанной с этим потерей калорий в результате блокады рецептора НГЛТ-2. Возможно, отчасти из-за натрийуретического воздействия ингибиторов НГЛТ-2 и, как следствие, внутрисосудистого сокращения объема и воздействия на интрареналовую гемодинамику препараты этой группы снижают систолическое и диастолическое артериальное давление (АД) в среднем на 5 и 2 мм рт.ст. соответственно и могут привести к сокращению альбуминурии на 30–50% у пациентов с нарушенной функцией почек. Доклинические и клинические исследования показали, что ингибиторы НГЛТ-2 способны оказывать благотворное гемодинамическое действие на почки за счет снижения гиперфильтрации и интрагломерулярного давления в результате нарушения тубулогломерулярной обратной связи. Последние данные свидетельствуют о том, что препараты этого класса также имеют противовоспалительные и антиоксидантные свойства и уменьшают окислительный стресс [16].
В 2008 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) обязало изучать влияние всех новых сахароснижающих препаратов на кардиоваскулярную систему [17]. За эти 12 лет было завершено множество исследований сердечно-сосудистых исходов эффективности и безопасности глюкозоснижающих препаратов. Среди новейших средств, доступных для лечения СД 2 типа, ингибиторы НГЛТ-2 привлекли большое внимание из-за наблюдаемых преимуществ для сердечно-сосудистой системы и почек.
Результаты исследований EMPA-REG (7020 пациентов) и CANVAS (10 142 пациента) на пациентах с ассоциированными ССЗ продемонстрировали влияние ингибиторов НГЛТ-2 не только на уровень глюкозы, но и на сердечно-сосудистый прогноз [14, 18]. С учетом данных исследований на повестке медицинского сообщества впервые встал амбициозный вопрос: можно ли оказать влияние на сердечно-сосудистый прогноз пациентов с СД 2 типа уже на стадии наличия факторов кардиоваскулярных риска?
Ответ на этот вопрос дало масштабное международное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование DECLARE-TIMI 58, в ходе которого оценивалось влияние терапии ингибитором НГЛТ-2 дапаглифлозином на риск развития сердечно-сосудистых осложнений у больных СД 2 типа. В общей сложности в это исследование вошли 17 160 пациентов как с диагностированными ССЗ (n=6974), так и в отсутствие таковых, но со множественными факторами риска, такими как возраст, АГ, курение, дислипидемия (n=10 186). Длительность наблюдения составила 4,2 года. Согласно данным исследования DECLARE-TIMI 58, дапаглифлозин продемонстрировал эффективное влияние на сердечно-сосудистый прогноз у большой популяции пациентов. У лиц, получавших этот препарат, на 17% был ниже риск относительный смерти от кардиоваскулярных причин или госпитализации по причине хронической сердечной недостаточности (относительный риск (ОР) 0,83; 95% доверительный интервал (ДИ) 0,73–0,95; p=0,005) Важным результатом в DECLARE-TIMI 58 была кардиоренальная точка: в группе пациентов, получавших дапаглифлозин, частота неблагоприятных кардиоренальных исходов оказалась на 24% ниже по сравнению с плацебо (ОР 0,76; 95% ДИ 0,67–0,87) [14].
Рассмотрение результатов исследования по подгруппам пациентов позволяет убедиться в эффективности проводимого лечения. Так, в подгруппе пациентов с множественными факторами риска снижение риска госпитализаций по поводу сердечной недостаточности составило 36% (ОР 0,64; 96% ДИ 0,46–0,68) [14]. Таким образом, дапаглифлозин – единственный пероральный сахароснижающий препарат, доказавший снижение риска госпитализации по поводу хронической сердечной недостаточности (ХСН) у пациентов с двумя и более факторами риска [14, 18].
В подгруппе пациентов с ассоциированными ССЗ продемонстрированы также консистентные данные. У больных с ранее перенесенным инфарктом миокарда (n=3584) при приеме дапаглифлозина наблюдалось значимое уменьшение числа основных сердечно-сосудистых исходов (MACE) (ОР 0,84; 95% ДИ 0,72–0,99; p=0,039) [19]. В подгруппе больных ХСН со сниженной фракцией выброса (ХСНнФВ) было достигнуто достоверное снижение риска госпитализации по поводу сердечной недостаточности на 36% (ОР 0,64; ДИ 96% 0,43–0,95) [14].
Таким образом, сделан фундаментальный вывод: дапаглифлозин способен оказывать положительное влияние в отношении развития и прогрессирования ХСН у пациентов с СД 2 типа. Более раннее начало терапии дапаглифозином при наличии факторов риска позволяет предупредить или замедлить развитие декомпенсации сердечной недостаточности и прогрессирование диабетической нефропатии у пациентов с СД 2 типа.
Однако, помимо клинических исследований, важно оценивать действие препарата в реальной клинической практике. Таким исследованием стало CVD Real Nordic, включавшее широкую популяцию пациентов с СД 2 типа. В нем было проведено сравнение влияния ингибиторов НГЛТ-2 (n=22 830) на сердечно-сосудистые исходы с другими пероральными сахароснижающими препаратами (n=68 490). В группе пациентов, получавших ингибиторы НГЛТ-2, отмечалось снижение МАСЕ на 22% (ОР 0,78; 95% ДИ 0,69–0,87), риска госпитализации по поводу ХСН – на 30% (ОР 0,70; 95% ДИ; 0,61–0,81) и вероятности событий сердечно-сосудистой смерти – на 47% (ОР 0,53; 95% ДИ 0,40–0,71) [18]. Также были проанализированы результаты добавления к лечению ингибиторов НГЛТ-2 по сравнению с ингибиторами дипептидилпептидазы-4 (иДПП-4). В группе ингибиторов НГЛТ-2 по сравнению с иДПП-4 отмечалось снижение МАСЕ на 21% (ОР 0,79; 95% ДИ, 0,67–0,94), риска госпитализации по поводу сердечной недостаточности – на 38% (ОР 0,62; 95% ДИ 0,50–0,77) и смерти от любой причины – на 41% (ОР 0,59; 95% ДИ 0,49–0,72). Полученные данные соответствуют результатам других крупномасштабных исследований, оценивавших влияние иДПП-4 на сердечно-сосудистые исходы: этот класс сахароснижающих средств не продемонстрировал положительного воздействия на сердечно-сосудистый прогноз у пациентов с СД 2 типа [19].
В связи с этим отметим также, что производные сульфонилмочевины, наоборот, способны повышать риск развития сердечной недостаточности у пациентов с СД 2 типа по сравнению с метформином [20].
Еще одним примечательным событием стало исследование DAPA-HF – применение дапаглифлозина с целью предотвращения неблагоприятных клинических исходов при сердечной недостаточности. В этом многоцентровом рандомизированном двойном слепом исследовании в параллельных группах приняли участие 4744 больных сердечной недостаточностью со сниженной фракцией выброса (ФВ) левого желудочка (≤40%) как с диагностированным СД 2 типа, так и без него. Приблизительно 45% зарегистрированных пациентов имели диабет, 37% – преддиабет, у 18% был нормальный уровень глюкозы. Фоновая терапия ХСНнФВ проводилась ингибиторами АПФ и блокаторами рецепторов ангиотензина II [21].
Сенсационные результаты DAPA-HF показали, что дапаглифлозин снижает первичную комбинированную конечную точку (сердечно-сосудистая смертность, госпитализация по причине ХСН, экстренное обращение за помощью в связи с ухудшением течения ХСН) на 26% (ОР 0,74; 95% ДИ 0,65–0,85; p <0,0001), а также достоверно снижает каждый из ее компонентов в отдельности [22]. Это изменило взгляд на дапаглифлозин как на первый жизнеспасающий препарат для лечения больных ХСНнФВ. Так, по результатам исследования удалось достичь снижения сердечно-сосудистой смертности на 18% (ОР 0,82; 95% ДИ 0,69–0,98), событий ухудшения течения сердечной недостаточности – на 30% (ОР 0,70; 95% ДИ 0,59–0,83). Важно отметить, что препарат применялся без титрации дозировки и всего 1 раз/ сут, что особенно важно при подборе терапии пациентам с ХСНнФВ. Что поразительно: результаты применения дапаглифлозина у пациентов с СД не отличались от таковых у пациентов без СД; это позволяет рекомендовать данный препарат для лечения сердечной недостаточности даже больным без нарушений углеводного обмена.
С учетом накопленных на сегодня научных и клинических данных стало понятно, насколько важно у пациентов с СД 2 типа уже на этапе наличия факторов сердечно-сосудистого риска подобрать оптимальную терапию, которая способна не только улучшать гликемический профиль пациента, но и проявлять кардио- и нефропротективное воздействие.
Анализ данных благоприятного влияния дапаглифлозина крайне значим, так как позволяет определить и лучше понять, у какой группы пациентов с СД 2 типа прием этого препарата наиболее эффективен, а также дает ответ на вопрос о том, возможно ли применение дапаглифлозина при других заболеваниях, кроме СД 2 типа.
НЕ ТОЛЬКО КОНТРОЛЬ ГЛИКЕМИИ
Положительный эффект ингибиторов НГЛТ-2 в отношении исходов у пациентов как с кардиоваскулярными факторами риска, так и атеросклеротическими ССЗ отчасти может определяться их влиянием на массу тела, АД, функциональное состояние почек, липидный профиль и содержание мочевой кислоты (т.е. параметры, определяющие сердечно-сосудистый риск) [25]. Благоприятное воздействие дапаглифлозина на сердечно-сосудистую систему и почки обусловлено не только снижением концентрации глюкозы в крови. Один из важных механизмов его действия – способность влиять на осмотический диурез и увеличивать объем выделяемой мочи (приблизительно на 375 мл/сут). Это сопровождается небольшим и транзиторным повышением выведения натрия почками, что не приводит к изменению концентрации Na+ в сыворотке крови, но способствует увеличению его доставки к дистальным канальцам. Следствием этого становится улучшение тубулогломерулярной обратной связи, что влечет за собой вазоконстрикцию приносящих артериол, снижение внутриклубочкового давления, расширение выносящих артериол, уменьшение секреции ренина [26]. То есть применение дапаглифлозина связано с улучшением функции почек. Ряд авторов к нефропротективным свойствам этого препарата относит также его способность к повышению гематокрита, что, в свою очередь, может способствовать лучшей доставке кислорода в ткани и нивелированию проявлений гипоксии и ишемического повреждения почек [27].
Применение дапаглифлозина приводит и к умеренному снижению АД [28]. Гемодинамические эффекты дапаглифлозина были отнесены к ключевым факторам, вносившим свой вклад в благоприятные кардиоренальные исходы. Снижение АД приводило к уменьшению пост- и преднагрузки на сердце, улучшению коронарного кровотока, сократительной способности миокарда, тем самым способствуя улучшению сердечной деятельности и снижению риска сердечной недостаточности [28, 29].
Помимо осмотического диуреза и связанного с ним гемодинамического действия, возникающего при ингибировании НГЛТ-2, потенциальными механизмами, обеспечивающими благоприятное воздействие дапаглифлозина на сердечно-сосудистую систему и почки, могут быть вторичные эффекты в отношении метаболизма миокарда, ионных каналов, фиброза, адипокинов и мочевой кислоты.
Например, при сердечной недостаточности ингибиторы НГЛТ-2 могут способствовать переходу миокарда на использование субстратов с более высокой энергетической эффективностью [30]. На фоне СД 2 типа снижается уровень окисления глюкозы, а окисление жирных кислот нарастает; это уменьшает эффективность работы сердца, поскольку второй путь энергетически менее продуктивен [31]. Критическую роль в патофизиологии сердечной недостаточности играют необратимые изменения характера субстратов энергетического метаболизма в миокарде и особенностей выработки энергии в сердце [30]. Ингибиторы НГЛТ-2 могут сдвигать кардиоренальный метаболизм от окисления жирных кислот и глюкозы в сторону использования кетоновых тел [26, 32, 33]. Связанное с этим улучшение эффективности работы сердца и ее сократительной функции – одна из причин того, что дапаглифлозин может снижать риск развития ХСН [34].
Помимо обусловленных ингибиторами НГЛТ-2 эффектов в отношении гемодинамических параметров, дополнительную пользу в отношении исходов сердечной недостаточности могут приносить изменения выработки аденозинтрифосфата (АТФ)/энергии в сердце [31]. В доклинических моделях терапия ингибитором НГЛТ-2 увеличивала общую выработку АТФ в сердце на ≈30% [31].
Наряду с прочим у пациентов с СД 2 типа и сердечной недостаточностью повышена активность натрий-водородной обменной системы (NHE), что увеличивает внутриклеточные концентрации кальция и является одним из механизмов повреждения кардиомиоцитов и ускоренного развития кардиомиопатии [34, 35]. Повышение внутриклеточных концентраций Ca2+ сопряжено с уменьшением его содержания в митохондриях кардиомиоцитов и нарушением в этих клетках энергетических функций и окислительно-восстановительных реакций. Ингибирование форм NHE, специфичных для тканей сердца, под воздействием ингибиторов НГЛТ-2 может дополнительно улучшать энергетический метаболизм миокарда за счет повышения концентраций кальция в митохондриях [34, 35].
ЗАКЛЮЧЕНИЕ
Кардиоренометаболический синдром – сводное междисциплинарное понятие, включающее такие заболевания, как АГ, ишемическая болезнь сердца, ХСН, дислипидемия, ожирение, СД 2 типа, ХБП. Многогранность патологических изменений диктует нам необходимость использования многофакторного подхода к лечению. Анализ положительных результатов исследований ингибиторов НГЛТ-2 показывает, что их преимущества связаны с эффектами, выходящими за пределы гликемического контроля, т.е. их можно рассматривать в большей степени как «кардиометаболические», нежели антидиабетические лекарства. В этом плане применение ингибиторов НГЛТ-2 видится одним из рычагов, сдвигающих парадигму лечения СД 2 типа: от стратегии достижения целевой гликемии к стратегии, направленной на комплексное снижение риска ССЗ.
Подводя итог вышесказанному, очевидно, что дапаглифлозин способен оказывать дополнительные благоприятные эффекты в отношении сердца и почек благодаря двунаправленному воздействию и на ХБП, и на сердечную недостаточность.



