Больным с фибрилляцией предсердий (ФП) показана длительная терапия антикоагулянтами, применение которой значительно улучшает прогноз, в частности, на фоне лечения антагонистом витамина К (АВК) варфарином частота инсультов снижается на 64% [1]. Безусловно, антикоагулянтная терапия повышает риск кровотечений, особенно у пациентов пожилого возраста, с наличием хронической болезни почек, сахарного диабета. Прямые пероральные антикоагулянты (ППАК), не относящиеся к антагонистам витамина К, а именно прямой ингибитор тромбина (блокатор IIa фактора свертывания крови) дабигатрана этексилат или ингибиторы Xa фактора свертывания крови апиксабан, ривароксабан и эдоксабан, имеют преимущество по сравнению с варфарином. В частности, на фоне их применения меньше частота внутричерепных кровотечений [2, 3].
Показано, что частота больших кровотечений при использовании дабигатрана в дозе 110 мг 2 раза/сут и апиксабана меньше, чем на фоне лечения варфарином, а при терапии ривароксабаном и максимальной дозой дабигатрана частота таковых сопоставима с риском большого кровотечения при лечении АВК [4].
Риск геморрагического инсульта при терапии ППАК ниже, чем на фоне лечения варфарином, при этом прием ППАК не требует титрования дозы и не нуждается в лабораторном контроле эффективности [2]. Установлено, что каждый ППАК обладает определенными преимуществами перед варфарином в условиях конкретного клинического испытания. После успешного завершения рандомизированных клинических исследований III фазы RE-LY, ARISTOTLE, ROCKET AF и ENGAGE AF-TIMI 48 дабигатрана этексилат, апиксабан, ривароксабан и эдоксабан были одобрены к клиническому применению у пациентов с неклапанной ФП. При высоком риске инсульта и системных эмболий (≥2 баллов по шкале CHA2DS2VASc у мужчин и ≥3 баллов у женщин) терапия антикоагулянтами (ППАК или АВК), несомненно, показана больным с неклапанной ФП (класс IA) [2, 3].
В рекомендациях по ведению пациентов с ФП Европейского общества кардиологов (2016) и Практических рекомендациях по использованию ППАК Европейской ассоциации по изучению аритмий сердца (2018) уточняется, что при возможности следует назначать препараты из группы ППАК: дабигатран, апиксабан, ривароксабан. Именно они, а не варфарин должны рассматриваться в первую очередь (класс I) [5].
Появление ППАК повысило приверженность больных к приему антикоагулянтов. По данным исследования «Профиль», доля пациентов с ФП и высоким риском тромбоэмболических осложнений по шкале CHA2DS2-VASc, находящихся на терапии оральными антикоагулянтами, возросла с 32,3% в 2012 г. до 63,8% в 2014 г. При этом прирост был достигнут за счет ППАК, так как процент больных, получающих варфарин, не изменился [6].
Безусловно, при выборе антикоагулянта как перед врачом, так и пациентом часто встает вопрос о наиболее эффективном и безопасном препарате. Следует признать, что прямых исследований по оценке эффективности и безопасности непосредственно между препаратами в группе ППАК не проводилось. Тем не менее можно принять во внимание некоторые ретроспективные исследования и метаанализы, косвенно позволяющие оценить эффективность и безопасность применения ППАК. Так, в ретроспективном исследовании D.J. Graham et al. (2016), проведенном у пациентов старше 65 лет, которые получали ППАК по поводу неклапанной ФП [7], анализу подверглись результаты применения дабигатрана по 150 мг 2 раза/сут у 55 240 пациентов и ривароксабана по 20 мг 1 раз/сут у 66 651 больного. За время наблюдения (>15 000 человеко-лет) было зарегистрировано 2537 «первичных событий», в том числе 306 тромбоэмболических инсультов, 176 внутричерепных кровоизлияний, 1209 эктракраниальных больших кровотечений (из них 108 были связаны с желудочно-кишечным трактом), а также 846 летальных исходов. Эффективность обоих препаратов в отношении уменьшения риска тромбоэмболических инсультов была сопоставима, однако прием ривароксабана был связан с повышением риска возникновения внутричерепных кровоизлияний (HR 1,65; 95% CI 1,20–2,26; p=0,002), экстракраниальных больших кровотечений (HR 1,48; 95% CI 1,32–1,67; p <0,001), больших желудочно-кишечных кровотечений (HR 1,40; 95% CI 1,23–1,59; p <0,001) без влияния на летальность в общей популяции.
Определенный интерес представляет метаанализ, проведенный Y. Bai et al. (2017), в котором были оценены результаты применения ППАК у 232 475 пациентов [8]. Частота возникновения больших кровотечений, желудочно-кишечных кровотечений, всех кровотечений без влияния на вероятность возникновения внутричерепных кровоизлияний оказалась выше на фоне использования ривароксабана по сравнению с аналогичными показателями в случае приема дабигатрана этексилата.
При все более частом использовании ППАК возникают практические вопросы, связанные с лабораторным контролем, изменением схем антикоагулянтной терапии, передозировкой, периоперационным ведением больных [9].
Не менее важный вопрос – сроки возобновления приема антикоагулянтов, в том числе ППАК, после развития ишемического инсульта, геморрагических осложнений. Согласно новым рекомендациям Европейского общества ритма сердца (2018) по использованию ППАК у пациентов с ФП [10], возобновлять их прием после перенесенного ишемического инсульта можно через 3–14 дней (в зависимости от степени неврологического дефицита) после исключения геморрагической трансформации по данным компьютерной томографии.
Следует признать, что прогрессивно возрастающее количество пациентов, принимающих ППАК, приводит к увеличению числа геморрагических осложнений, с которыми приходится сталкиваться клиницистам. В связи с этим хотелось бы поделиться опытом ведения пациента с ФП, у которого на фоне приема ППАК развилось внутримозговое кровоизлияние.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациент Д., 64 года (пенсионер), поступил в экстренном порядке в Городскую клиническую больницу им. М.Е. Жадкевича (Москва) с подозрением на ишемический инсульт от 23.01.2019.
В день поступления на фоне повышения артериального давления (АД) до 150/90 мм рт.ст. у него возникли жалобы на слабость в правых конечностях, нарушение речи, чувство онемение лица справа. Бригадой СМП больной был госпитализирован в стационар в отделение нейрореанимации.
Из анамнеза выяснилось, что пациент длительно страдает гипертонической болезнью 3 стадии, артериальной гипертензией 3 степени (с максимальным повышением АД до 200/120 мм рт.ст., адаптирован к АД 130/80 мм рт.ст.), имеет риск сердечно-сосудистых осложнений 4, пароксизмальную форму фибрилляции – трепетания предсердий (CHA2DS2VASc – 3 балла, HAS-BLED – 3 балла), варикозную болезнь нижних конечностей, ожирение 3 стадии (ИМТ=40,60 кг/м2).
В июне 2016 г. пациенту была проведена радиочастотная аблация каватрикуспидального истмуса по поводу трепетания – фибрилляции предсердий. Пароксизмы трепетания – фибрилляции предсердий не рецидивировали после радиочастотной аблации, но, учитывая высокий риск тромбоэмболических осложнений при возможном возникновении такого пароксизма, пациенту был рекомендован прием ривароксабана по 20 мг/сут.
Помимо ривароксабана, пациент постоянно принимал розувастатин по 20 мг/сут и лозартан по 50 мг 2 раз/сут.

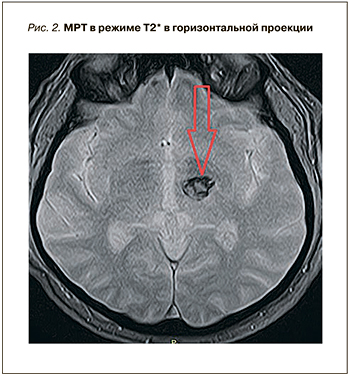 При поступлении пациенту была выполнена магнитно-резонансная томография (МРТ) головного мозга (рис. 1 и 2), на которой выявлена картина острейшего внутримозгового кровоизлияния в область базальных ядер слева (таламус) размерами до 1,8×1,9×1,8 см (объемом около 3,0 см3), без прорыва в желудочковую систему, с незначительным масс-эффектом. Отмечались очаговые изменения белого вещества головного мозга сосудистого генеза до 0,5 см в диаметре. Результаты по шкале Рэнкин составили 4 балла, по NIHSS – 5 баллов. Учитывая ясное сознание, отсутствие грубого неврологического дефицита, дислокационного синдрома у коморбидного пациента, показаний для экстренного нейрохирургического вмешательства не было. Проводилось консервативное лечение: противоотечная, гипотензивная и гемостатическая терапия. Прием ривароксабана был отменен.
При поступлении пациенту была выполнена магнитно-резонансная томография (МРТ) головного мозга (рис. 1 и 2), на которой выявлена картина острейшего внутримозгового кровоизлияния в область базальных ядер слева (таламус) размерами до 1,8×1,9×1,8 см (объемом около 3,0 см3), без прорыва в желудочковую систему, с незначительным масс-эффектом. Отмечались очаговые изменения белого вещества головного мозга сосудистого генеза до 0,5 см в диаметре. Результаты по шкале Рэнкин составили 4 балла, по NIHSS – 5 баллов. Учитывая ясное сознание, отсутствие грубого неврологического дефицита, дислокационного синдрома у коморбидного пациента, показаний для экстренного нейрохирургического вмешательства не было. Проводилось консервативное лечение: противоотечная, гипотензивная и гемостатическая терапия. Прием ривароксабана был отменен.
При поступлении в отделение нейрореанимации пациенту был выполнен весь спектр диагностических мероприятий, входящий в список рекомендаций при этой патологии. Уровень МНО составил 1,39 ед., АЧТВ – 32,5 с, что соответствовало референсным значениям.
На фоне проводимой терапии отмечалась положительная динамика. Повторная МРТ от 28.01.2019 выявила картину подострого внутримозгового кровоизлияния в область базальных ядер слева размерами 1,2×1,4×1,2 см (объемом около 1,2 см3).
С учетом постоянного синусового ритма на протяжении суток (по результатам холтеровского мониторирования ЭКГ) и перенесенного геморрагического инсульта, а также принимая во внимания риски развития тромбоэмболических осложнений (избыточная масса тела, состояние после радиочастотной аблации по поводу пароксизмальной формы фибрилляции – трепетания предсердий, CHA2DS2VASc – 3 балла, HAS-BLED – 3 балла), было принято решение воздержаться от возобновления приема антикоагулянтов.
ОБСУЖДЕНИЕ
В представленном клиническом наблюдении мы столкнулись с геморрагическим осложнением у пациента с пароксизмальной формой ФП, получавшем ривароксабан в дозе 20 мг/сут. В описываемой клинической ситуации геморрагический инсульт развился на фоне относительно стабильных цифр АД и нормальных показателей коагулограммы. Исходный риск ишемического инсульта и системного тромбоэмболизма по шкале CHA2DS2VASc составил 3 балла, что требует назначения антикоагулянтов, в то время как риск возникновения кровотечений по шкале НАS-BLED также был высок (3 балла). Тактика ведения таких больных активно обсуждается в литературе, однако решение о возобновлении приема антикоагулянтов и их дозах принимается индивидуально.
При возникновении геморрагических осложнений на фоне приема ППАК всегда возникает вопрос о нейтрализации действия антикоагулянта в режиме реального времени. В настоящий момент такая возможность имеется в отношении дабигатрана этексилата (ДТ). В 2018 г. в России компанией «Берингер Ингельхайм» был зарегистрирован идаруцизумаб (Праксбайнд) – специфический антагонист дабигатрана, который представляет собой фрагмент человеческого моноклонального антитела (Fab). Он связывается с дабигатраном с высокой аффинностью, которая примерно в 300 раз превосходит связывающую способность самого дабигатрана к тромбину. Комплекс «идаруцизумаб–дабигатран» характеризуется высокой скоростью образования и крайне низкой скоростью распада, вследствие чего является очень стабильным. Идаруцизумаб прочно и специфично связывается с дабигатраном и его метаболитами и нейтрализует их антикоагулянтный эффект.
Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) зарегистрировало препарат андексанет альфа (andexanet alfa), который может применяться в качестве антидота ривароксабана и апиксабана. До этого одобрения специфического антидота ингибиторов фактора свертываемости Ха не существовало. Ожидается, что в США андексанет альфа появится в продаже в 2019 г. Сроки регистрации его в России пока не известны.
ЗАКЛЮЧЕНИЕ
Таким образом, назначение ППАК несет в себе риск развития геморрагических осложнений, полностью предупредить которые не представляется возможным. Прогрессивно увеличивающееся количество пациентов, получающих ППАК, ассоциируется с возрастанием случаев, когда антикоагулянты требуется отменить. Кроме того, в реальной клинической практике у старшей возрастной группы пациентов имеет место коморбидная патология, зачастую сопровождающаяся полипрагмазией. Возобновление, режим дозирования и выбор конкретного ППАК остается на усмотрение клинициста в конкретной клинической ситуации.



