ВВЕДЕНИЕ
Распространенность анемии среди населения составляет более 20%, и, несмотря на снижение этого показателя в последние десятилетия, абсолютное число случаев анемии продолжает возрастать [1]. Хроническая железодефицитная анемия (ЖДА) – наиболее часто встречающаяся форма анемии. Не являясь непосредственной причиной смерти, она приводит к гипоксии, утяжеляющей течение и ухудшающей исходы сердечно-сосудистых заболеваний (ССЗ) [2], которые и без того выступают ведущей причиной смерти во всем мире [3].
Данные о влиянии железодефицита на течение ССЗ появились более полувека назад. До сих пор окончательно не установлено, служит ли анемия независимым фактором риска неблагоприятного исхода или же маркером более тяжелой формы заболевания. Наиболее существенна ее роль при хронической сердечной недостаточности (ХСН) [4–6] и ишемической болезни сердца (ИБС) [7–9]. По данным российского многоцентрового регистра артериальной гипертензии, ИБС и ХСН [10], частота встречаемости анемического синдрома (гемоглобин ≤130 г/л у мужчин и ≤120 г/л у женщин) у больных со стабильной ИБС в 2020 г. составила 17,8%, а у пациентов с ХСН – 13,8%. Согласно регистру острого коронарного синдрома (ОКС) одного крупного кардиологического стационара, принимавшего участие в федеральном регистре ОКС [11], снижение уровня гемоглобина встречалось в 21% случаев. Зарубежные исследования демонстрируют сходные результаты [12–13].
При лечении ССЗ небольшое снижение гемоглобина зачастую остается незамеченным. Только при анемии средней степени (гемоглобин менее 90 г/л) начинают назначаться препараты железа, как правило, пероральные. В большинстве случаев это делается без подтверждения железодефицита и дополнительного обследования с целью установления причины уменьшения уровня гемоглобина. Контроль эффективности проводимой терапии пероральными препаратами железа проводится на амбулаторном этапе недостаточно, поэтому анемия сохраняется у пациента на протяжении длительного времени. Таким образом, несмотря на адекватное выполнение мероприятий кардиологической медицинской помощи, в том числе высокотехнологичной, нескорректированная анемия препятствует улучшению исходов. Адекватное лечение могло бы улучшить клинические результаты лечения больных ССЗ с ЖДА.
В 2013 г. Американским колледжем терапевтов (American College of Physicians) были опубликованы рекомендации по лечению анемии у пациентов с ССЗ [14]. Основные их положения гласили: 1) переливание крови у госпитализированных больных ИБС должно применяться ограниченно, как правило, при снижении гемоглобина менее 70–80 г/л; 2) стимуляторы эритропоэза (препараты эритропоэтина) не должны использоваться у больных ИБС и ХСН при анемии легкой и средней степени. Конкретные рекомендации по приему пероральных препаратов железа у кардиологических пациентов с анемией и железодефицитом в этих рекомендациях отсутствовали в связи с недостатком доказательных данных.
В современных отечественных и зарубежных клинических рекомендациях по диагностике и лечению основных ССЗ отдельное внимание группе пациентов с анемией уделено только в рекомендациях по ХСН [15–17]. При этом акцент в них сделан на применении внутривенных форм железа у пациентов со сниженной фракцией выброса левого желудочка и железодефицитом. Однако внутривенные препараты железа не получили пока широкого распространения в повседневной клинической практике из-за высокой стоимости и невозможности их самостоятельного применения пациентами в амбулаторных условиях. В рекомендациях Американского колледжа кардиологии (АСС)/Американской ассоциации сердца (АНА) по ХСН от 2017 г. указано, что данных относительно приема пероральных препаратов железа у больных с ХСН недостаточно.
Таким образом, роль пероральных препаратов железа в лечении анемии при ССЗ должным образом не изучена.
Цель предлагаемого обзора – оценить эффективность и безопасность пероральных препаратов железа у пациентов кардиологического профиля с анемическим синдромом и обозначить пути оптимизации их назначения в реальной клинической практике. Нами были проанализированы релевантные исследования, содержащиеся в базах еLibrary, PUBMED, Google Scholar и clinicaltrials. gov за 2015–2020 гг. Поиск проводился по ключевым словам «железодефицитная анемия», «пероральные препараты железа», iron, iron deficiency anemia, iron replacement therapy, oral iron, их комбинациям, а также по спискам литературы найденных публикаций. Кроме того, проанализированы положения клинических рекомендаций Минздрава России по ЖДА от 2021 г. [18], касающиеся именно применения пероральных препаратов железа.
ПРИМЕНЕНИЕ ПЕРОРАЛЬНЫХ ПРЕПАРАТОВ ЖЕЛЕЗА ПРИ ЖЕЛЕЗОДЕФИЦИТЕ У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ: ДАННЫЕ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
На настоящий момент практически единственным современным исследованием приема пероральных препаратов железа у пациентов кардиологического профиля с железодефицитом стало исследование IRONOUT [19]. Именно оно упоминается в клинических рекомендациях по ХСН. Это двойное слепое рандомизированное, плацебо-контролируемое исследование было посвящено влиянию высокодозового перорального полисахарида железа, принимаемого в течение 16 нед, на толерантность к физической нагрузке у пациентов с ХСН со сниженной фракцией выброса левого желудочка (<40%) и железодефицитом (ферритин 15–100 или 101–299 нг/мл и насыщение трансферрина железом <20%). Всего в него вошло 225 пациентов. Согласно результатам, отличий по переносимости физических нагрузок и частоте побочных эффектов между группой перорального препарата железа и плацебо выявлено не было.
В более раннем исследовании, которое упоминается в рекомендациях АСС/АНА по ведению пациентов с врожденными пороками сердца от 2018 г. [20], изучалось влияние высокодозовой терапии железа фумаратом в течение 3 мес на переносимость физических нагрузок у пациентов с цианотичными пороками сердца и железодефицитом (ферритин <30 или 30–49 нг/мл и насыщение трансферрина железом <15%) [21]. Это проспективное одноцентровое открытое нерандомизированное исследование включало 25 участников. Результаты показали значительное улучшение переносимости физических нагрузок и повышение качества жизни при отсутствии нежелательных явлений и хорошей переносимости препарата железа.
Еще одно проспективное одноцентровое открытое рандомизированное контролируемое исследование было выполнено у 50 пациентов с планируемой кардиохирургической операцией и железодефицитом для сравнения эффективности внутривенных (железа карбоксимальтозат) и пероральных (железа сульфат по 200 мг 2 раза/сут) препаратов железа [22]. В нем не было показано преимуществ парентеральных форм железа над пероральными в отношении потребности в гемотрансфузии и исходах оперативного вмешательства.
Представляет интерес и недавно проведенное рандомизированное, контролируемое открытое исследование Kaundal R. et al., в котором было показано, что прием пероральных препаратов железа в дозе 60 мг (в пересчете на элементарное железо) 2 раза/сут сопоставим по эффективности и частоте побочных эффектов с однократным приемом 120 мг железа через день [23].
Перспективы применения пероральных препаратов железа, в том числе у пациентов кардиологического профиля, продолжают изучаться в ряде клинических исследований, набор в которые продолжается с 2019 г. (табл.).

ПОЛОЖЕНИЯ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ПО ЛЕЧЕНИЮ ПЕРОРАЛЬНЫМИ ПРЕПАРАТАМИ ЖЕЛЕЗА
В 2021 г. Минздравом России были утверждены Федеральные клинические рекомендации по ЖДА [18], где предложен алгоритм действий врача при выявлении этого заболевания. При подтвержденном железодефиците, характерными признаками которого, согласно рекомендациям, является снижение уровня сывороточного железа <10,7 мкмоль/л, ферритина <11 нг/мл и повышение общей железосвязывающей способности сыворотки (ОЖСС) крови >90 мкмоль/л, всем пациентам назначаются пероральные препараты железа. Целью такой терапии служит нормализация уровня гемоглобина (у женщин 120–140 г/л, у мужчин 130–160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки >40–60 мкг/л).
В соответствии с рекомендацией ВОЗ оптимальная доза железа для лечения ЖДА составляет 120 мг/сут, для профилактики железодефицита – 60 мг/сут. Длительность лечения определяется глубиной исходного железодефицита и может варьировать от 1 до 3 мес. Лечение целесообразно сочетать с назначением поливитаминов для полноценного обеспечения пластических процессов.
Снижение уровня сывороточного железа без изменения уровней сывороточного ферритина и ОЖСС – признак анемии хронических заболеваний, к которым, безусловно, относятся и ССЗ. Наряду с этим пациенты с ССЗ часто имеют сопутствующую патологию. В настоящее время утверждены Федеральные клинические рекомендации по анемии при хронической болезни почек (ХБП) [24] и анемии при злокачественных новообразованиях [25]. При ХБП в додиализной стадии и при проведении перитонеального диализа назначаются пероральные препараты железа. Также они показаны при злокачественных новообразованиях с доказанным абсолютным дефицитом железа (снижение ферритина <10 нг/мл). При функциональном дефиците железа (уровень ферритина >10 нг/мл) пероральные препараты железа применяют в дополнение к эритропоэзстимулирующим препаратам (эритропоэтину).
В случае ЖДА и установленной причины железодефицита параллельно с использованием пероральных препаратов железа проводятся мероприятия по устранению этой причины. Если она не установлена, то следует продолжать обследование пациента на фоне лечения.
Пероральные препараты железа, рекомендованные к применению у пациентов с ЖДА, в виде международных непатентованных наименований (МНН) приведены в федеральных клинических рекомендациях. При этом обращает на себя внимание тот факт, что в большинстве приведенных лекарственных форм содержание элементарного железа значительно ниже рекомендованных терапевтических доз; это необходимо учитывать при назначении конкретного лекарственного препарата. При этом следует ориентироваться не на дозировку соли железа, являющейся действующим веществом (она, как правило, высока), а на содержание чистого железа.
В отечественных клинических рекомендациях указано, что дозы железосодержащих препаратов и длительность лечения рассчитывают индивидуально с учетом возраста, массы тела пациента и терапевтического плана. В то же время рекомендации не содержат конкретных принципов индивидуального подбора дозы и вариантов терапевтического плана, однако они есть в ранее разработанном, но не введенном в действие ГОСТе Р52600.4-2008 «Протокол ведения больных. Железодефицитная анемия» [26]. В этом же документе изложены общие принципы лечения ЖДА, которые необходимо помнить практическому врачу:
1) невозможно излечения ЖДА одной диетой;
2) применение лекарственных средств, строго соответствующих определенному патогенетическому варианту анемии, т.е. использование препаратов железа;
3) использование преимущественно пероральных препаратов;
4) лечение адекватно высокими суточными дозами одного препарата с хорошей переносимостью;
5) оценка эффекта лечения по клинико-лабораторным признакам, в том числе по ретикулоцитарному кризу;
6) использование препаратов с оптимальным соотношением «затраты/эффективность», позволяющим минимизировать затраты на лечение;
7) устранение причин (причинных заболеваний) ЖДА.
Рациональная терапевтическая тактика подразумевает начало лечения с момента выявления ЖДА до достижения полной клинико-гематологической ремиссии; при необходимости проводится поддерживающая (профилактическая) терапия.
Основой заместительной терапии дефицита железа при лечении ЖДА служит применение препаратов железа. Их оптимальная суточная доза при лечении ЖДА должна соответствовать необходимой суточной дозе и составляет для взрослых:
- 200 мг/сут в составе препаратов солей железа (двухвалентного железа);
- 200–300 мг железа в препаратах полимальтозатного комплекса гидроксида железа (трехвалентного железа).
Применение меньших доз препаратов не дает адекватного клинического эффекта.
При латентном дефиците железа или для насыщения депо после окончания курса терапии применяют половинные относительно лечебных дозы препаратов.
Обязательным компонентом рационального применения железосодержащих препаратов является контроль эффективности терапии. В первые дни лечения проводится оценка субъективных ощущений, на 5–8-й день обязательно определение ретикулоцитарного криза (2–10-кратное увеличение числа ретикулоцитов по сравнению с исходным значением). На 3-й неделе оценивают прирост гемоглобина и числа эритроцитов. Отсутствие ретикулоцитарного криза свидетельствует либо об ошибочном назначении препарата, либо о назначении неадекватно малой дозы. Нормализация уровня гемоглобина, исчезновение гипохромии происходит обычно к концу 1-го месяца лечения (при адекватных дозах препаратов). Однако для насыщения депо рекомендуется применение половинной дозы железосодержащих препаратов на протяжении еще 4–8 нед. Насыщение депо определяется с помощью комплексного биохимического исследования. При отсутствии этих методов лечение проводится эмпирически.
Среди побочных эффектов на фоне перорального применения препаратов железа наиболее часто возникают диспепсические расстройства (анорексия, металлический вкус во рту, чувство переполнения желудка, давления в области эпигастрия, тошнота, рвота), запоры, иногда диарея. Развитие запоров связано с образованием в кишечнике сернистого железа, выступающего активным ингибитором функции толстого кишечника. У некоторых больных при применении препаратов солей железа происходит коричневатое окрашивание эмали зубов. Часто появляющееся темное окрашивание стула не имеет клинического значения.
Добавим, что двухвалентное железо очень часто входит в состав комплексных витаминно-минеральных препаратов. Однако доза железа в них незначительна, поэтому они не могут быть использованы для лечения железодефицитных состояний.
ТЕРАПИЯ АНЕМИЧЕСКОГО СИНДРОМА В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Наиболее часто встречающиеся ошибки лечения ЖДА имеют следующие основные причины:
- препараты железа назначены в неадекватных (малых) дозах;
- лечение кратковременно, не достигнута адекватная приверженность больного к терапии;
- необоснованно назначены витаминно-минеральные комплексы, биологические активные добавки или лекарства с малым содержанием железа.
Мы провели оценку качества диагностики и лечения анемического синдрома в соответствии с данными крупного регионального кардиологического центра. Проанализировано 8 случайно отобранных историй болезни пациентов с ИБС, которым выполнена реваскуляризация миокарда по поводу нестабильной стенокардии или острого инфаркта миокарда в период с апреля по июль 2021 г.; уровень гемоглобина у этих пациентов был менее 130 г/л для мужчин и менее 120 г/л для женщин. Было установлено, что ни одному пациенту в стационаре не выполнен анализ крови на ферритин, хотя этот показатель служит «золотым стандартом» диагностики ЖДА, так как необходим для подтверждения абсолютного железодефицита. 7 из 8 пациентов не получили рекомендаций по обследованию и лечению в связи с анемией. Одному пациенту с уровнем гемоглобина 89 г/л был назначен железа сульфат в дозе 200 мг/ сут без указания длительности приема. При этом отсутствовали рекомендации по дополнительному обследованию и биохимическому мониторингу проводимой терапии. Таким образом, ни у одного из этих пациентов диагностика и лечение анемического синдрома не соответствовало в полной мере положениям Федеральных клинических рекомендаций по ЖДА.
ПУТИ ОПТИМИЗАЦИИ НАЗНАЧЕНИЯ ПЕРОРАЛЬНЫХ ПРЕПАРАТОВ ЖЕЛЕЗА ПАЦИЕНТАМ КАРДИОЛОГИЧЕСКОГО ПРОФИЛЯ
Преодолеть существующие проблемы призвано применение клинических рекомендаций. Они основаны на данных наиболее актуальных исследований по ведению пациентов с ЖДА. Тем не менее алгоритм, предложенный в Федеральных клинических рекомендациях, недостаточно детализирован, что не позволяет врачу использовать его в качестве справочного материала в повседневной работе. Так, он начинается с установленного диагноза ЖДА. Однако практическому врачу была бы более полезна последовательность действий с момента обнаружения изменений в общем анализе крови.
С учетом мнения терапевтов и кардиологов Саратовского государственного медицинского университета им. В.И. Разумовского, на основе Федеральных клинических рекомендаций предложен более детализированный алгоритм лечения пероральными препаратами железа (рис.). Он рассчитан на наиболее типичные клинические ситуации и удобен для использования в повседневной клинической практике, поскольку не требует дополнительного обращения к тексту клинических рекомендаций.
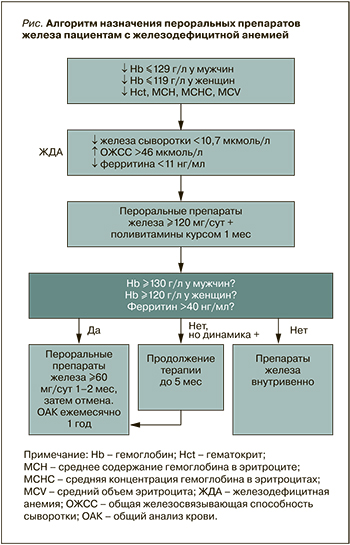
Аналогичный подробный алгоритм был разработан на основе национальных клинических рекомендаций по ЖДА в отделении неотложной кардиологии крупного медицинского центра в Канаде [27]. Он стал частью программы по повышению качества процедуры переливания крови при анемии. Целью этой программы было повышение доли обоснованных гемотрансфузий до 80% (при исходном уровне этого показателя 50%). Программа включала обучение персонала, информирование пациентов, закупку препаратов железа, ежемесячный анализ выполненных гемотрансфузий при анемии в отделении. Это позволило сократить частоту необоснованных переливаний крови до 9% и добиться более широкого применения препаратов железа.
Аналогичные программы могут быть реализованы и в отношении назначения пероральных препаратов железа. При этом целью становится повышение доли обоснованного назначения пероральных препаратов железа до 80%. Необходимо предварительно оценить исходный уровень данного показатель, и делать это целесообразно с помощью регистра. Представляется, что ведение регистров ССЗ будет способствовать выявлению анемии и ее устранению, особенно если регистр обладает автоматизированным аналитическим аппаратом, обеспечивающим поддержку принятия врачебных решений.
Алгоритм, разработанный специалистами Саратовского государственного медицинского университета на основании положений Федеральных клинических рекомендаций, безусловно, требует апробации в условиях реальной клинической практики. Так, определение трех лабораторных показателей для подтверждения железодефицита может представлять проблему из-за высокой стоимости анализа. Например, в рекомендациях Медицинской ассоциации Альберты (Alberta Medical Association, Канада) по ЖДА от 2018 г. [28] в качестве критерия используется только ферритин, причем диагностические уровни его выше, чем в отечественных клинических рекомендациях: <30 мкг/л (30 нг/мл) для мужчин и <13 мкг/л (13 нг/ мл) для женщин против 11 (10) нг/мл в федеральных клинических рекомендациях 2020–2021 гг. [18, 24, 25]. Это может иметь большое практическое значение, поскольку даже при анемии средней степени уровень ферритина не всегда достигает 11 нг/ мл, что тем не менее является железодефицитным состоянием. Так, у пациента с уровнем гемоглобина 89 г/л (случай из практики) уровень сывороточного ферритина составлял 16,5 нг/мл (при норме для мужчин 22–322 нг/ мл), при этом уровень сывороточного железа был 3,27 мкмоль/л (норма 12,5–32,2 нмоль/л), ОЖСС – 80,52 мкмоль/л (норма 45–72 мкмоль/л), а насыщение трансферрина железом – 4,1% (норма 20–50%). Уровни витамина В12 и фолиевой кислоты находились в пределах нормы (300 и 7,6 нг/мл соответственно). При выписке из кардиологического стационара (до получения результатов обмена железа) ему был назначен железа сульфат 200 мг/сут. Анализ был выполнен до начала приема препарата. Обоснованно ли в этом случае назначение пациенту препаратов железа? Согласно Федеральным клиническим рекомендациям по ЖДА, не вполне, но по критериям канадских рекомендаций – абсолютно обоснованно.
Еще один вопрос, который может возникнуть у практического врача при использовании алгоритма, основанного на Федеральных клинических рекомендациях по ЖДА: оправданно ли назначение препаратов железа пациентам (особенно женского пола) с небольшим снижением уровня гемоглобина и нормальными значениями показателей обмена железа. В Федеральных клинических рекомендациях по ЖДА указано, что «необходимо добиваться нормализации гемоглобина у всех пациентов». В связи этим приведем случай из практики.
У пациентки 57 лет, перенесшей реваскуляризацию миокарда, назначение железосодержащих препаратов в профилактических дозах в сочетании с поливитаминами позволило через 1 мес после выписки нормализовать уровень гемоглобина. Исходное его содержание составляло 115 г/л, уровень сывороточного железа – 13,37 нмоль/л (норма 10,7–32,2), ОЖСС – 61,67 мкмоль/л (норма 45–72 мкмоль/л), уровень ферритина – 163 нг/мл (норма для женщин 3,5–223,5 нг/мл), насыщение трансферрина железом – 22% (норма), уровень витамина В12 – 305 пг/мл (норма), фолиевой кислоты – 8,5 мг/мл (норма). Пациентке был назначен железа сульфат (Сорбифер Дурулес) в дозе 100 мг/ сут в сочетании с поливитаминным препаратом. Через 1 мес терапии уровень гемоглобина составил 123 г/л, гематокрит – 33,3% (понижен), средняя концентрация гемоглобина в эритроцитах (МСНС) – 373 г/л (повышена). Еще через 2 мес повторный анализ крови показал аналогичные результаты. Представляется, что полезным может быть назначение пероральных препаратов железа именно у пациентов с небольшим снижением гемоглобина (анемией легкой степени) и пограничными с железодефицитом изменениями биохимических параметров (ферритин, процент насыщения трансферрина железом).
Несомненно, важным аспектом при лечении ЖДА является выбор конкретного препарата для восполнения дефицита железа. Наиболее часто в отечественной клинической практике применяются сульфат железа (Fe2+) и железа гидроксид полимальтозат (Fe3+). Нами проанализированы инструкции по применению препаратов, содержащих эти формы железа: Феррум Лек (железа (III) гидроксид полимальтозат таблетки жевательные 100 мг, производство Lek, Словения) и Сорбифер Дурулес (железа (II) сульфат + аскорбиновая кислота, таблетки, покрытые пленочной оболочкой 100 + 60 мг, производство Egis, Венгрия).
Железа гидроксид полимальтозат, согласно инструкции, назначается с целью лечения ЖДА у детей старше 12 лет и взрослых по 1–3 таблетки 100 мг/сут в течение 3–5 мес до нормализации содержания гемоглобина. После этого лечение следует продолжить в течение нескольких недель в дозе 1 таблетка жевательная/сут с целью восполнения запасов железа.
Железа сульфат обычно рекомендуется в начальной дозе 2 таблетки 100 мг в день. При необходимости, например при развитии побочных реакций, дозу можно уменьшить (1 таблетка/сут). Пациентам с ЖДА при необходимости дозу можно повысить до 3–4 таблеток в день за два приема (утром и вечером). Максимальная доза – 4 таблетки/сут. Продолжительность приема определяется индивидуально, на основании лабораторных показателей, характеризующих состояние обмена железа. Лечение следует продолжать до достижения оптимальной концентрации гемоглобина и восстановления лабораторных показателей обмена железа в плазме крови. Для дальнейшего пополнения депо может потребоваться продолжение приема препарата еще в течение примерно 2 мес. Обычно длительность терапии при значительной потере железа составляет 3–6 мес.
Обе приведенные инструкции предполагают прием препарата в лечебных дозах в течение минимум 3 мес, максимум – 5–6 мес. Отличается длительность последующего приема в профилактических дозах для восполнения тканевых депо железа: у железа сульфата она вдвое больше, чем у железа гидроксида полимальтозата. Учитывая, что максимальная суточная доза железа сульфата составляет 400 мг (4 таблетки), максимальная длительность приема в лечебных дозах 6 мес, а в профилактических дозах – 2 мес, максимальная курсовая доза соответствующего препарата, а соответственно и элементарного железа, получается на 62% больше, чем в случае с железа гидроксида полимальтозатом. Это немаловажно, когда врач имеет дело с выраженным дефицитом железа, требующим длительного лечения пероральными препаратами железа в высоких дозах.
Отметим также, что указанная в инструкциях обоих препаратов длительность курса приема (3–6 мес) выше таковой, указанной в рекомендациях по ЖДА 2021 г. (1–3 мес). Таким образом, несмотря на соблюдение положений клинических рекомендаций, нормализации гемоглобина может не произойти из-за продолжительности лечения, не соответствующей инструкции по применению препарата. По данным Khananah F. et al. [27], в Канаде средняя длительность назначения препаратов перорального железа для оценки их эффективности составляет 3 мес.
В соответствии с отечественными рекомендациями по ЖДА отличия в эффективности пероральных препаратов двух- и трехвалентного железа отсутствуют. При этом фармакоэкономический анализ показал, что железа сульфат (Сорбифер Дурулес) является одним из самых экономически эффективных препаратов железа [29]. Вероятно, поэтому Сорбифер Дурулес является наиболее часто назначаемым железосодержащим препаратом (до 92,3%) в России [30]. Особое покрытие таблетки предотвращает растворение таблетки в желудке. Аскорбиновая кислота при этом улучшает всасывание железа в кишечнике. Прием препарата Сорбифер Дурулес по 100 мг 2 раза/сут обеспечивает на 30% больше всасывания железа по сравнению с другими препаратами этого класса [31]. Высокая биодоступность сульфата железа способствует более высокому темпу прироста гемоглобина по сравнению с другими пероральными железосодержащими препаратами, особенно при тяжелой форме анемии [32]. Следовательно, при назначении препарата Сорбифер Дурулес можно раньше ожидать повышения уровня гемоглобина.
Важное преимущество препарата – технология «Дурулес», обеспечивающая постепенное замедленное высвобождение активного компонента из матрицы таблеток, а также равномерное поступление лекарственного препарата в кровь в течение 6 ч [33]. Благодаря этому, Сорбифер Дурулес обладает хорошим профилем переносимости, минимизируя вероятность нежелательных явлений, что крайне важно для пациентов с хроническими заболеваниями [34]. Таким образом, железа сульфат (в том числе Сорбифер Дурулес) целесообразно использовать в качестве препарата первого выбора у пациентов с ЖДА, страдающих ССЗ.
ЗАКЛЮЧЕНИЕ
Пероральные препараты железа – наиболее доступные и оптимальные по соотношению затрат и эффективности средства для лечения ЖДА. Требуются качественно спланированные исследования их применения у пациентов кардиологического профиля для включения в клинические рекомендации по соответствующей нозологии.
В настоящее время назначение пероральных препаратов железа при анемии, осложняющей течение ССЗ, остается недостаточным. Применение алгоритма назначения пероральных препаратов железа позволяет врачу выбрать оптимальную тактику ведения пациента с пониженным гемоглобином. Необходима систематизация данных реальной клинической практики, которая позволит получить портрет больного кардиологического профиля с ЖДА и оценить с позиции отечественных и международных рекомендаций качество его обследования и лечения. На основании этой информации могут быть приняты обоснованные и действенные меры по совершенствованию назначения пероральных препаратов железа в реальной клинической практике.



