Сердечно-сосудистые заболевания (ССЗ) лидируют в структуре причин смертности и инвалидизации населения России [1]. Более половины пациентов с сердечно-сосудистой патологией умирают от ишемической болезни сердца (ИБС) [2]. По данным экспертов ВОЗ, к 2020 г. ИБС выйдет на ведущую позицию среди всех причин смертности и инвалидизации в мире [3].
Одним из важных факторов, усугубляющих течение ИБС у больных сахарным диабетом 2 типа (СД 2), может являться кардиоваскулярная автономная нейропатия (КАН), формирование которой при СД 2 в 5 раз увеличивает риск внезапной смерти [4]. Известно, что КАН является хроническим осложнением СД 2 и может приводить к серьезным нарушениям системной гемодинамики и ритма сердца. Однако информация о распространенности данного осложнения СД 2 остается до настоящего времени противоречивой. Согласно исследованиям ряда авторов, распространенность КАН может достигать 60% среди пациентов с длительным стажем сахарного диабета [5]. В то же время И.И. Дедов и М.В. Шестакова указывают на наличие КАН у 25% обследованных пациентов с сахарным диабетом [6]. При этом в клиническом диагнозе указания на КАН встречаются только в 3% случаев. Известно, что классификация КАН предполагает выделение субклинической и клинической стадий [4], при этом особенно важно уметь выявлять это грозное осложнение СД на доклинической стадии, когда возникшие изменения в автономной нервной системе еще могут быть обратимыми. Однако начальные клинические признаки нарушения автономной иннервации могут долгие годы оставаться вне внимания врачей-эндокринологов, тем более что известные классические тесты (Ewing D., 1975) для диагностики КАН, по мнению ряда авторов, далеко не всегда позволяют выявлять патологический процесс, особенно на доклинической стадии [5].
Целью настоящего исследования явилось изучение распространенности КАН у больных ИБС в сочетании с предиабетом и СД 2, уточнение критериев ранней диагностики доклинической стадии КАН у данной категории больных.
Материал и методы
Для реализации поставленной цели на первом этапе нами обследовано 156 пациентов и проанализировано 380 историй болезней больных ИБС в сочетании с предиабетом и СД 2, находившихся на лечении в кардиологическом отделении ГБУ РО «Ростовская областная клиническая больница». Из них 271 (50,5%) женщина и 265 (49,5%) мужчин, средний возраст обследованных пациентов составил 65,4±6,8 года. Больные были разделены на 3 группы в зависимости от состояния углеводного обмена. В группу 1 вошли 175 пациентов с ИБС и впервые выявленной нарушенной гликемией натощак или нарушенной толерантностью к углеводам (ИБС+ПД), средний возраст 63,5±3,1 года, в группу 2 – 234 пациента с ИБС и СД 2 (ИБС+СД), средний возраст 65,2±3,4 года, длительность СД 2 9,4±3,8 года. Группу 3 составили 132 больных ИБС без нарушений углеводного обмена, средний возраст 68,4±2,2 года. В контрольную группу включены 20 пациентов без признаков ИБС и нарушений углеводного обмена, средний возраст 63,6±3,4 года.
У всех больных анализировали антропометрические показатели и оценивали результаты биохимических исследований: глюкозу крови натощак и через 2 ч после еды, уровень HbA1с, показатели липидного спектра крови, С-пептид, иммунореактивный инсулин (ИРИ) с расчетом индекса инсулинорезистентности (ИР) HOMA (Homeostasis Model Assessment) по формуле:
ИР HOMA = глюкоза натощак × ИРИ (мкЕД/мл) / 22,5.
Значения ИР HOMA более 2,27 расценивали как наличие инсулинорезистентности. Инструментальные методы исследования включали суточное мониторирование артериального давления (СМАД) с расчетом индексов вариабельности, суточное мониторирование ЭКГ (ХМЭКГ) с определением циркадного индекса (ЦИ), временных характеристик вариабельности ритма сердца, коронароангиографию (КАГ). Для диагностики КАН использовались классические кардиоваскулярные тесты (ККТ) (Ewing D.,1975), включавшие изучение частоты сокращений сердца в покое, вариацию частоты сердечных сокращений, реакции частоты сердечных сокращений в ответ на ортостатическую пробу, пробу Вальсальвы, реакции систолического артериального давления в ответ на ортостатическую пробу, реакции диастолического артериального давления в ответ на изометрическую нагрузку. Пробы начинались после 20-минутного отдыха. Интервал между пробами составлял не менее 5 мин.
Критерии невключения в исследование: пациенты с перенесенным инфарктом миокарда или инсультом менее 3 мес назад, выраженной патологией печени и почек, онкологическими заболеваниями, ХСН III стадии и/или IV ФК, с тяжелыми гипогликемическими состояниями (потребовавшими помощи другого лица, с потерей сознания или без нее) за последние 3 мес.
Статистический анализ данных проводили с помощью программ Microsoft Office Excel 2010 и STATISTICA 10.0. Для оценки типа распределения данных использовали анализ Колмогорова–Смирнова, при значениях p >0,05 распределение считалось не отличающимся от нормального. Полученные данные представлены в виде M±SD (M – среднее арифметическое, SD – стандартноотклонение). В случае нормального распределения при сравнении двух независимых выборок использовали критерий Стьюдента, а при отличии от нормального – критерии Манна–Уитни и χ2 или тест Левена с определением F. Полученные различия считали статистически значимыми при р <0,05.
 Результаты
Результаты
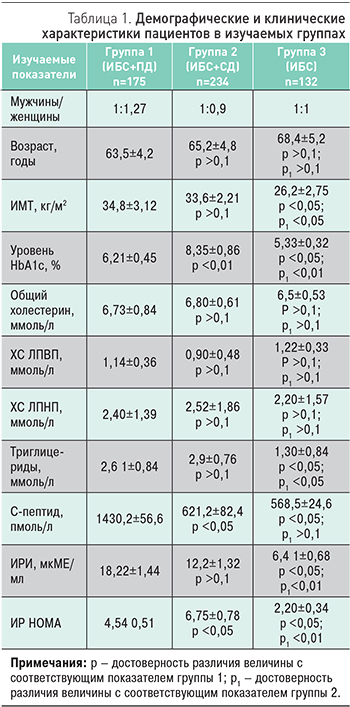
В табл. 1 представлена клиническая характеристика исследуемых больных. Количество мужчин и женщин, а также возраст пациентов в изучаемых группах существенно не различались. Пациенты групп ИБС+ПД и ИБС+СД имели избыточную массу тела или ожирение, по сравнению с группой ИБС.
Индекс инсулинорезистентности в группе СД+ИБС оказался достоверно выше по сравнению с группой ИБС+ПД и особенно с группой ИБС, что могло быть обусловлено недостаточной компенсацией углеводного обмена у пациентов с СД 2. Уровень HbA1c у большинства пациентов группы ИБС+СД не соответствовал целевым значениям и в среднем составил 8,35±0,86%, что существенно выше, чем в группах ИБС и ИБС+ПД (p <0,05).
Значения показателей липидного спектра крови во всех трех группах существенно не различались. Исключение – триглицериды, значения которых в группах ИБС+ПД и ИБС+СД составили соответственно 2,6±0,84 и 2,9±0,76 ммоль/л и были достоверно выше, чем в группе ИБС (1,3±0,84 ммоль/л, p <0,05).
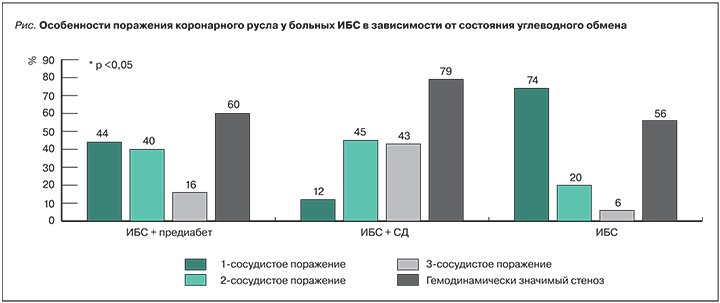
Результат анализа характера поражения коронарных артерий, по данным КАГ, с учетом состояния углеводного обмена представлен на рис.
У больных ИБС чаще встречалось однососудистое поражение коронарных артерий. Напротив, в группах с нарушениями углеводного обмена прогрессировала мультисегментарность поражения коронарного русла. Если в группе ИБС количество пациентов с двухсосудистым поражением составляло только 20%, то в группе ИБС+ПД их количество достигало 40% (p <0,05). В группе ИБС+СД наибольшее количество пациентов имели двух- (45%) и трехсосудистое (43%) поражение коронарных артерий, в то время как в группах ИБС+ПД и ИБС пациентов с трехсосудистым поражением было достоверно меньше (16 и 6% соответственно, p <0,05). В группе ИБС+СД оказалось существенно больше гемодинамически значимых стенозов.
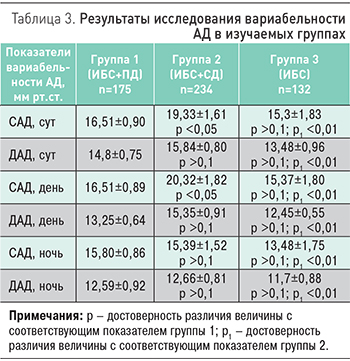
Особый интерес представляют результаты анализа вариабельности ритма сердца по данным ХМЭКГ и вариабельность АД по результатам СМАД в обсуждаемых группах.
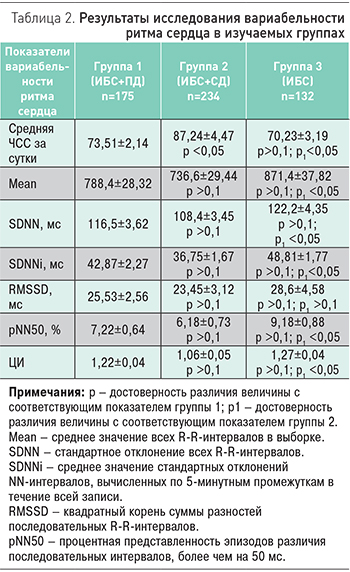 Выявлено существенное отличие параметров ХМЭКГ группы ИБС+СД по сравнению с больными ИБС (табл. 2). Так, у больных ИБС средняя ЧСС за сутки составляла 70,23±3,19 уд./мин, в то время как в группе ИБС+СД этот показатель оказался достоверно выше (87,24±4,47 уд./мин, p <0,01). Существенно выше в группе ИБС+СД был и ЦИ: 1,06±0,05 против 1,27±0,04 в группе ИБС (p <0,05). О нарушенной вариабельности ритма сердца в группе ИБС+СД свидетельствовали временные показатели SDNN, SDNNi и pNN50, значения которых оказались достоверно ниже, чем в группе ИБС.
Выявлено существенное отличие параметров ХМЭКГ группы ИБС+СД по сравнению с больными ИБС (табл. 2). Так, у больных ИБС средняя ЧСС за сутки составляла 70,23±3,19 уд./мин, в то время как в группе ИБС+СД этот показатель оказался достоверно выше (87,24±4,47 уд./мин, p <0,01). Существенно выше в группе ИБС+СД был и ЦИ: 1,06±0,05 против 1,27±0,04 в группе ИБС (p <0,05). О нарушенной вариабельности ритма сердца в группе ИБС+СД свидетельствовали временные показатели SDNN, SDNNi и pNN50, значения которых оказались достоверно ниже, чем в группе ИБС.
Отличалась в группе ИБС+СД и вариабельность АД (табл. 3). Это касалось главным образом показателей систолического АД (САД). Если показатель вариабельности САД в течение суток в группе ИБС составлял 15,3±1,83 мм рт.ст., то в группе ИБС+СД он был достоверно выше 19,33±1,61 мм рт.ст. (p<0,05). При этом повышенная вариабельность САД в обсуждаемой группе сохранялась как днем, так и ночью. Вариабельность диастолического АД (ДАД) в группе ИБС+СД отличалась в меньшей степени, разница с группой ИБС оказалась достоверной только в отношении ДАД днем (15,35±0,92 и 12,45±0,55 мм рт.ст., p <0,05).
Следует отметить отсутствие значимых отличий параметров вариабельности ритма сердца и АД в группах ИБС+ПД и ИБС.
Учитывая, что изменения показателей вариабельности ритма сердца и АД в группе ИБС+СД могут свидетельствовать о наличии КАН, на втором этапе исследования из этой группы были выделены 126 пациентов, у которых с целью выявления признаков КАН была проанализирована клиническая картина и выполнены ККТ. Оказалось, что у 72 (57%) больных данной подгруппы показатели вариабельности ритма сердца и АД, а также ЦИ не выходили за рамки значений этих показателей в контрольной группе, при этом сумма баллов ККТ была меньше 5. Следовательно, признаков КАН у них выявлено не было.
 У остальных 54 пациентов (43%) из числа выделенных в группе ИБС+СД выявлялись отклонения показателей вариабельности ритма сердца и АД от аналогичных показателей в контрольной группе. При этом у большинства из них (70%) выявлены отличия от контрольной группы только по показателям вариабельности ритма сердца, но не вариабельности АД, и отсутствовали клинические проявления КАН. У остальных 30%, наряду с изменениями вариабельности ритма сердца, имели место изменения показателей вариабельности АД, а у некоторых больных отмечены клинические проявления КАН (головокружение, сердцебиение и др.). Следует отметить, сумма баллов ККТ, соответствующая уровню КАН (>5 баллов), была только у 28 больных (22%). Более того, именно у этих больных отмечены изменения показателей вариабельности и ЧСС, и АД, а также имели место клинические признаки КАН.
У остальных 54 пациентов (43%) из числа выделенных в группе ИБС+СД выявлялись отклонения показателей вариабельности ритма сердца и АД от аналогичных показателей в контрольной группе. При этом у большинства из них (70%) выявлены отличия от контрольной группы только по показателям вариабельности ритма сердца, но не вариабельности АД, и отсутствовали клинические проявления КАН. У остальных 30%, наряду с изменениями вариабельности ритма сердца, имели место изменения показателей вариабельности АД, а у некоторых больных отмечены клинические проявления КАН (головокружение, сердцебиение и др.). Следует отметить, сумма баллов ККТ, соответствующая уровню КАН (>5 баллов), была только у 28 больных (22%). Более того, именно у этих больных отмечены изменения показателей вариабельности и ЧСС, и АД, а также имели место клинические признаки КАН.
Следовательно, выполнение ККТ не всегда позволяет выявить КАН, особенно на ранних стадиях. Можно предполагать, что исследование вариабельности ритма сердца по данным ХМЭКГ и АД по данным СМАД более объективно, по сравнению с ККТ, позволяет судить о наличии КАН. Согласно полученному в данном исследовании фактическому материалу, выполнение ККТ позволило выявить КАН в группе ИБС+СД только у 22% пациентов, в то время как на основании оценки показателей вариабельности ритма сердца и АД их доля составила 43%.
Проведенное исследование наглядно иллюстрирует, что для ранней диагностики КАН у больных ИБС+СД более точную информацию можно получить при одновременной оценке показателей вариабельности ритма сердца и вариабельности АД. При этом о наличии доклинической стадии КАН свидетельствуют преимущественно отклонения показателей вариабельности ритма сердца при отсутствии изменений в показателях вариабельности АД. Выраженные изменения показателей вариабельности ритма сердца по данным ХМЭКГ и одновременное изменение показателей вариабельности АД по результатам СМАД свидетельствуют о наличии клинической стадии КАН.
Заключение
Выявлена высокая распространенность (43%) КАН у больных ИБС в сочетании с сахарным диабетом 2 типа.
При наличии кардиоваскулярной автономной нейропатии у больных ИБС в сочетании с сахарным диабетом 2 типа превалирует мультифокальное поражение коронарного русла с развитием гемодинамически значимых стенозов (79% случаев).
Одновременная оценка показателей вариабельности ритма сердца и артериального давления позволяет в 70% случаев верифицировать кардиоваскулярную автономную нейропатию на доклинической стадии и оптимизировать дифференциацию клинической и доклинической стадий.



