В конце XX в. японскими учеными был разработан новый препарат – гастро- и энтеропротектор ребамипид. Фармакологические свойства ребамипида хорошо изучены: это повышение секреции желудочной слизи, индукция синтеза простагландинов E2 и I2, улучшение кровотока в слизистой оболочке желудочно-кишечного тракта (ЖКТ), уменьшение ее повышенной проницаемости, выведение свободных радикалов, подавление синтеза воспалительных цитокинов [1–4]. Помимо этого, препарат способствует уменьшению воспалительной реакции, связанной с действием фактора некроза опухоли (ФНО) альфа, стабилизации клеточной линии макрофагов, снижению активации ядерного фактора каппа B (nuclear factor kappa B – NF-kappa B), коррекции сигнального пути MARK, подавлению экспрессии генов, связанных с апоптозом и сохранением тесных контактных комплексов, что играет важную роль в защитном действии препарата, направленном на заживление слизистой оболочки ЖКТ [5, 28].
Проведено большое количество экспериментальных и клинических работ по изучению ребамипида. Так, в эксперименте на крысах было показано, что препарат положительно влиял на заживление язвенных дефектов различного генеза (вызванных аспирином, индометацином, стрессом, химическими агентами) и предотвращал их развитие. При этом он не ингибировал желудочную секрецию [6].
Результаты другого исследования продемонстрировали способность ребамипида подавлять целекоксиб-ассоциированный апоптоз клеток слизистой оболочки ЖКТ [2]. В исследовании Lai Y. et al. оценивали влияние ребамипида на восстановление повреждений слизистой оболочки кишечника, вызванных нестероидными противовоспалительными препаратами (НПВП), и изучали механизм, с помощью которого он может способствовать регенерации слизистой оболочки кишечника при повреждении аспирином. Чтобы вызвать острое повреждение тонкой кишки, в течение 5 дней мышам вводили аспирин (по 200 мг/кг/сут), затем на протяжении 5 дней животные получали ребамипид (по 320 мг/кг/сут). Структурные изменения тонкой кишки оценивались с помощью электронной микроскопии. Структуры плотных контактов между эпителиальными клетками тонкого кишечника были значительно повреждены у мышей после введения аспирина на 5-й и 10-й день. У мышей с аспирин-индуцированным повреждением тонкой кишки введение ребамипида способствовало улучшению структуры кишечного барьера, восстановлению структур плотных соединений и регенерации повреждения тонкого кишечного эпителия за счет усиления экспрессии циклооксигеназы 2 (COX-2) и накопления β-катенина. Исследователи сделали вывод, что введение ребамипида при аспирин-индуцированном повреждении позволяет улучшить барьерную структуру кишечника и способствует регенерации тонкой кишки за счет регулирования экспрессии COX-2 и накопления β -катенина [7].
Японские ученые изучали эффекты ребамипида при профилактике желудочно-кишечных кровотечений. В опытах на крысах исследователи стимулировали желудочную секрецию гистамином, после чего проводили перфузию аспирина. За 24 ч до перфузии аспирина применялся перорально клопидогрел. В ходе исследования оценивалось профилактическое действие различных противоязвенных препаратов, в том числе ребамипида в дозах 3‒30 мг/кг. Как показали результаты, способность ребамипида предупреждать кровотечения сопоставима с таковой антисекреторных препаратов и других протекторов (ирсогладина, тепренона). При этом ребамипид не влиял на желудочную секрецию [8].
В ряде исследований индуцированное приемом НПВП увеличение активных форм кислорода (АФК) приводило к повреждению митохондрий, вследствие чего нарушалась целостность слизистой оболочки кишечника. Назначение ребамипида существенно снижало концентрацию АФК и количество поврежденных клеток в слизистой оболочке тонкой кишки, что было обусловлено активацией митохондриальной марганцевой супероксиддисмутазы [9].
Сегодня в связи с широким применением НПВП, в том числе низких доз аспирина (НДА), препарат с высокими протективными свойствами актуален как никогда. Количество пациентов, особенно пожилых, постоянно принимающих аспирин и/или НПВП, неуклонно возрастает. Вместе с этим увеличивается частота желудочно-кишечных кровотечений, в частности, тяжелых. Активное использование НДА в целях профилактики сердечно-сосудистых и цереброваскулярных осложнений приводит к изъязвлениям ЖКТ и кровотечениям.
Изучение этой проблемы, равно как и профилактические меры, в большей мере касались верхних отделов ЖКТ. Применение видеокапсульной энтероскопии (ВКЭ) показало, что НПВП повреждают не только верхние отделы ЖКТ, но и тонкую кишку, что проявляется изъязвлениями, кровотечениями и анемией. Если при кровотечениях из внутренних отделов ЖКТ определенную роль играет желудочная секреция, то механизм повреждения слизистой оболочки кишечника, где кислая среда отсутствует, не до конца понятен [10–12]. Ребамипид (Ребагит) способствует улучшению кровоснабжения слизистой оболочки желудка, активации ее барьерной функции, усилению пролиферации и обмена эпителиальных клеток желудка, оказывает гастропротективный эффект при воздействии на слизистую оболочку НПВП.
В настоящее время большое количество пациентов нуждается в антиагрегантной терапии. Но даже НДА при регулярном приеме более чем в 90% случаев приводят к развитию гастро- и энтеропатий (диспепсии, острому поражению слизистой оболочки, эрозиям, язвам и их осложнениям – язвенному кровотечению и смерти). Ингибиторы протонной помпы (ИПП) не всегда дают ожидаемые результаты при профилактике и лечении НПВП-гастропатий. Так, они не эффективны при повреждениях слизистой оболочки тонкой кишки и могут снижать эффективность антиагрегантной терапии (омепразол, эзомепразол) [38, 39]. Протективные свойства ребамипида подтверждены не только экспериментально, но и клинически [13]. Противоязвенный и противовоспалительный эффекты препарата в отношении НПВП-энтеропатий, в том числе при приеме НДА, зафиксированы в исследовании с участием здоровых добровольцев. Общее количество аспирин-ассоциированных повреждений подвздошной кишки к четвертой неделе терапии у здоровых добровольцев было в три раза ниже при использовании ребамипида (р=0,03) [14]. Интересно, что лечебный эффект Ребагита обусловлен не только системным действием после абсорбции из ЖКТ, но и прямым местным проникновением в слизистую оболочку при перемещении по ЖКТ [15].
У 38 пациентов, получавших НДА (100 мг) свыше 3 мес, для лечения энтеропатии использовали высокие дозы ребамипида (300 мг/сут). После 8 нед лечения в группе ребамипида по сравнению с группой плацебо достоверно уменьшилось количество повреждений (язв, эрозий) слизистой оболочки (р=0,046), что было подтверждено при выполнении ВКЭ. Высокие дозы препарата переносились удовлетворительно: такой вывод был сделан при использовании тройных доз ребамипида (900 мг/сут), которые назначались здоровым добровольцам, а также пациентам с НПВП-индуцированной энтеропатией [16].
Один из ключевых механизмов развития энтеропатии – нарушение проницаемости слизистой оболочки тонкой кишки. Этот механизм доказан в исследовании, посвященном сравнительной оценке эффективности ребамипида и ИПП при лечении диклофенак-индуцированной энтеропатии [17].
Ребамипид способствует снижению риска тонкокишечных кровотечений, что было показано с помощью ВКЭ в исследовании с участием 31 пациента с ИБС, получавших антитромбоцитарный препарат (тиенопиридин) и НПВП (отношение рисков 0,31; 95% доверительный интервал 0,12–0,82, р=0,02) [18].
176 пациентов с хроническим гастритом получали ребамипид в течение 26 нед. При оценке до и после лечения в основной и контрольной группах методом иммуногистохимии было установлено, что ребамипид способствовал улучшению состояния слизистой оболочки желудка за счет снижения в ней экспрессии CDX2 (р=0,021) и TFF3 (р=0,012) – иммуногистохимических маркеров дисплазии и карциномы. Отмечалась хорошая приверженность пациентов лечению [19].
К сожалению, эрадикация инфекции, вызванной H. pylori, не способна полностью устранить риск развития рака желудка. Поэтому проблема его профилактики актуальна и сегодня. В экспериментах на крысах при индуцированном канцерогенезе (N-метил-N’-нитро-N-нитрозогуанидин) показан превентивный эффект ребамипида. Заболеваемость раком в группе ребамипида была достоверно ниже, чем в группе контроля (р <0,05). При этом наблюдалась тенденция к более низкой частоте инвазии карциномы в мышечный слой в группе ребамипида [20].
В пилотных проектах (6 исследований, 611 пациентов) добавление ребамипида повышало эффективность эрадикации H. pylori. Так, в группе пациентов, получавших ребамипид в дополнение к амоксициллину и ИПП, эрадикация составила 73,3%, в группе без ребамипида – 61,4% (р <0,05) [21].
В другом исследовании изучались изменения гистологической картины гастрита у пациентов, получавших ребамипид после эрадикации H. pylori. 169 пациентов, достигших успешной эрадикации, были случайным образом разделены на две группы – основную (n=82) и контрольную (n=87). Пациенты основной группы получали ребамипид. Гистопатологические изменения оценивали по обновленной системе Sydney в начале исследования и год спустя. Результаты показали в основной группе достоверное уменьшение выраженности хронического воспаления в области малой кривизны тела желудка на фоне приема ребамипида после эрадикации H. pylori по сравнению с контрольной группой (1,12±0,08 против 1,35±0,08; р=0,043) [22].
Эксперименты на крысах показали, что использование ребамипида может изменять состав микробиома пищевода и вследствие этого уменьшать риск развития пищевода Барретта [23].
Определенные трудности связаны с профилактикой и лечением язв желудка после эндоскопической подслизистой диссекции. Систематический обзор и метаанализ продемонстрировали, что добавление к ИПП ребамипида в течение 8 нед до и 4 нед после процедуры может сокращать частоту изъязвлений и ускорять сроки заживления постоперационных язв по сравнению с монотерапией ИПП [24–26].
Энтеропротективные свойства Ребагита объясняются его модулирующим воздействием на микробиоту. Применение препарата способствует снижению до нормального уровня концентрации энтерококка и энтеробактерий в слизистой оболочке подвздошной кишки и, кроме того, уменьшению воспаления за счет супрессии гена, ответственного за экспрессию ФНО-альфа и Duox2 (двойной оксидазы, регулирующей секрецию слюнных желез и желез ЖКТ) [27].
Из 10 047 пролеченных пациентов нежелательные явления, включая патологические результаты лабораторного обследования, были зарегистрированы у 54 участников (0,54%). К ним относились симптомы со стороны ЖКТ, такие как запор, повышенное газообразование, тошнота и диарея. Важный момент: из 3035 пациентов в возрасте более 65 лет нежелательные реакции были зарегистрированы лишь у 18 пациентов (0,59%). Природа и частота развития этих реакций у данной группы пациентов не отличалась от таковой у лиц молодого и пожилого возраста.
Таким образом, по данным многочисленных зарубежных исследований, ребамипид оказывает цитопротекторное действие в отношении слизистой оболочки желудка и тонкой кишки при повреждающем воздействии различных факторов (НПВП, этанола, щелочей, H. pylori и др.). Препарат способствует активации энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов, повышению содержания слизи на поверхности стенки желудка, улучшению кровоснабжения слизистой оболочки желудка, активируя ее барьерную функцию, усиливает пролиферацию и обмен эпителиальных клеток желудка, освобождает слизистую оболочку от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами. Подтверждение тому – результаты экспериментальных и клинических исследований [1].
Положительные эффекты ребапимида наблюдаются не только со стороны ЖКТ. В ряде исследований показано, что он ингибирует воспаление суставов, восстанавливая дисбаланс между Th17 и T-регуляторными клетками и активируя оксигеназу Nrf2/HO-1 [32]. А после использования в течение 2 нед 2%-ного раствора ребамипида в виде глазных капель снижается уровень интерлейкинов (ИЛ) 6, 17, ФНО-альфа в слезной жидкости и, следовательно, уровень воспаления. Показано, что 2%-ная суспензия ребамипида намного эффективнее 0,1%-ного раствора гиалуроната натрия у пациентов с синдромом «сухого глаза» [33].
Результаты пилотных исследований ребамипида продемонстрировали хороший эффект препарата в заживлении язв и эрозий слизистой оболочки полости рта при рецидивирующем афтозном стоматите и болезни Бехчета. Полоскания раствором ребамипида эффективны при воспалении слизистой оболочки полости рта у пациентов после химиотерапии [34–36].
Изучается возможность использования ребамипида при витилиго. Ребамипид за счет ингибирования цитокинов ИЛ-6, ИЛ-8, ИЛ-10, ФНО-альфа и Th17 влияет на окислительный стресс, играющий определенную роль в развитии этого заболевания [37].
В 2016 г. ребамипид появился на российском фармацевтическом рынке. Сегодня он представлен препаратом Ребагит («ПРО.МЕД.ЦС Прага»). Таким образом, теперь в арсенале отечественных врачей имеется уникальный гастро- и энтеропротектор, не имеющий аналогов в России.
Цель исследования – изучить гастроцитопротективный эффект ребамипида в комбинированной терапии с ИПП при эрозивно-язвенных поражениях верхних отделов ЖКТ.
МАТЕРИАЛ И МЕТОДЫ
Обследованы 140 больных с эрозивно-язвенными поражениями верхних отделов ЖКТ (54 мужчины и 86 женщин). Возраст пациентов составлял 22–85 лет, средний возраст 57,8±1,3 лет (M±σ). Диагноз был верифицирован данными клинических, объективных и эндоскопических методов исследования. У 50 из 140 обследованных больных перед коронарографией (КАГ) и аортокоронарным шунтированием (АКШ) при эзофагогастродуоденоскопии (ЭГДС) были обнаружены эрозивно-язвенные поражения верхних отделов ЖКТ.
Больные в зависимости от проводимой терапии разделены на 2 группы:
- • 1 группа (110 человек) получала Ребагит по 100 мг 3 раза/сут + ИПП 20 мг 2 раза/сут;
- • 2 группа (30 человек) получала Де-нол 240 мг 2 раза/сут + ИПП 20 мг 2 раза/сут.
При выявлении H. pylori (Нр) к терапии добавлялся Клацид (500 мг 3 раза/сут). Всем больным до и после лечения проводилась ЭГДС с определением H. Pylori уреазным тестом (Нр в биоптате). Статистическая обработка данных проводилась с использованием компьютерной программы STATISTICA 6.0, достоверность полученных величин определяли при помощи t-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении ЭГДС 140 пациентам с эрозивно-язвенными заболеваниями верхних отделов ЖКТ у 84 (60%) из них был выявлен эрозивный гастрит, у 14 (10%) – эрозивный эзофагит, у 14 (10%) – язвенная болезнь двенадцатиперстной кишки (ЯБДПК), у 12 (8,6%) – язвенная болезнь желудка (ЯБЖ), у 8 (5,7%) – эрозивный дуоденит и еще у 8 (5,7%) – эрозивный гастрит и эрозивный дуоденит (рис. 1).
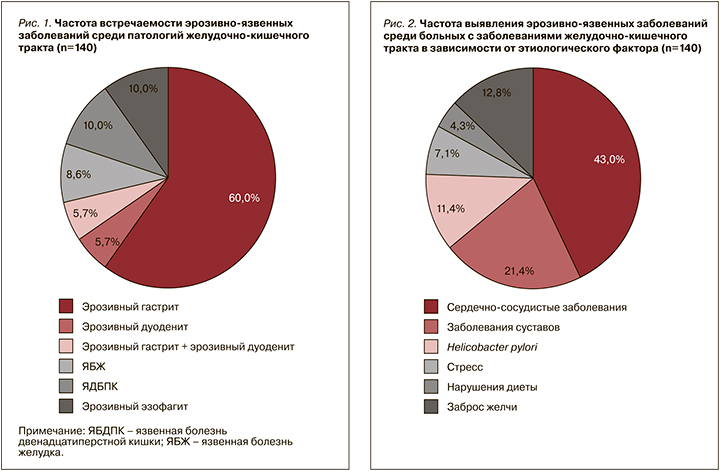
Далее проводился анализ частоты выявления эрозивно-язвенных поражений среди больных с заболеваниями ЖКТ в зависимости от этиологического фактора (рис. 2).
Как видно из рис. 2, среди 140 обследованных больных эрозивно-язвенные поражения ЖКТ чаще выявлялись у больных с сердечно-сосудистыми заболеваниями (ССЗ), которые принимают низкие дозы аспирина (НДА) и антикоагулянты – у 60 (43%) человек. У 30 человек (21,4%) имелись заболевания суставов (при этом они длительно использовали НПВП), у 18 (12,8%) – заброс желчи и ЖКБ в анамнезе (холецистэктомия и холедохолитиаз на ЭГДС – дуоденогастральный рефлюкс), у 16 (11,4%) – хеликобактериоз (Н. pylori). Еще у 10 человек (7,1%) эрозивно-язвенные поражения ЖКТ развились после длительного стресса, и лишь у 6 (4,3%) причиной эрозий и язв были нарушения в диете (злоупотребление острой и соленой пищей).
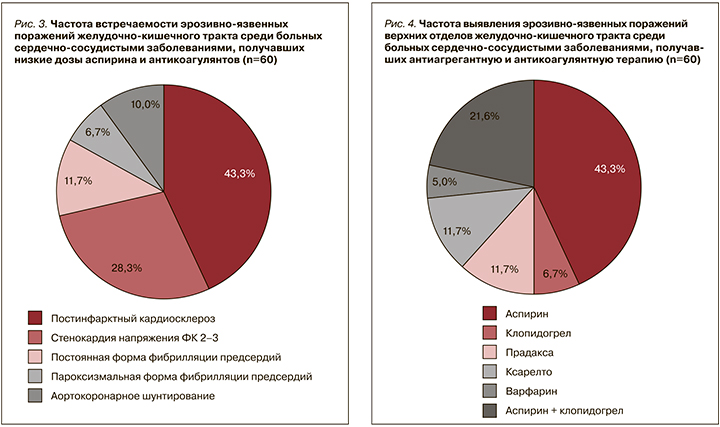
Также была проанализирована частота выявления эрозивно-язвенных поражений ЖКТ среди больных ССЗ, получавших НДА и антикоагулянты, после стентирования коронарных артерий (рис. 3).
Как видно из рис. 3, среди 60 больных ССЗ, постоянно получавших НДА и антикоагулянты, эрозивно-язвенные поражения ЖКТ чаще всего выявлялись при постинфарктном кардиосклерозе – у 26 пациентов (43,3%). При стенокардии напряжения ФК 2–3 аналогичный показатель составил 17 (28,3%) человек, при АКШ – 6 (10%), при постоянной форме фибрилляции предсердий (ФП) – 7 (11,7%) человек. Лишь 4 (6,7%) пациента страдали пароксизмальной формой ФП.
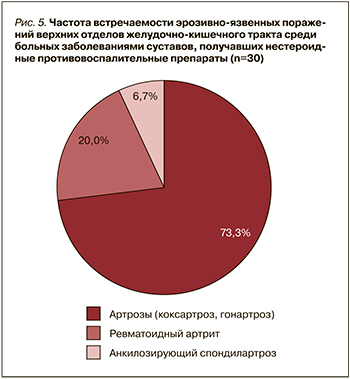 Следует подчеркнуть, что большинство больных, получавших НДА, со стороны ЖКТ активно жалоб не предъявляли, а эрозии и язвы верхних отделов ЖКТ выявлялись только при ЭГДС. При этом у 15 (25%) пациентов были обнаружены множественные хронические эрозии.
Следует подчеркнуть, что большинство больных, получавших НДА, со стороны ЖКТ активно жалоб не предъявляли, а эрозии и язвы верхних отделов ЖКТ выявлялись только при ЭГДС. При этом у 15 (25%) пациентов были обнаружены множественные хронические эрозии.
Результаты, полученные при анализе частоты выявления эрозивно-язвенных поражений ЖКТ среди больных ССЗ в зависимости от принимаемых препаратов в рамках антиагрегантной и антикоагулянтной терапии, отражены на рисунке 4.
Как видно из рисунка 4, среди 60 больных ССЗ, у которых были выявлены эрозивно-язвенные поражения верхних отделов ЖКТ, 26 (43,3%) человек получали низкие дозы аспирина, 4 (6,7%) – клопидрогрел, 7 (11,7%) – ксарелто, 7 (11,7%) – прадаксу, 3 (5%) – варфарин, еще 13 (21,6%) пациентов одновременно принимали аспирин и клопидрогрел.
Также в данном исследовании нами проводился анализ частоты выявления эрозивно-язвенных поражений верхних отделов ЖКТ у больных с заболеваниями суставов, получавших НПВП (рис. 5).
Как видно из рисунка 5, среди 30 больных с заболеваниями суставов, получавших НПВП, эрозивно-язвенные поражения ЖКТ чаще выявлялись при артрозах – у 22 (73,3%) человек. 6 (20%) пациентов страдали ревматоидным артритом (РА) и еще 2 (6,7%) – анкилозирующим спондилоартрозом.
В ходе исследования был проведен анализ сравнительной клинической эффективности терапии при эрозивно-язвенных поражениях верхних отделов ЖКТ до и после лечения ребамипидом (Ребагит) и висмута трикалия дицитратом (Де-нол) (рис. 6).
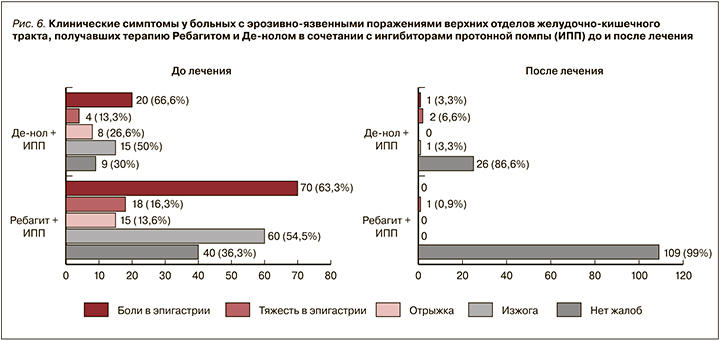
Как следует из рисунка 6, в группе исследования, получавшей Ребагит+ИПП (110 больных), до лечения 60 (54,5%) пациентов предъявляли жалобы на изжогу, 15 (13,6%) – на отрыжку воздухом, 18 (16,3%) – на тяжесть в эпигастрии после еды, 70 (63,3%) – на боли в эпигастрии, 40 (36,3%) человек не предъявляли жалоб (эрозии и язвы были выявлены случайно при ЭГДС перед КАГ). После лечения Ребагитом и ИПП в течение 3–4 нед у 109 из 110 больных (99%) отмечалась клинически положительная динамика: отсутствовали жалобы со стороны ЖКТ, при пальпации не было боли в эпигастрии. Лишь у одной больной (0,9%) отмечалась тяжесть в эпигастрии; при этом у данной пациентки при контрольной ЭГДС после лечения Ребагитом в дозе 300 мг/сут через 4 нед крупный язвенный дефект уменьшился с 30–35 до 15–20 мм в диаметре, в связи с чем доза Ребагита была увеличена до 600 мг/сут.
В группе, получавшей Де-нол+ИПП (30 больных) до лечения, 15 (50%) человек предъявляли жалобы на изжогу, 8 (26,6%) – на отрыжку воздухом, 4 (13,3%) – на тяжесть в эпигастрии после еды, 20 (66,6%) – на боли в эпигастрии, 9 (10%) не предъявляли жалоб (эрозии и язвы выявлены случайно при ЭГДС перед КАГ). Через 3–4 нед после лечения Де-нолом и ИПП у 26 из 30 больных (86,7%) отмечалась клинически положительная динамика: отсутствовали жалобы со стороны ЖКТ, при пальпации не было боли в эпигастрии. После лечения Де-нолом у 4 из 30 (13,3%) пациентов жалобы сохранялись: двое (6,6%) предъявляли жалобы на тяжесть в эпигастрии после приема пищи, у одного (3,3%) сохранялись боли в эпигастрии, еще у одного (3,3%) – изжога.
Динамика эндоскопических признаков в группах пациентов, получавших Ребагит+ИПП и Де-нол+ИПП, приведена в таблице.
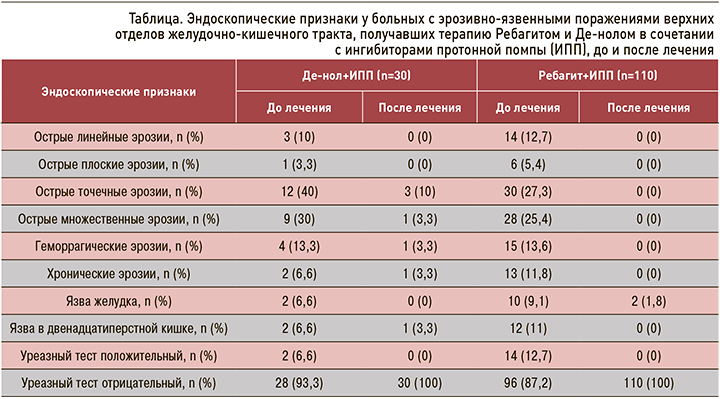
Как можно видеть, в группе пациентов, получавших терапию Ребагитом и ИПП, при контрольной ЭГДС после лечения у 108 из 110 больных (98,2%) эрозии полностью заэпителизировались, язвы полностью зарубцевались, анализ на H. pylori был отрицательным. Лишь у двух больных положительная динамика была медленной. У одной больной при ЭГДС были выявлены две крупные язвы до 30‒35 мм в диаметре с «подрытыми» краями, глубиной до 10‒12 мм; через 4 нед после лечения Ребагитом (300мг/сут) + ИПП (40 мг/сут) язвенный дефект уменьшился с 30‒35 до 15‒20 мм в диаметре. У второго больного на фоне постоянной терапии по поводу анкилозирующего спондилоартрита (мелоксикам 15 мг/сут, методжек 10 мг и инфликсимаб по 400 мг в/а капельно каждые 8 нед) после лечения Ребагитом (300 мг/сут) в сочетании с ИПП (40 мг/сут) язва уменьшилась с 0,6 до 0,4 см. Этим больным доза Ребагита была увеличена до 600 мг в сутки, и продолжено лечение ИПП в дозировке 20 мг 2 раза/сут: через 4 нед при контрольном ЭГДС язвы у них зарубцевались.
Также следует подчеркнуть, что у одного больного при ЭГДС была обнаружена крупная и глубокая язва в желудке до 3,5 мм; ему сразу был назначен Ребагита в дозе 600 мг/сут в сочетании с ИПП. При контрольном ЭГДС через один месяц язва у этого пациента полностью зарубцевалась.
Среди 110 больных, получавших Ребагит и ИПП, до лечения у 14 (12,7%) больных выявлялась Н. pylori. Этим пациентам к терапии был добавлен Клацид (500 мг 3 раза/сут); после лечения у всех 14 больных уреазный тест был отрицательным. Добавим, что среди 110 больных лишь у одной пациентки были отмечены нежелательные реакции: на фоне приема Ребагита возникли боли в животе, в связи с чем она самостоятельно отменила прием препарата. Тем не менее при контрольной ЭГДС у этой больной эрозии зарубцевались.
 В группе исследования, получавшей терапию Де-нолом и ИПП, у 23 из 30 больных (76,6%) при контрольной ЭГДС эрозии полностью заэпителизировались, язвы полностью зарубцевались, анализ на H. pylori был отрицательным (рис. 7). Лишь у 2 (6,6%) больных этой группы до лечения была выявлена Н. pylori. Им был добавлен к терапии Клацид (500 мг 3 раза/сут), после лечения у обоих больных уреазный тест был отрицательным.
В группе исследования, получавшей терапию Де-нолом и ИПП, у 23 из 30 больных (76,6%) при контрольной ЭГДС эрозии полностью заэпителизировались, язвы полностью зарубцевались, анализ на H. pylori был отрицательным (рис. 7). Лишь у 2 (6,6%) больных этой группы до лечения была выявлена Н. pylori. Им был добавлен к терапии Клацид (500 мг 3 раза/сут), после лечения у обоих больных уреазный тест был отрицательным.
Следует подчеркнуть, что у 7 (23,3%) больных после лечения Де-нолом и ИПП при контрольной ЭДГС не наблюдался положительный эффект: у 5 человек острые эрозии сохранялись, у одной больной множественные острые эрозии перешли в множественные хронические эрозии, еще у одного пациента язва желудка не зарубцевалась. В связи с отсутствием эндоскопического эффекта от приема Де-нола и ИПП все семеро больных из этой группы исследования были переведены в группу, получавшую Ребагит.
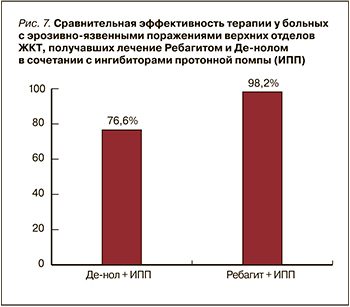
Как видно из рисунка 7, в группах больных, получавших Ребагит и Де-нол в сочетании с ИПП при эрозивно-язвенных поражениях верхних отделов ЖКТ, после лечения эндоскопическая эффективность терапии составила 98,2 и 76,6% соответственно. Клинически после лечения комбинацией ИПП+Ребагитом у 99% больных отсутствовали жалобы со стороны ЖКТ, при пальпации не отмечалась боль в эпигастрии. После лечения Де-нолом в сочетании с ИПП клиническая эффективность составила 86,7%.
ЗАКЛЮЧЕНИЕ
- При эрозивно-язвенных поражениях верхних отделов ЖКТ после комбинированного лечения ИПП+Ребагит эндоскопическая эффективность терапии составила 98,2%. Клинически у 99% больных, получавших указанную комбинированную терапию, после лечения отсутствовали жалобы со стороны ЖКТ. Это еще раз подтверждает гастроцитопротективный эффект Ребагита.
- Среди 140 обследованных пациентов эрозивно-язвенные поражения верхних отделов ЖКТ чаще всего выявлялись у больных ССЗ, получавших низкие дозы аспирина и антикоагулянтов (43,2%). При этом данные больные жалоб активно не предъявляли, эрозии и язвы в верхних отделах ЖКТ у них выявлялись только при ЭГДС перед коронарографией и аортокоронарным шунтированием.
- При крупных и глубоких язвах и выявлении язв у больных с сердечно-сосудистыми и ревматологическими заболеваниями, постоянно получающих аспирин в низких дозах и НПВП, необходимо увеличение дозы Ребагита до 600 мг/сут. Повышение дозировки Ребагита у участвовавших в исследовании пациентов полностью восстанавливало поврежденную слизистую оболочку, ускоряло заживление язв и предотвращало риск осложнений
Таким образом, результаты представленного исследования позволяют заключить, что Ребагит является высокоэффективным гастроцитопротектором, который способствует восстановлению поврежденной слизистой оболочки ЖКТ при эрозивно-язвенных поражениях верхних отделов ЖКТ независимо от этиологического фактора. Пациентам с крупными и глубокими язвами, а также больным сердечно-сосудистого и ревматологического профиля, постоянно получающим низкие дозы аспирина и НПВП, имеющим язвенные повреждения ЖКТ, необходимо увеличить дозу ребагита до 600 мг/сут.



