Диарея – частое или однократное опорожнение кишечника с выделением жидких каловых масс. Любая диарея – клиническое проявление нарушения всасывания воды и электролитов в кишечнике. Это один из наиболее частых синдромов, встречающихся в практике терапевта, врача общей практики, педиатра, гастроэнтеролога и инфекциониста.
Причины развития синдрома диареи многообразны. В патогенезе диареи участвуют четыре основных механизма:
- кишечная секреция;
- повышение осмотического давления в полости кишки;
- кишечная экссудация;
- нарушение транзита кишечного содержимого.
Механизмы диареи тесно связаны между собой, но для каждого заболевания характерен преобладающий тип. Этим объясняются особенности клинических проявлений различных типов диареи (табл. 1) [1–5].
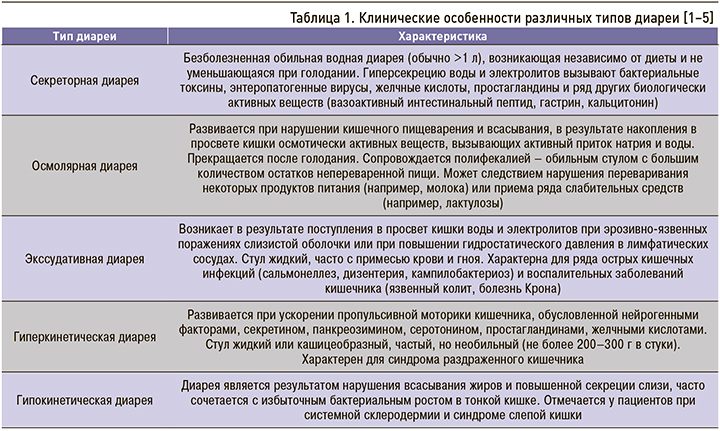
Выделяют острую и хроническую формы диареи.
Диарея считается острой, если продолжается до двух недель. Обычно она имеет инфекционную этиологию [6–9]. Основными ее возбудителями выступают бактерии (кишечная палочка с патогенными свойствами, сальмонеллы, кампилобактерии, шигеллы, вибрионы, иерсинии), вирусы (ротавирусы, аденовирусы, энтеровирусы), простейшие (лямблии, дизентерийная амеба, кристоспоридии). Инфекционная диарея сопровождается тошнотой, рвотой, схваткообразными болями в животе и в легких случаях прекращается самостоятельно. Тяжелые формы быстро приводят к обезвоживанию и истощению. Пристального внимания со стороны врача и наблюдения за больным в условиях стационара требует быстро прогрессирующая диарея и объем стула более 1 л. При несвоевременном оказании помощи больному грозит развитие дегидратации, гиповолемии, метаболического ацидоза [6–9].
Диарея считается хронической, если продолжается свыше 3 нед. Она может быть клиническим проявлением многих заболеваний (в первую очередь пищеварительной системы), и выяснение ее причин должно начинаться с изучения данных анамнеза, физического исследования и макроскопии фекалий [10–12].
ПРИЧИНЫ ДИАРЕИ И ЕЕ ОСОБЕННОСТИ ПРИ РАЗНЫХ ЗАБОЛЕВАНИЯХ
При сборе анамнеза следует обратить внимание на особенности начала, объем стула, наличие тенезмов и дефекаций в ночное время суток, связь диареи с болями в животе, присутствие крови в стуле, изменения массы тела. Копрологическое исследование дает возможность выявлять жир (стеаторея), мышечные волокна (креаторея), глыбки крахмала (амилорея), свидетельствующие о нарушениях кишечного пищеварения и всасывания, и кристаллы желчных кислот, указывающие на возможность хологенной диареи. Большое значение имеет и обнаружение яиц гельминтов, лямблий и амеб [13].
Диарея может возникать при повышенном поступлении желчи в подвздошную и слепую кишку.
В этих случаях желчь, обладая детергентными свойствами, вызывает гиперкинезию кишечника и гиперсекрецию воды и электролитов. Подобная диарея называется хологенной и развивается после обширной резекции тонкой кишки, включая подвздошную, у больных с воспалительными заболеваниями подвздошной кишки, дисфункциях билиарного тракта и после холецистэктомии [14, 15]. Хологенная диарея характеризуется частым обильным водянистым стулом ярко-желтой или зеленой окраски (холерея). У большинства больных она сочетается с болями в правой подвздошной области [14, 16].
Хроническая диарея в сочетании с метеоризмом, ранней болью в эпигастральной области, чаще дистензионного висцерального характера с симптомами желудочного дискомфорта (тяжесть в эпигастрии после приема пищи, тошнота, отрыжка), снижением массы тела типична для гастритоподобного варианта хронического дуоденита [17].
Диарея в 70–80 % случаев – симптом болезни Крона, особенно выраженный при поражении толстой кишки. Она проявляется неоформленным (иногда жидким) стулом, имеющим примесь слизи, с частотой 5 раз в сутки и более. Диарея часто возникает после еды, может наблюдаться нередко в ночные часы. Примесь крови в стуле обнаруживается приблизительно у 40 % пациентов с поражением толстой кишки. Патологические примеси в кале (кровь, гной) отмечаются преимущественно при поражении левой половины толстой кишки [3, 13].
Клиническая картина язвенного колита зависит от тяжести и протяженности процесса. В легких случаях с ограниченным поражением прямой кишки больные жалуются на тенезмы (неотложные болезненные позывы с чувством неполного опорожнения) с примесью слизи и крови в кале. Более распространенное поражение сопровождается диареей (частый кашицеобразный или жидкий стул) и тенезмами. При развернутой клинической картине дискинетический и язвенно-геморрагический синдромы воспаления кишечника проявляются частым жидким стулом, с примесью крови, гноя и слизи («малиновое желе»). Частота дефекаций может достигать 20–40 раз в сутки.
В период обострения кровопотеря может составлять до 100–200 мл/сут.
Для язвенного колита наиболее характерна ночная (преимущественно ночью и утром) и постпрандиальная диарея. Больные могут страдать недержанием кала, что связано с поражением сфинктера заднего прохода и общей слабостью. [3, 13].
Диарея, вызванная паразитическими простейшими (амебы, лямблии), может развиваться не только остро, но и постепенно и может сопровождаться постоянными болями в животе и появлением крови в кале.
Глютеновая энтеропатия (глютенчувствительная целиакия) – хроническая генетически детерминированная аутоиммунная Т-клеточно-опосредованная энтеропатия, характеризующаяся стойкой непереносимостью специфических белков эндосперма зерна некоторых злаковых культур с развитием гиперрегенераторной атрофии слизистой оболочки тонкой кишки и связанного с ней синдрома мальабсорбции [18]. Типичная форма целиакии начинается в детстве, протекает с выраженным синдромом нарушенного всасывания: диареей, полифекалией, истощением, отеками, отставанием в развитии и т.д. Латентная форма целиакии характеризуется малосимптомным течением и может отмечаться у взрослых пациентов, преимущественно женщин. К характерным ее симптомам относятся хроническая диарея (стул обильный, пенистый), маленький рост, железодефицитная анемия, остеопороз. Обострения заболевания связаны с употреблением продуктов из пшеницы, ржи, овса, ячменя [19, 20].
При дивертикулярной болезни толстой кишки часто отмечается чередование запоров с диарей в сочетании со схваткообразными болями, преимущественно в левой нижней части живота слева, и метеоризмом [21, 22]. При дивертикулите диарея (30%) относится к диагностически значимым жалобам вместе с усиливающейся болью в левой подвздошной области (70%); реже у пациентов отмечаются анорексия, тошнота и рвота (20%); гипертермия и дизурические явления (15%). При наличии у пациента хронической диареи у интерниста должна быть онконастороженность, поскольку диарея может быть проявлением опухолевых заболеваний желудочно-кишечного тракта (ЖКТ). Так, диарея встречается почти у половины больных с гастриномой (синдромом Золлингера–Эллисона), причем у 20% пациентов она может выступать единственным проявлением заболевания. Развитие диареи связано с поступлением в тощую кишку значительного количества кислого желудочного содержимого с последующим усилением моторики тонкой кишки и развитием в ней воспаления, увеличением секреции ионов калия, замедлением всасывания воды в кишечнике за счет непосредственного действия гастрина и вторичной гиперсекрецией панкреатических бикарбонатов. При низких значениях рН происходит инактивация липазы, что приводит к возникновению стеатореи. [13].
Синдром Вернера–Моррисона (панкреатическая холера) возникает у пациентов с опухолью, развивающейся из нейроэндокринной ткани поджелудочной железы в 90% случаев (либо в области симпатического ствола в 10%), вырабатывающей вазоактивный интестинальный полипептид (ВИПома). Для синдрома характерны водянистый стул, гипокалиемия и почечная недостаточность. Количество теряемой за сутки воды может составить около 4–10 л, причем одновременно с водой теряются натрий и калий. Развивается тяжелая дегидратация, потеря массы тела, гипокалиемия. Диарея обусловлена высокой секрецией натрия и воды в просвет кишечника под влиянием вазоактивного интестинального полипептида (ВИП).
В результате подавления ВИП желудочной секреции возникает гипохлоргидрия. У 25–30% больных наблюдаются приливы крови и приступообразное покраснение лица (вследствие выраженного вазодилатирующего эффекта ВИП). Отмечается тенденция к снижению артериального давления, возможна выраженная артериальная гипотензия. [13].
Карциноидный синдром, обусловленный гормонально-активной опухолью, исходящей из энтеро-хромаффинных (аргентаффинных) клеток кишечника, часто сопровождается диареей (75%), в сочетании с покраснением кожи (90%), шумным дыханием (20%), эндокардиальным фиброзом (33%), поражением клапанов правого отдела сердца.
Диарея в сочетании с болью в животе и субфебрилитетом может быть одним из проявлений злокачественной опухоли толстого кишечника. Диарея при опухолях толстого кишечника относится к числу характерных признаков кишечной непроходимости. Стул может быть кашицеобразным или водянистым, частота его может составлять 10–12 раз в сутки, при этом суточный объем стула небольшой, редко достигающий 1 л. Характерно появление диареи после запора различной длительности. Диарея чаще встречается при раке дистальных отделов толстой кишки. При раке толстой кишки диарея не бывает длительной в отличие от опухолей тонкой кишки [12].
При лечении онкологических заболеваний диарея может быть следствием цитостатической энтеропатии и лучевого (пострадиационного) колита.
Диарея может носить и функциональный характер: в случае функциональной диареи (подраздел С3 в соответствии с классификацией функциональных расстройств кишечника по Римским критериям IV) и синдроме раздраженного кишечника (подраздел С1) при варианте с диареей (жидкий или кашицеобразный чаще 25%, а твердый или комковатый стул реже 25% всех актов дефекации) и смешанном варианте (жидкий или кашицеобразный чаще 25%, твердый или комковатый стул чаще 25% всех актов дефекации). [23, 24].
Наряду с изменениями частоты стула у больных синдромом раздраженного кишечника (СРК) наблюдается изменение формы и консистенции кала, характерны типы 6 и 7 по Бристольской шкале распределения кала по форме. Учащение стула может сочетаться с выделением небольшого суточного количества кала кашицеобразной или жидкой консистенции (так называемая дистальная диарея малого объема). При запорах, наоборот, больной может жаловаться на однократное выделение кала, который в начале дефекации оформленный, а затем кашицеобразный и даже водянистый (так называемый пробкообразный стул).
Для пациентов с СРК характерны утренняя диарея, возникающая после завтрака и в первую половину дня, и отсутствие диареи по ночам. Половина больных СРК отмечает примесь слизи в кале, происхождение и причины образования которой остаются неизученными. Выделение крови с калом, ночная диарея, синдром мальабсорбции и потеря массы тела при этом относятся к симптомам «тревоги», исключающим диагноз СРК и требующим настойчивых поисков органического заболевания [25, 26]. Римскими критериями IV определен минимум обследования пациентов с СРК: общий анализ крови и кала, С-реактивный белок, фекальный кальпротектин [23, 24]. В соответствии с рекомендациями Российской гастроэнтерологической ассоциации (2016), в диагностический минимум добавлены тест на скрытую кровь в кале и определение антител IgA к тканевой трансглутаминазе для исключения целиакии [25].
Диарея выступает симптомом не только заболеваний ЖКТ [1, 13]. Так, у больных сахарным диабетом она может быть одним из ведущих проявлений диабетической энтеропатии [27, 28], для которой типично волнообразное течение с чередованием периодов обострений продолжительностью от нескольких часов или дней до нескольких недель (частота стула может достигать 15–30 раз в сутки) и периодов относительного благополучия. Наблюдается сохранение диареи в ночное время и ее усиление после приема пищи (постпрандиальная диарея). Стул при этом водянистый, коричневый, могут отмечаться тенезмы. При анализе кала может выявляться стеаторея, но существенной потери массы тела у пациентов, как правило, не происходит.
Диарея и гипердефекация могут сопутствовать гиперфункции щитовидной железы и относятся к клиническим критериям диагностики диффузного токсического зоба [29].
Диарея может быть одним из висцеральных проявлений сидеропенического синдрома при железодефицитной анемии и гастроэнтерологического синдрома при В12-дефицитной анемии [29, 30].
Медикаментозно обусловленная диарея может быть вызвана приемом препаратов магния (в том числе и антацидов, содержащих магний), ингибиторов протонной помпы, нестероидных противовоспалительных препаратов (НПВП-энтеропатия) [31], селективных ингибиторов обратного захвата серотонина, слабительных средств, сердечных гликозидов, хенодезоксихолевой кислоты, антикоагулянтов, повышенных доз эссенциальных фосфолипидов [13].
Диарея, ассоциированная с приемом антибиотиков (ААД), может развиваться не только остро, но и принимать хроническое течение. Наиболее часто она возникает в результате избыточного роста бактерий при подавлении облигатной кишечной микрофлоры антибактериальными препаратами. Этиологическим фактором развития ААД выступают Clostridium difficile, Clostridium perfringers, Staphylococcus aureus, Salmonella spp., Klebsiella oxytoca, Candida spp. Почти все антибиотики, кроме ванкомицина, способны вызывать диарею, связанную с анаэробной флорой. Длительное время ААД относилась к госпитальным инфекциям, однако в последнее время она все чаще встречается у пациентов и в амбулаторных условиях [32].
Клинические проявления синдрома избыточного бактериального роста (СИБР) весьма вариабельны, среди них роль первой ласточки обычно играет синдром желудочно-кишечной диспепсии: диарея, реже запор, метеоризм, вздутие, урчание в животе, отрыжка и неприятный запах изо рта [3, 13].
Диарея не принадлежит к обязательным симп-томам СИБР, но чаще именно она значительно понижает качество жизни пациента и заставляет его обратиться к врачу. Диарейный синдром носит комбинированный характер (осмотический, секреторный и гипермоторный компоненты) и имеет клиническую окраску в зависимости от варианта кишечной диспепсии (табл. 2).

ЗНАЧЕНИЕ КОРРЕКЦИИ КИШЕЧНОГО МИКРОБИОЦЕНОЗА
Перечисленные выше патологические состояния и нозологические формы не являются полным перечнем возможных причин развития синдрома хронической диареи, но все же составляют большую часть встречающихся болезней, которые необходимо рассматривать врачу первого контакта (врачу общей практики и терапевту) при проведении дифференциальной диагностики. Следует отметить, что при любой хронической диарее наблюдается изменение количественного и качественного состава кишечной микрофлоры [33–36], в связи с чем коррекция нарушений кишечного микробиоценоза с применением пробиотиков, пребиотиков, синбиотиков, а в ряде ситуаций и антибактериальных препаратов необходима всем пациентам с этим нарушением здоровья (а не только с синдромом избыточного бактериального роста).
Пробиотики – живые микроорганизмы, которые при использовании в адекватных количествах вызывают улучшение здоровья организма хозяина. Механизм взаимодействия «пробиотик – хозяин» включает иммунологические и неиммунологические эффекты (табл. 3).

Современные пробиотики должны соответствовать следующим требованиям:
- высокой жизнеспособности и биологической активности;
- высокой адгезивности;
- содержанию пробиотических штаммов 106–109;
- антагонизму по отношению к условно-патогенной и патогенной флоре;
- устойчивости к физико-химическим факторам (кислотность, осмотический шок, температура, действие желчных кислот и т.п.);
- сохранению стабильности на протяжении срока хранения;
- антибиотикоустойчивости;
- клинически доказанной эффективности и хорошей переносимости [26, 39].
В зависимости от качественного состава бактерий пробиотики подразделяются на три группы:
- моноштаммовые, содержащие один штамм бактерий определенного вида;
- мультиштаммовые, включающие несколько штаммов одного вида микроорганизмов;
- многовидовые (многокомпонентные), состоящие из штаммов различных видов, принадлежащих к одному или к разным семействам бактерий.
Необходимо подчеркнуть: тезис о том, что многокомпонентные пробиотики, содержащие большое число (8 и более) пробиотических микроорганизмов, «отличаются улучшенной функцио-нальностью, активностью и эффективностью, обусловленной симбиозом и синергизмом разных видов микроорганизмов» и соответственно предпочтительнее моноштаммовых и мультиштаммовых пробиотиков, фактически базируется лишь на одном литературном обзоре, в котором рассматривались результаты единичных экспериментальных сравнительных исследований у животных [40].
Пребиотики – это пищевые вещества (в основном состоящие из некрахмальных полисахаридов и олигосахаридов, плохо перевариваемых человеческими ферментами), которые обеспечивают питание определенных групп кишечных микроорганизмов. Наиболее известные пребиотики – инулин, лактулоза, олигофруктоза, галактоолигосахариды, олигосахариды грудного молока. Ряд авторов относит к пребиотикам витамины и микроэлементы, поскольку только нормальная микрофлора кишечника обеспечивает полноценное всасывание этих нутрициентов [41].
Современная концепция коррекции нарушенного кишечного микробиоценоза заключается в комбинированном применении про- и пребиотиков или синбиотиков – продуктов, содержащих пробиотики и пребиотики, и совмещающих эффекты тех и других [41–45].
Всем современным требованиям к препаратам для коррекции нарушений кишечного микробиоценоза соответствует синбиотик Флориоза (БАД к пище). В его состав входят 3 особых пробиотических штамма бактерий: Bifidumbacterium lactis B1-04, Lactobacillus acidophilus La-14 и Lactobacillus rhamnosus Lr-32. Важной особенностью этих штаммов является высокая кислото-, пепсино- и желчеустойчивость и повышенные адгезивные свойства к слизистой оболочке ЖКТ; этим они отличаются от многих других штаммов, которые высокочувствительны к агрессивной среде верхних отделов ЖКТ, а потому в большинстве случаев выпускаются в защитных кишечнорастворимых капсулах.
Пробиотики, входящие в состав синбиотика Флориоза, вследствие высокой кислото-, пепсино- и желчеустойчивости и повышенным адгезивным свойствам к слизистой оболочке ЖКТ действуют на всем протяжении ЖКТ и не нуждаются в специальной защитной капсуле; препарат выпускается в форме порошка в пакетиках-саше, который необходимо рассасывать в полости рта до полного растворения. Содержащаяся в нем комбинация штаммов способствует нормализации микрофлоры, начиная с полости рта и верхних отделов ЖКТ (лактобактерии) и заканчивая толстой кишкой (бифидобактерии).
Этот момент особенно важен, поскольку установлено морфофункциональное сходство слизистой оболочки полости рта и пищеварительного тракта, а также наличие тесной взаимосвязи различных отделов ЖКТ с его начальным отделом – полостью рта, осуществляемой посредством анатомических, физиологических и гуморальных взаимосвязей [46]. Наиболее распространенной патологией слизистой оболочки полости рта при хронической диарее и заболеваниях кишечника выступает хронический рецидивирующий афтозный стоматит. Нередки случаи появления афт в полости рта задолго до возникновения симптомов со стороны ЖКТ. У больных с синдромом избыточного бактериального роста в кишечнике часто обнаруживаются глоссит, катаральный и афтозный стоматит, ангулярный стоматит (трещины в уголках рта), протекающие на фоне дефицита витаминов В12, РР и фолиевой кислоты [28, 47].
Изменения языка характеризуются яркой гиперемией с последующим цианозом, отечностью. Возможен складчатый язык, часто встречается десквамация и сглаженность его рельефа. Слизистая оболочка полости рта бледно-розового цвета, отмечается ее незначительная отечность, дорсальная поверхность языка равномерно обложена налетом серовато-желтого цвета, особенно интенсивно выраженного по утрам в дистальных отделах языка. Другие изменения слизистой оболочки полости рта, определяемые визуально, обусловлены сочетанием избыточного бактериального роста в кишечнике с поражением других отделов пищеварительной системы [46, 47].
ДОКАЗАТЕЛЬНАЯ БАЗА
Эффективность и хорошая переносимость пробиотических штаммов синбиотика Флориоза изучена и доказана в целом ряде исследований [48–54]. Они являются представителями естественной микрофлоры кишечника с высокой способностью к адгезии, их количество соответствует нормам ВОЗ и рекомендациям Российской гастроэнтерологической ассоциации: в 1 пакетике-саше содержится 3×109 пробиотических бактерий.
В ряде исследований описаны дополнительные свойства и эффекты пробиотических штаммов синбиотика Флориоза.
Отмечена устойчивость B. lactis B1-04 к антибиотикам [55, 56], а на рост L. acidophilus La-14 не оказывают ингибирующего влияния НПВП (диклофенак, ибупрофен) [57]. Продемонстрирована способность B. lactis B1-04 [58] и L. acidophilus La-14 [57] продуцировать бактериоцины, ингибирующие рост Listeria monocytogenes и других серологических типов Listeria spp.
В исследовании французских ученых было показано, что B. lactis B1-04 и L. acidophilus La-14 могут действовать в качестве адъювантов к гуморальному иммунному ответу после оральной вакцинации [59]. В ряде исследований продемонстрировано, что прием лактобактерий, в частности L. acidophilus La-14, уменьшает тяжесть ротавирусной диареи [60–62] и повышает иммуногенность и эффективность ротавирусных вакцин [63].
Австралийские ученые в рандомизированном двойном слепом плацебо-контролируемом исследовании [64] обнаружили, что профилактический прием B. lactis B1-04 снижает заболеваемость верхних дыхательных путей (ОР 0,73; 95% доверительный интервал 0,55–0,95; p=0,022). В другом рандомизированном плацебо-контролируемом исследовании американские ученые установили, что прием B. lactis B1-04 повышает устойчивость к риновирусной инфекции [65].
В клинических и экспериментальных исследованиях показана эффективность и хорошая переносимость перорального приема L. acidophilus La-14 в комплексной терапии цистита [66] и бактериального вагиноза [67, 68]. Кроме этого, L. acidophilus La-14 рассматривается как инновационный биологический инструмент для профилактики и терапевтического лечения гипероксалурии и воспалительных явлений, связанных с накоплением оксалатов [69, 70].
Синбиотик Флориоза также содержит инулин – сложный углевод, который выполняет функцию пребиотика. Он не переваривается в организме, но расщепляется бактериями в кишечнике, поэтому благотворно влияет на состояние микробиоты. Включение пребиотика положительно влияет на состав и активность лактобактерий и бифидобактерий. Кроме того, в процессе метаболизма из инулина в кишечнике образуются короткоцепочечные жирные кислоты, которые улучшают защитную функцию кишечника и иммунный ответ организма [71–73]. Благодаря тому, что синбиотик Флориоза выпускается в саше, в которое вмещается больше инулина, чем в капсулу, пациент получает при его приеме сразу 800 мг этого пребиотического компонента. В связи с этим заметим, что большинство пробиотиков в капсулах вообще не содержит инулин, который улучшает метаболизм колоноцитов и способствует физиологичному восстановлению микрофлоры.
Кроме этого, в одном саше синбиотика Флориоза содержатся витамины В1 (1,1 мг), В2 (1,4 мг), В6 (1,4 мг), В12 (2,5 мкг). Снабжение организма витаминами и минеральными веществами напрямую зависит от состояния микрофлоры кишечника. Поэтому при нарушении кишечного микробиоценоза важно компенсировать недостаток витаминов, в частности группы В, которые играют важную роль в обмене веществ. Они улучшают состояние нервной, сердечно-сосудистой систем и органов ЖКТ. Но особенно важно для пациентов гастроэнтерологического профиля то, что восполнение витаминов группы В нормализует моторику кишечника [74, 75]. Таким образом, значимое отличие синбиотика Флориоза от других синбиотиоков – широкая представленность витаминов группы В в их суточной потребности, что позволяет максимально компенсировать их дефицит у пациентов с нарушением кишечного микробиоценоза.
Синбиотик Флориоза разработан и произведен компанией Farmaceutici Procemsa S.p.A. (Италия) с использованием субстанции компании DuPont Nutrition & Biosciences – мирового лидера в производстве инновационных продуктов и решений в сфере фармацевтики, здравоохранения, питания и биотехнологии.
Режим дозирования синбиотика Флориоза составляет 1 пакет-саше в день во время еды. Как уже отмечалось, содержимое пакета-саше необходимо рассасывать в полости рта до полного растворения, при этом не требуется запивания водой. Продолжительность приема препарата 10–20 дней, при необходимости прием можно повторить.
Синбиотик Флориоза может быть полезен в комплексной коррекции нарушений моторики кишечника (диарея и запор), синдрома раздраженного кишечника, острых кишечных инфекций, хронических заболеваний ЖКТ, во время и после применения антибиотиков.
ЗАКЛЮЧЕНИЕ
Благодаря универсальным иммуномодулирующим свойствам пробиотики и синбиотики активно участвуют в процессах формирования системной и местной иммунорезистентности организма.
Их прием оправдан в рамках комплексной коррекции аллергических заболеваний, непереносимости лактозы, острых респираторных вирусных инфекциях (ОРВИ), синусита, фарингита, патологии пародонта, гельминтозов, а также у пациентов с частыми продолжительными стрессовыми ситуациями [41–45, 76–78].
Наличие в арсенале терапевта и врача общей практики современного синбиотика Флориоза, включающего пробиотические штаммы с хорошей доказательной базой эффективности и благоприятной переносимостью, позволит оптимизировать коррекцию синдрома хронической диареи и другой гастроэнтерологической патологии.



