До настоящего времени стандарты медикаментозной терапии неалкогольной жировой болезни печени (НАЖБП) не разработаны. Не существует патогенетически обоснованных показаний к применению того или иного препарата, что связано с отсутствием доказательств их способности уменьшать воспаление и фиброз печени, улучшать прогноз. В этом контексте лечебные мероприятия при НАЖБП направлены на устранение факторов, способствующих развитию болезни, коррекцию ассоциированных метаболических отклонений (ожирения, нарушений углеводного и липидного обменов) [1, 2].
Формирование НАЖБП неразрывно связано с гиперсекрецией адипокинов и цитокинов, хроническим воспалением, стрессом эндоплазматического ретикулума, оксидативным стрессом, митохондриальной и эндотелиальной дисфункцией, нарушениями кишечной микробиоты на фоне висцерального ожирения и инсулинорезистентности [3]. Дисфункция эндотелия выступает неотъемлемым звеном патогенеза НАЖБП, что обусловлено способностью экспрессированных на лейкоцитах и эндотелиоцитах молекул адгезии обеспечивать миграцию иммунных клеток в локусы воспаления. Имеются данные о повышенных плазменных уровнях адгезинов при НАЖБП, сопряженных с гистологической картиной, течением заболевания, метаболическим синдромом без оценки их динамики в ходе лечебных мероприятий [4–6].
Предполагается, что благоприятное влияние снижения массы тела и физических нагрузок на течение НАЖБП может быть связано с уменьшением активности макрофагов с М1-фенотипом, ответственных за хроническое воспаление, эндотелиальную дисфункцию, гиперэкспрессию провоспалительных цитокинов и молекул адгезии [7]. Так, снижение массы тела на фоне диеты и физической активности у пациентов с ожирением сопровождалось уменьшением плазменной концентрации молекулы межклеточной адгезии-1 (ICAM-1), молекулы адгезии сосудистого эндотелия-1 (VCAM-1), Е-селектина, увеличением сывороточных уровней адипонектина, что, возможно, обусловлено улучшением биодоступности оксида азота или снижением количеств липопротеинов низкой плотности (ЛНП) в крови [8]. Вместе с тем факт корректирующего воздействия аэробных нагрузок на показатели эндотелина-1 и молекул адгезии [9] оспаривается в ряде исследований [10].
Существуют данные о нормализации уровней адгезинов, содержания циркулирующих в крови эндотелиоцитов под влиянием статинов, α-липоевой кислоты [11, 12]. Применение на модели неалкогольного стеатогепатита (НАСГ) конъюгата урсодезоксихолевая кислота – лизофосфатидилэтаноламид снижало экспрессию генов фактора некроза опухоли-α (ФНО-α) и VCAM-1 [13]. Способность широко используемых при НАЖБП препаратов – пентоксифиллина, метформина, фосфоглива (глицирризиновой кислоты) – изменять адгезиновый статус при НАЖБП ранее не изучалась.
Цель исследования – оценка влияния различных вариантов терапии НАЖБП на показатели растворимых молекул адгезии.
МАТЕРИАЛ И МЕТОДЫ
В динамике лечения обследовано 42 пациента с НАЖБП (21 мужчина, 21 женщина) в возрасте от 19 до 65 лет (средний возраст 44,48±1,93 лет).
Критерии включения: пациенты с диагнозом НАЖБП старше 18 лет, согласие на участие в исследовании.
К критериям невключения относились заболевания печени другой этиологии; употребление алкоголя в гепатотоксических дозах; прием в течение последних 12 нед гепатопротекторов, препаратов, корректирующих нарушения углеводного и/или липидного обменов, глюкокортикостероидов, нестероидных противовоспалительных препаратов, антиоксидантов, иммуносупрессивных препаратов, пентоксифиллина; острые и хронические в периоде обострения клинически значимые соматические заболевания, трансплантация органа в анамнезе; злокачественные новообразования; психические заболевания; алкогольная или наркотическая зависимость, отказ от участия в исследовании.
У включенных в исследование больных определялись повышенные сывороточные уровни аспарагиновой (68,52±4,30 ед./л) и аланиновой аминотрансфераз (79,05±5,99 ед./л) (АСТ, АЛТ), гаммаглутамилтранспептидазы (ГГТ) (99,24±13,44 ед./л), увеличение индексов массы тела (ИМТ) (34,09±0,79 кг/м2) и инсулинорезистентности (HOMA-IR) (4,92±0,30). В 80,9% случаев выявлялась гипертриглицеридемия, в 64,3% – сниженное содержание холестерина липопротеинов высокой плотности (ЛВП). Абдоминальное ожирение, артериальная гипертензия и метаболический синдром отмечались у 90,5; 47,6 и 80,9% пациентов соответственно.
Немедикаментозная терапия НАЖБП включала рациональное питание со снижением общей калорийности, количества животных жиров, легкоусвояемых углеводов, увеличение физической активности с учетом состояния сердечно-сосудистой системы (ежедневные аэробные физические нагрузки длительностью не менее 40–60 мин), что обеспечивало снижение массы тела (не более 0,5–1,0 кг в неделю) [1].
Больные, в зависимости от фармакотерапии, были разделены на 3 группы:
- в 1-й (17 пациентов) применялся гепатопротектор в сочетании с эндотелиопротектором пентоксифиллином по 400 мг 3 раза/сут;
- во 2-й (10 пациентов) использовалась комбинация гепатопротектора и инсулиносенситайзера метформина с титрацией дозы до 1–2 г в сутки;
- в 3-й (n=15) медикаментозное лечение включало назначение только гепатопротектора – комбинации эссенциальных фосфолипидов и глицирризиновой кислоты (фосфоглив форте) по 1 капсуле 3 раза/сут.
Длительность терапии составила 3 мес.
Пентоксифиллин был назначен одной из групп пациентов в связи с его известным позитивным влиянием на проявления НАЖБП в виде снижения продукции провоспалительных цитокинов и уменьшения оксидативного стресса [14]. Метформин применялся для коррекции синдрома инсулинорезистентности и с учетом данных о благотворном его воздействии на течение НАЖБП [1, 15, 16]. Выбор фосфоглива в качестве гепатопротектора был связан с известной способностью фосфолипидов стабилизировать мембраны клеток, улучшать липидный и углеводный обмены, а также с антиоксидантным и противовоспалительным эффектами глицирризиновой кислоты, ее способностью ингибировать апоптоз и ограничивать некроз гепатоцитов [17].
Контрольную группу в исследовании сформировали 60 практически здоровых людей (33 мужчины, 27 женщин) в возрасте от 22 до 55 лет (средний возраст 44,84±1,30 лет), сопоставимых по возрасту, полу, этнической принадлежности.
Изучение плазменных уровней молекул суперсемейства иммуноглобулинов (молекулы адгезии эндотелия и тромбоцитов-1 – PECAM-1, VCAM- 1, ICAM-1) до и после 12 нед лечения осуществлялось методом иммуноферментного анализа с помощью наборов фирмы Bender MedSys-tems GmbH (Австрия).
Все пациенты дали информированное согласие на проведение исследования, одобренного этическим комитетом Ставропольского государственного медицинского университета.
Результаты были статистически обработаны с помощью программы IBM SPSS Statistics 24. Количественные значения с нормальным распределением представлены в виде средняя ± стандартная ошибка средней. Применялись t-критерий Стьюдента, критерий Ньюмена–Кейлса, парный t-критерий Стьюдента, коэффициент линейной корреляции Пирсона (r), критерий c2 с поправкой Йейтса на непрерывность. При проверке гипотез статистически значимыми считались различия при p ≤0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В динамике лечения НАЖБП отмечалось улучшение антропометрических показателей (уменьшение массы тела и ИМТ), состояния биохимических маркеров воспалительного процесса (АСТ, АЛТ, ГГТ, СОЭ, С-реактивного белка), снижение значений HOMA-IR, сывороточных уровней триглицеридов.
Исходно увеличенное содержание в крови всех молекул суперсемейства иммуноглобулинов в процессе лечения у пациентов статистически значимо снижалось, оставаясь сравнительно более высоким, чем у здоровых (табл. 1). На фоне лечения выявлена положительная ассоциация изменения величин ICAM-1 с динамикой показателей воспаления и уровней ферментов: ΔICAM-1 и ΔАЛТ (r=+0,39; p <0,05); ΔICAM-1 и ΔГГТ (r=+0,32; p <0,05); ΔICAM-1 и ΔСОЭ (r=+0,40; p <0,05); ΔICAM-1 и ΔС-реактивного белка (r=+0,36; p <0,05). Это свидетельствует о взаимосвязи восстановления функции эндотелия с уменьшением воспалительных изменений в печени.
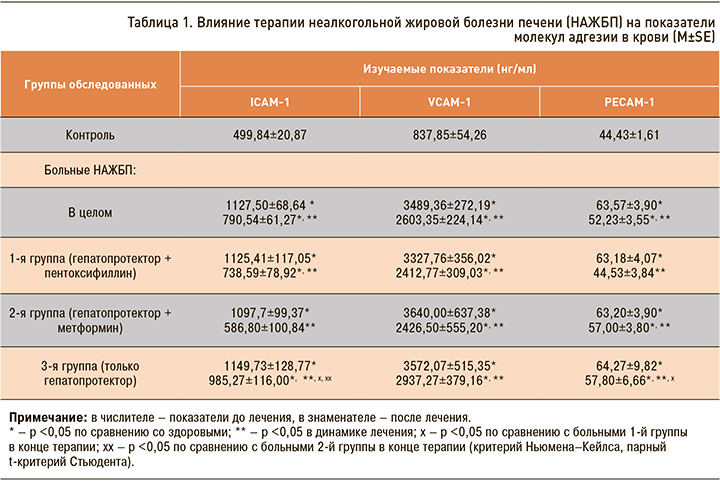
Концентрация всех адгезинов в крови снижалась в случаях применения комбинации гепатопротекторов и эндотелиопротектора (пентоксифиллина), при этом величины ICAM-1 и VCAM- 1 сохранялись повышенными, а уровни PECAM-1 в конце терапии не отличались от нормы. После лечения гепатопротекторами в сочетании с инсулиносенситайзером (метформином) наблюдалось уменьшение значений VCAM-1, PECAM-1 в крови и нормализация показателей ICAM-1. Монотерапия гепатопротектором приводила к снижению плазменного содержания всех медиаторов, не достигающему, однако, контрольных величин (см. табл. 1).
Исходная концентрация адгезинов в крови больных на фоне различных схем лечения была сопоставимой, однако через 12 нед терапии гепатопротектором значения ICAM-1 были выше, чем в случаях включения в схему эндотелиопротектора или инсулиносенситайзера. Кроме того, при назначении гепатопротектора после лечения определялось сравнительно более высокое плазменное содержание PECAM-1 по сравнению с пациентами, дополнительно получавшими пентоксифиллин (см. табл. 1).
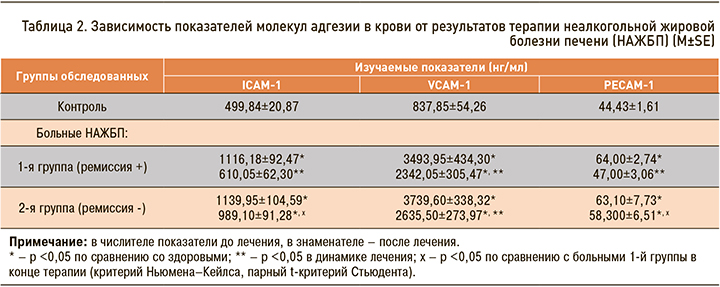
У 52,4% больных в процессе лечения достигнута биохимическая ремиссия НАЖБП: нормализация показателей АСТ (69,36±4,33 и 28,27±1,38 ед./л, p <0,05) и АЛТ (68,36±7,78 и 38,14±0,57 ед./л, p <0,05). В 47,6% случаев величины АСТ (67,60±7,81 и 53,45±4,90 ед./л, p<0,05) или АЛТ (91,80±8,44 и 74,55±6,70 ед./л, p <0,05) сохранялись повышенными, несмотря на статистически значимое снижение. Случаи биохимической ремиссии обычно наблюдались у больных 1-й (45,4%) и 2-й (36,4%) групп, а отсутствие ремиссии чаще встречалось у пациентов 3-й группы, получавших гепатопротектор (55,0%). Изолированное применение гепатопротектора было сопряжено с неудовлетворительными результатами терапии (55,0% – отсутствие и 18,2% – наличие ремиссии), тогда как эффективность комбинированных схем (81,8 и 45% ремиссии соответственно) оказалась достоверно более высокой (c2=4,7; p <0,05).
В случаях биохимической ремиссии НАЖБП статистически значимо снижались концентрации всех адгезинов в крови, при этом уровни ICAM-1 и PECAM-1 к концу 12 нед терапии нормализовались. У пациентов с отсутствием нормализации АСТ или АЛТ в динамике лечения снижалось только содержание VCAM-1, а вот значения ICAM-1 и PECAM-1 сохранялись более высокими, чем в 1-й группе пациентов (табл. 2).
При отсутствии алгоритмов ведения больных с НАЖБП и недоказанной эффективности традиционно применяемых лекарственных средств уточнение механизмов их действия представляет интерес для поиска новых путей лечения.
В случаях достижения биохимической ремиссии НАЖБП содержание ICAM-1, PECAM-1 в крови, по нашим данным, нормализовалось, VCAM-1 – снижалось; при недостаточном ответе на лечение уменьшались лишь значения VCAM-1. Комбинация гепатопротектора с эндотелиопротектором или инсулиносенситайзером приводила к нормализации PECAM-1 или ICAM-1 в крови, чего не наблюдалось при монотерапии гепатопротектором. Указанные изменения молекул адгезии в динамике терапии характеризуют опосредованность эффектов препаратов воздействием на оксидативный стресс и эндотелиальную дисфункцию. Динамика медиаторов функции эндотелия была взаимосвязана с улучшением антропометрических параметров, снижением массы жировой ткани, в том числе висцерального ее пула. Возможно, в основе позитивного влияния терапии лежит возрастание уровней адипонектина [15], способного подавлять эндотелиальную экспрессию Е-селектина, ICAM-1 и VCAM-1 [18].
Благоприятное влияние пентоксифиллина и метформина на печеночное воспаление при НАЖБП [14, 16] могло быть обусловлено угнетением секреции молекул адгезии. Ранее на фоне приема пентоксифиллина было отмечено снижение плазменных уровней ICAM-1, VCAM-1 при ишемической болезни сердца [19], уменьшение экспрессии ICAM-1 в легочной ткани, а в культуре эндотелиальных клеток наблюдалось подавление ФНО-a-индуцированной экспрессии VCAM-1 [20]. Метформин уменьшал содержание ICAM-1, VCAM-1 в крови у больных сахарным диабетом 2 типа [21] и снижал сывороточные уровни ICAM-1, Е-селектина, ФНО-a, интерлейкина-6 при синдроме поликистозных яичников [22].
Противовоспалительные и антиангиогенные эффекты пентоксифиллина и метформина были связаны с ингибированием продукции ФНО-a, ядерного фактора-κВ, интерлейкина-8 и реактивных форм кислорода, со снижением перекисного окисления липидов [3, 23], а влияние метформина на адгезины могло быть обусловлено коррекцией уровня гликемии и стимуляцией высвобождения оксида азота [24].
Реверсия воспаления при НАЖБП на фоне приема препаратов глицирризиновой кислоты может осуществляться путем угнетения экспрессии ФНО-a, ICAM-1, Р-селектина и циклооксигеназы-2, опосредованного подавлением экспрессии ядерного фактора-κВ [17, 25, 26], а в модели псориаза эти препараты были способны снижать клеточные уровни ICAM-1 и угнетать адгезию моноцитов к кератиноцитам [27]. В случаях метотрексат-индуцированного энтерита на фоне приема глицирризиновой кислоты происходило снижение уровней провоспалительных цитокинов и экспрессии гена ICAM-1 [28]. Содержание мРНК и белков ICAM-1, VCAM-1 в легких снижалось на фоне эндотоксемии при применении глицирризиновой кислоты [29].
Позитивные сдвиги молекул адгезии в ходе применения пентоксифиллина или (при наличии инсулинорезистентности) метформина сопровождаются выраженными противовоспалительными эффектами, улучшают состояние печени, что может служить обоснованием их включения в схемы терапии НАЖБП.
ЗАКЛЮЧЕНИЕ
- На фоне терапии НАЖБП отмечается позитивная динамика растворимых молекул адгезии, более выраженная в случаях использования комбинированных схем лечения (сочетания гепатопротектора с эндотелиопротектором или инсулиносенситайзером).
- Достижение биохимической ремиссии НАЖБП характеризуется нормализацией показателей большинства адгезинов. При отсутствии ремиссии наблюдается лишь снижение содержания VCAM-1 в крови.



