ВВЕДЕНИЕ
Болезнь Крона (БК) и язвенный колит (ЯК) относятся к хроническим воспалительным, иммунологически опосредованным заболеваниям, характеризующимся рецидивирующим активным воспалением пищеварительного тракта. Воспалительные заболевания кишечника (ВЗК) могут сопровождаться внекишечными расстройствами, которые диагностируются до, одновременно или после постановки основного диагноза. [1]. Внекишечные проявления, как правило, вносят значительный вклад в заболеваемость и снижение качества жизни пациентов [2, 3].
Согласно последним исследованиям, пациенты с ВЗК имеют повышенный риск развития сердечно-сосудистых заболеваний (ССЗ) [4], остающихся основной причиной заболеваемости и смертности во всем мире [5, 6].
В настоящее время в ряде исследований сообщается о сочетанном течении атеросклероза и ВЗК, развитии атриовентрикулярной блокады, перикардита, амилоидоза сердца, дилатационной кардиомиопатии и эндомиокардиального фиброза, ишемической болезни (ИБС) сердца у больных ВЗК, о наличии васкулита и артериита Такаясу при БК [7].
ВЗК чаще всего начинаются в раннем возрасте; такие пациенты обычно не имеют классических факторов риска кардиоваскулярной патологии в виде артериальной гипертонии, ожирения, дислипидемии, сахарного диабета 2-го типа. Тем не менее ВЗК и ССЗ характеризуются хроническим воспалением и сходным патогенезом [8].
ПАТОГЕНЕТИЧЕСКИЕ ВЗАИМОСВЯЗИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА
Было предложено несколько потенциальных механизмов для объяснения повышенного сердечно-сосудистого риска у пациентов с ВЗК, среди которых наиболее важным считается нарушение регуляции иммунной системы наряду с тромбоцитарной и эндотелиальной дисфункцией [9]. Во всех возрастных группах у пациентов с ВЗК имеются функциональные сосудистые изменения, свидетельствующие об эндотелиальной дисфункции, даже до появления структурных изменений атеросклероза [10–12].
Эндотелий – это однослойный эпителий, выстилающий внутреннюю поверхность сосудов. Он продуцирует ряд медиаторов, регулирующих сосудистый гомеостаз, а именно оксид азота (NO), простациклин, эндотелин, фактор Виллебранда и молекулы клеточной адгезии. К дисфункции эндотелия при ВЗК приводит повышенный уровень провоспалительных цитокинов (интерлейкина 1, интерлейкина 6, фактора некроза опухоли-альфа) и окислительный стресс [13]. Фактор некроза опухоли-альфа и интерлейкин 6 усиливают воспаление в эндотелиальных клетках путем увеличения экспрессии молекулы клеточной адгезии, приводят к апоптозу эндотелиальных клеток, микро- и макрососудистой дисфункции, а также уменьшают эндотелиально-зависимую вазодилатацию и повышают протромботическое состояние [14]. Повреждение эндотелиального слоя сопровождается повышением уровня десквамированных эндотелиоцитов (ДЭЦ), васкулоэндотелиального фактора роста (ВЭФР) плазмы крови [15] и макроальбумина (МАУ) в моче. Существует корреляция между уровнем маркеров эндотелиальной дисфункции и активностью воспалительного процесса при ВЗК [16].
Известно, что у пациентов с ВЗК наблюдаются увеличенная толщина интимы и аномальная жесткость сонных артерий, которые служат суррогатными маркерами атеросклероза [17, 18]. Так, в работе Theocharidou E. et al. в 2014 г. были установлены особенности, касающиеся величины толщины комплекса интима-медиа сонных артерий (cIMT; показатель риска сердечно-сосудистых заболеваний) у 42 пациентов с ВЗК (26 с БК и 16 с ЯК), имевших ССЗ и диабет. Величина cIMT была значительно выше у пациентов с ВЗК по сравнению с 42 здоровыми лицами (0,62±0,08 против 0,52±0,06 мм; p <0,0005). Не отмечалось отличий в значении cIMT между пациентами с БК и ЯК или между группами с различной активностью заболевания и лечением [19].
В работе Roifman I. et al. было обследовано 98 пациентов, в том числе 48 с ВЗК (17 с ЯК + 31 с БК), и 50 здоровых человек из контрольной группы. Функцию эндотелия в обеих группах оценивали с помощью пульсовой артериальной тонометрии (ПАТ) и ультразвукового исследования плечевого сустава для определения дилатации, опосредованной потоком, и реактивной гиперемии при сдвиговом напряжении. Согласно полученным результатам, у пациентов с ВЗК микрососудистая эндотелиальная дисфункция была с более низкими индексами ПAT (р <0,01) и реактивной гиперемией при сдвиговом напряжении (р <0,05) по сравнению с контролем [10].
Другим независимым предиктором ССЗ является гомоцистеин [20]. Он представляет собой метаболит метионина и цистеина, который вызывает окислительный стресс, способствует перекисному окислению липидов, индуцирует выработку воспалительных факторов и противодействует сосудорасширяющим свойствам оксида азота за счет образования S-нитрозогомоцистеина, что приводит к дисфункции эндотелия [21]. В ряде исследований продемонстрировано, что у больных ВЗК уровень гомоцистеина значительно выше по сравнению с контрольной группой [22, 23].
Известно также, что ВЗК ассоциированы с гиперкоагуляцией [24, 25]. Феномен гиперкоагуляции связывают с тромбоцитозом, увеличением факторов свертывания V, VIII, фибриногена, cнижением антитромбина III. Вследствие этого развивается дисбаланс свертывающей системы крови, что значительно повышает риск развития тромбоэмболических катастроф [26–28]. Более того, у пациентов с ВЗК по сравнению с общей популяцией в 2–3 раза выше вероятность венозной тромбоэмболии, особенно в период высокой активности ВЗК [29].
Первые данные о частоте венозной тромбоэмболии (ВТЭ) у пациентов с ВЗК были представлены в UMIBDED (базе данных эпидемиологии ВЗК Университета Manitoba). Так, при БК частота тромбоэмболии глубоких вен (ТГВ) составила 31,4 на 10 000 человеко-лет, а легочной эмболии (ТЭЛА) – 10,3 на 10 000 человеко-лет. При ЯК встречаемость ТГВ равнялась 30,0 на 10 000 человеко-лет, а ТЭЛА – 19,8 на 10 000 человеко-лет. IRR (коэффициент заболеваемости) при БК составил 4,7 (95% доверительный интервал (ДИ): 3,5–6,3) для ТГВ и 2,9 (95% ДИ: 1,8–4,7) для ТЭЛА. При ЯК тот же показатель равнялся 2,8 (95% ДИ, 2,1–3,7) для ТГВ и 3,6 (95% ДИ, 2,5–5,2) для ТЭЛА. Самый высокий IRR для этих событий был среди пациентов моложе 40 лет, а это означает, что молодые люди с ВЗК имеют еще более высокий риск ТГВ и ТЭЛА, чем их здоровые сверстники [30].
В систематическом обзоре и метаанализе Singh S. et al. также сообщили о высоком риске развития сердечно-сосудистых катастроф у лиц с ВЗК (отношение шансов (ОШ) 1,18; 95% ДИ: 1,09–1,27). В данном исследовании у пациентов с ВЗК в возрасте <40–50 лет риск инсульта был в 4 раза выше по сравнению с пожилыми людьми без ВЗК [31, 32]. Наряду с этим исследователи отметили, что женщины с ЯК и БК, несмотря на меньшее анатомическое поражение коронарных артерий, имеют значительно более высокий избыточный риск ССЗ по сравнению с мужчинами того же возраста. Применение оральных контрацептивов может выступать дополнительным прокоагулянтным фактором, увеличивающим вероятность тромботических сердечно-сосудистых катастроф у женщин [33, 34].
Метаанализ 10 исследований с включением 155 970 больных ВЗК продемонстрировал повышенный риск ИБС у лиц моложе 50 лет по сравнению с сопоставимой по возрасту контрольной группой. При этом данный риск оказался более выражен у женщин, чем у мужчин [35].
Также наблюдения последних лет показали, что воспалительная активность ВЗК связана с увеличением риска развития ССЗ [36]. В популяционном когортном исследовании сообщалось о повышенной угрозе инфаркта миокарда в период высокой активности ВЗК [37, 38].
Ученые из Дании в своем исследовании сравнили возникновение традиционных и нетрадиционных сердечно-сосудистых факторов риска у пациентов с ВЗК и среди населения в целом. В исследование было включено 108 789 человек, из которых 1203 имели диагноз ВЗК (347 – БК, 856 – ЯК). Кардиоваскулярные заболевания чаще диагностировались в популяции с ВЗК, чем в общей популяции (13,2 и 10,9% соответственно), хотя распространенность классических сердечно-сосудистых факторов риска в первом случае была ниже. У пациентов с ВЗК отмечались более низкие уровни общего холестерина и холестерина липопротеидов низкой плотности (ЛПНП), а также более высокие концентрации С-реактивного белка и фибриногена, нежели в общей популяции. Это исследование подтверждает, что более высокая распространенность ССЗ при ВЗК, по сравнению с общей популяцией, может быть ассоциирована с хроническим воспалением [39].
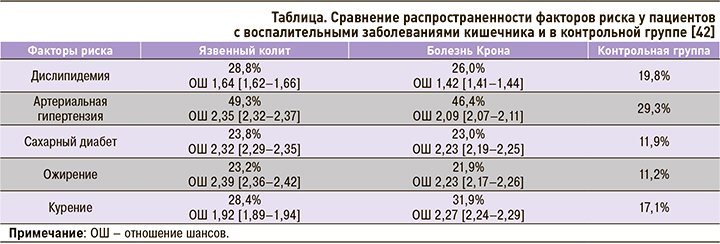
В другом крупном метаанализе (29 млн пациентов с ВЗК) было отмечено, что распространенность инфаркта миокарда (ИМ) у пациентов с ВЗК была выше по сравнению с контрольной группой, лиц без ВЗК, сопоставимых по полу и возрасту. Более того, как при ЯК, так и БК, ИМ чаще встречался именно у молодых пациентов: ОШ в группе 30–34 лет составило 12,05 (95% ДИ: 1,16–13,01), у пациентов 65+ лет – 2,08 (95% ДИ: 2,04–2,11). При этом развитие ИМ у молодых лиц с ВЗК ассоциировалось с наличием его классических факторов риска: сахарного диабета, дислипидемии, артериальной гипертензии, ожирения и курения, которые также регистрировались чаще у лиц с ЯК или БК по сравнению с контрольной группой [40, 41].
Обобщенные данные о факторах риска ССЗ у пациентов с ВЗК и без них (контроль) представлены в таблице.
ЗАКЛЮЧЕНИЕ
Таким образом, можно сделать вывод о том, что ВЗК облигатно ассоциируются с повышенным риском ССЗ и сердечно-сосудистой смертности, в особенности у женщин и молодых людей до 50 лет. Прослеживается взаимосвязь патогенеза кардиоваскулярной патологии с ВЗК и активностью последних. Системное воспаление у больных ВЗК приводит к окислительному стрессу и повышению цитокинов, молекул клеточной адгезии, гомоцистеина, что, в свою очередь, вызывает эндотелиальную дисфункцию и запускает атеросклероз. Кроме того, гиперкоагуляция в системе коагуляционного гемостаза, а также гипертромбоцитопения, особенно в фазу активности (атаки) ВЗК, зачастую становятся причиной тромбоэмболических событий среди данной когорты пациентов. ВЗК следует рассматривать как относительно модифицируемый фактор риска ССЗ в случае выбора и проведения своевременной и эффективной базисной (противовоспалительной) терапии.



