ВВЕДЕНИЕ
1,5 млрд человек во всем мире страдают хроническими диффузными заболеваниями печени. Ежегодно примерно 1 млн смертей происходит из-за осложнений цирроза печени (ЦП), что делает его 11-й по частоте причиной смерти в мире [1]. ЦП – заболевание, при котором развивается диффузное разрастание соединительной ткани с образованием узлов регенерации, возникающих в результате некроза гепатоцитов, что нарушает дольчатую структуру органа. ЦП является результатом прогрессирования хронического гепатита, поэтому имеет такие же причины и патогенез, хотя у различных нозологических форм гепатита есть свои особенности в скорости прогрессирования, клинической картине и прогнозе [2–4].
КЛАССИФИКАЦИЯ ЦИРРОЗА ПЕЧЕНИ
1. Морфологическая классификация ЦП, предложенная Всемирной ассоциацией гепатологов (Акапулько, 1974) и Всемирной организацией здравоохранения (1978):
- • мелкоузловой, или мелконодулярный цирроз: диаметр узлов от 1 до 3 мм (обычно алкогольной этиологии);
- • крупноузловой, или макронодулярный цирроз: диаметр узлов более 3 мм (обычно постнекротический – при активном гепатите, лекарственных поражениях, аутоиммунных заболеваниях, болезни Вильсона–Коновалова и др.);
- • неполная септальная форма (нечеткие черты регенерации в узлах, участки портальных трактов связываются тонкими фиброзными перегородками – септами).
2. Этиологическая классификация ЦП:
- • вирусный, алкогольный, лекарственный, первичный билиарный, вторичный билиарный;
- • врожденный, наблюдающийся при следующих заболеваниях: гепатолентикулярная дегенерация (болезнь Вильсона–Коновалова), гемохроматоз, дефицит α1-антитрипсина, тирозиноз, галактоземия, гликогенозы;
- • застойный (недостаточность кровообращения), болезнь и синдром Бадда–Киари;
- • обменно-алиментарный, возникающий при следующих состояниях: ожирение/метаболический синдром, наложение обходного тонкокишечного анастомоза, тяжелые формы сахарного диабета;
- • индийский детский, цирроз печени неясной этиологии (криптогенный).
3. Степень активности ЦП (выраженность цитолиза биохимически, морфологически).
4. Стадия: компенсации, декомпенсации ЦП (с уточнением от 0 до 6 ст.).
5. Класс тяжести ЦП по Чайльд–Пью (А, B, C).
6. Осложнения: асцит, варикозное расширение вен пищевода, кровотечение, печеночная энцефалопатия, инфекция, гиперспленизм и др.
7. Оценка прогноза ЦП и его осложнений (по шкалам MELD, Gahs, Lille и др.) [2–13].
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина и течение ЦП определяются, как правило, этиологическими факторами, активностью печеночного процесса и включают клинические проявления предшествующего хронического поражения печени. В 40% случаев ЦП носит субклинический характер. Первым симптомом может быть даже такое фатальное осложнение, как массивное пищеводно-желудочное кровотечение из варикозных анастомозов объемом до 1 л. До 30% пациентов обращаются за медицинской помощью поздно из-за того, что заболевание клинически «начинается» с незначительных симптомов. При ЦП, помимо печеночных синдромов, встречающихся при хроническом гепатите (ХГ), ключевым клиническим синдромом выступает портальная гипертензия (ПГ) [3–5, 7, 9, 10–12, 14].
ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЦИРРОЗА ПЕЧЕНИ
1. Опрос и физикальное обследование: перкуссия, пальпация печени и селезенки – постепенное уменьшение печени при переходе хронического гепатита в ЦП, увеличение селезенки, «печеночные знаки» при осмотре.
2. Лабораторные функциональные пробы печени: маркеры цитолиза, холестаза, гепатоцеллюлярной недостаточности, активности воспаления, тесты гемостаза, оценка функции почек.
3. Сывороточные маркеры фиброза 4 стадии: гиалуроновая кислота более 200 нг/мл, Фибротест, соотношение АСТ/АЛТ более 1 (кроме алкогольного гепатита), показатель APRI более 1,5.
4. Эластометрия – плотность печени более 12 кПа.
5. Портальная гипертензия по данным ультразвукового исследования (УЗИ): увеличение воротной и селезеночной вен, спленомегалия, диффузно неравномерное повышение эхогенности печени. Асцит выявляется методами визуализации при наличии более 1,5 л жидкости в брюшной полости.
6. Определение дополнительных показателей для установления этиологии ЦП: для исключения болезни Вильсона–Коновалова у молодых людей с ЦП – церуллоплазмин, медь в крови, кольцо Кайзера–Флейшнера на роговице, для диагностики гемохроматоза – уровни железа и ферритина в крови, при метаболическом синдроме – липидный спектр, а также прочие дополнительные тесты для выявления других причин ЦП.
7. Биопсия для уточнения тяжести поражения и этиологии заболевания возможна на компенсированной стадии ЦП (противопоказана при тяжелой портальной гипертензии, геморрагическом синдроме).
8. Компьютерная томография (КТ) позволяет выявить изменение размеров печени, спленомегалию, асцит [2–5, 7, 9–12].
Портальная гипертензия
В результате развития соединительной ткани, узлов-регенератов и перестройки сосудистой архитектоники печени развиваются портокавальные анастомозы. Портальная гипертензия (ПГ) – это клинический симптомокомплекс, гемодинамически проявляющийся патологическим повышением портального градиента давления (разности давления в воротной и нижней полой вене), что сопровождается формированием портосистемных коллатералей, через которые происходит сброс крови из портальной вены в обход печени. В норме портальный градиент давления составляет 1–5 мм рт. ст. Клинически значимой ПГ становится при значениях этого показателя выше 10 мм рт.ст. Наибольшее клиническое значение при ПГ имеют портокавальные анастомозы пищевода.
Признаки ПГ включают спленомегалию, асцит. При массивном асците наблюдаются одышка, олигурия, варикозные коллатерали на передней и боковой поверхностях брюшной стенки – «голова медузы» (воротная вена с верхней полой веной за счет реканализации пупочной вены). По данным ультразвукового исследования (УЗИ)/допплерографии обнаруживаются расширение диаметра воротной и селезеночной вен, наличие асцита. В норме портальное давление находится в диапазоне 5–10 мм рт.ст. (или 10–15 мм вод. ст.). Градиент венозного давления в печени (разница в венозном давлении между поступающей и эфферентной кровью в печень) также определяет тяжесть ЦП, хотя его трудно измерить. Значение 16 мм и более означает значительно повышенный риск смерти [2–5, 7, 8, 13].
Большое значение в диагностике ПГ имеют фиброэзофагогастродуоденоскопия (ФГДС) и ректороманоскопия для выявления варикозных коллатералей.
СТАДИИ ЦИРРОЗА ПЕЧЕНИ
К клиническим особенностям компенсированного ЦП относятся сосудистые «звездочки» (паутинные невусы/ангиома), ладонная эритема, контрактура Дюпютрена (склероз ладонного апоневроза, стягивание ладони начинается на безымянном пальце), хлопающий тремор рук (за счет интоксикации ЦНС), гинекомастия, атрофия яичек/гипогонадизм. Сосудистые «звездочки», ладонная эритема, гинекомастия могут появиться и на стадии хронического гепатита. Сосудистые «звездочки» также встречаются и при других состояниях, например при беременности, гиповитаминозах, аутоиммунных заболеваниях, сахарном диабете и др. При компенсированном ЦП медиана выживаемости достигает 12 лет.
Клинические проявления при прогрессировании ЦП: при переходе хронического гепатита в ЦП гепатомегалия постепенно уменьшается, размеры печени могут быть меньше нормы. Боли при ЦП часто отсутствуют. При этом нарастают спленомегалия и синдром гиперспленизма (уменьшение количества лейкоцитов, тромбоцитов и эритроцитов в периферической крови). Обычно прогрессируют и нарушения функциональных проб печени: синдром цитолиза, холестаза, гепатоцеллюлярная недостаточность (снижение альбумина, холинэстеразы, факторов протромбинового комплекса и т.д.). Повышается активность воспаления за счет воздействия эндогенных токсинов на печень и селезенку, вследствие чего у пациентов отмечаются гипергаммаглобулинемия, повышенная скорость оседания эритроцитов (СОЭ).
Проявления декомпенсации при ЦП включают такие осложнения, как пищеводно-желудочное и/ или желудочно-кишечное кровотечение, печеночная энцефалопатия, желтуха или асцит. У пациентов с ранее стабильным ЦП декомпенсация может возникать из-за различных причин, таких как запор, инфекция, повышенное потребление алкоголя, лекарств, кровотечение из варикозно расширенных вен пищевода или обезвоживание. Переход от компенсированного процесса при ЦП к декомпенсированному обычно занимает 5–7 лет. Декомпенсированный ЦП – это системная патология с дисфункцией многих органов и систем. Декомпенсация ЦП при адекватной терапии может быть обратима. Медиана выживаемости при этой стадии заболевания составляет 2 года.
Терминальный ЦП характеризуется тяжелыми/рефрактерными осложнениями, в том числе повторными острыми эпизодами энцефалопатии, максимальной выраженностью других синдромов и осложнений, закономерно ведущим к летальному исходу без радикального лечения в виде трансплантации печени, хотя в терминальной стадии прогноз трансплантации ухудшается [3–6, 8].
КЛАССИФИКАЦИЯ СТАДИЙ КЛИНИЧЕСКОГО ТЕЧЕНИЯ ЦИРРОЗА ПЕЧЕНИ
Стадия 0: нет варикозно измененных вен/узлов, мягкая ПГ. Плотность печени при эластографии – 15–20, или градиент печеночного венозного давления 5–10 мм рт.ст.
Стадия 0 представляет собой компенсированный ЦП.
Стадия 1: нет варикоза. Плотность печени ≥20, или градиент печеночного венозного давления ≥10 мм рт.ст.
Стадия 2: варикоз (клинически значимая портальная гипертензия при возникновении клинических проявлений заболевания или превышении градиентом портального давления значения 10 мм рт.ст.).
Стадия 3: кровотечение.
Стадия 4: впервые возникшая декомпенсация (печеночная энцефалопатия), не связанная с кровотечением.
Стадия 5: проявления повторной декомпенсации (ПЭ).
Стадии 3–5 представляют собой декомпенсированный ЦП.
Стадия 6 – терминальный ЦП: поздняя декомпенсация, рефрактерный асцит, желтуха, инфекции, дисфункция почек (гепаторенальный синдром) или других органов (гепато-пульмональный синдром) [4, 6, 8].
ОСЛОЖНЕНИЯ ЦИРРОЗА ПЕЧЕНИ: АСЦИТ
Патогенез асцита: повышенное синусоидальное гидростатическое давление и застой в воротной вене (ПГ), гипоальбуминемия (снижение онкотического давления плазмы), гиперальдостеронизм (нарушение инактивации альдостерона в печени) ведут к задержке жидкости в брюшной полости. Развитие асцита при ЦП ассоциируется с плохим прогнозом: летальность в течение 1 года достигает 40%, в течение 2 лет – 50% [2–4, 14].
Диагностика асцита
1. Выявление свободной жидкости физикальными и инструментальными методами (УЗИ, КТ).
2. При большом количестве асцитической жидкости появляются дополнительные симптомы: пупочная, паховая грыжа, варикозное расширение вен и отек ног, смещение сердца и набухание яремных вен, плевральный выпот.
3. Лабораторное исследование асцитической жидкости при ЦП: стерильный транссудат, относительная плотность <1015, содержание белка <25 г/л. Количество лейкоцитов <500 в 1 мкл (преобладание лимфоцитов и небольшое количество нейтрофилов).
Степени асцита: 1-я – жидкость в брюшной полости определяется только при УЗИ; 2-я – симметричное увеличение живота; 3-я – напряженный асцит (до ≥10 л), приводящий к сдавлению сосудов и органов брюшной полости, выраженным отекам ног.
Диагностические критерии рефрактерного асцита: отсутствие эффекта от диуретиков на фоне интенсивной диуретической терапии (спиронолактон 400 мг/сут и фуросемид 160 мг/сут) не менее 1 нед и диеты с ограничением соли (90 ммоль/сут); отсутствие ответа на терапию – снижение веса менее 0,8 кг за 4 дня и потребление натрия больше его выделения; рецидив асцита после лечения – повторное появление 2-й или 3-й стадии асцита в течение 4 нед после его исчезновения.
Рефрактерный асцит свидетельствует о плохом прогнозе: выживаемость в течение 1 года составляет 50%, медиана выживаемости – 6 мес. Диагноз рефрактерного асцита основывается на ответе на мочегонные средства и ограничение соли у стабильных пациентов без осложнений в виде кровотечения и инфекции. Пациенты с этим осложнением рассматриваются как кандидаты на трансплантацию печени.
Лечение асцита
1. Ограничение приема жидкости (диурез за предыдущий день + 300–500 мл).
2. Спиронолактон – 150–200 мг/сут с уменьшением дозы до поддерживающей (100 мг/сут) в течение месяцев и лет.
3. При недостаточном эффекте – фуросемид 40–80 мг/сут.
4. Парацентез брюшной полости (2–3 л/сут) с одновременным внутривенным введением 10 г альбумина внутривенно на 1 л удаленной жидкости. Противопоказания к парацентезу – инфекция, кровотечение, печеночная кома.
5. Постановка венозных портокавальных шунтов (при этом увеличивается печеночная энцефалопатия) [2–7, 14].
ОСЛОЖНЕНИЯ ЦИРРОЗА ПЕЧЕНИ: ПЕЧЕНОЧНАЯ ЭНЦЕФАЛОПАТИЯ
Печеночная энцефалопатия (ПЭ) связана со снижением детоксикационной функции печени и шунтированием крови в полые вены. Она развивается на фоне различных печеночных синдромов, в том числе печеночно-клеточной недостаточности, которая проявляется желтухой, геморрагическим синдромом на коже, кровотечениями из слизистых оболочек, «запахом печени» изо рта (источник – продукты интоксикации), сонливостью, потерей памяти, отеком конечностей (из-за снижения онкотического давления крови и снижения альбумина ниже 30 г/л). После появления клинически выраженной ПЭ в течение 1 года выживает 42% больных, а в течение 3 лет – всего 23% [2–5, 7, 15].
Лабораторные признаки ПЭ: снижение альбумина, продукции факторов свертывания крови (протромбинового комплекса); снижение синтеза холестерина, холинэстеразы, гипогликемия.
ПЭ проявляется дезориентацией во времени и пространстве, нарушениями способности к счету, почерка, расстройством сна (дневная сонливость, ночная бессонница), тремором, психозом. В итоге может развиться кома.
Стадии ПЭ приведены в таблице 1.
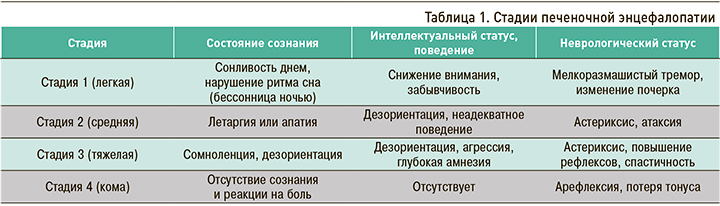
К факторам, способствующим развитию ПЭ у пациентов с ЦП, относятся нарушения электролитного баланса (прием диуретиков, рвота, диарея) – до 25–30% случаев; кровотечение (из варикозного расширения вен пищевода, желудка, язвы желудка) – 25–30%; применение седативных средств, наркотических анальгетиков, азотсодержащих препаратов (10–15%); прием мочегонных салуретиков, алкоголя (18%); инфекции (спонтанный бактериальный перитонит, инфекции мочевыводящих путей, бронхолегочные инфекции), лихорадка, операции, запор (10–18%); употребление богатой белком пищи (7–10%); азотемия (гепаторенальный синдром; 25–30%). Нередко к ПЭ приводит сочетание нескольких факторов.
Лечение ПЭ
1. Устранение провоцирующих факторов.
2. Диета. Белок в рационе больного ПЭ должен быть представлен преимущественно протеинами растительного происхождения и лактальбумином ввиду их лучшей переносимости. Для предотвращения процессов катаболизма количество поступающего белка должно быть не менее 60 г/сут (на 2–3-й стадиях ПЭ). После ликвидации признаков ПЭ суточное количество белка должно быть не менее тех же 60 г/сут (на 2–3-й стадиях ПЭ) с последующим увеличением до 80–100 г (1–1,5 г/ кг массы тела). Калорийность пищи (1800–2500 ккал/сут) обеспечивается адекватным поступлением жиров (70–140 г) и углеводов (280–325 г).
3. Санация кишечника для снижения образования и всасывания аммиака и других токсинов, образующихся в кишечнике: уменьшение пищевых белков, изменение микрофлоры кишечника (антибиотики, пробиотики и пребиотики – хилак-форте), опорожнение кишечника (клизмы).
4. Дезинтоксикационная терапия (уменьшение образования и связывание аммиака в кишечнике): с этой целью применяются лактулоза (по 20–30 г в течение 7–14 дней с последующим переходом на индивидуальную дозировку), орнитин и др. Отметим, что лактулоза также обладает эффектом пребиотика.
5. Переливание альбумина.
6. При необходимости переливание свежезамороженной плазмы (с активированными факторами свертывания).
7. Радикальное лечение – трансплантация печени [2–5, 7, 15].
ОСЛОЖНЕНИЯ ЦИРРОЗА ПЕЧЕНИ: КРОВОТЕЧЕНИЕ ИЗ ВАРИКОЗНЫХ ПИЩЕВОДНО-ЖЕЛУДОЧНЫХ ВЕН
Кровотечение из варикозно расширенных вен пищевода (ВРВП) и желудка – критическое состояние, при котором в последующие 6 нед умирает более 20% больных. У 30% пациентов с вирусным ЦП ВРВП формируются в течение 5 лет, при алкогольном циррозе – в 50% случаев за 2 года. Кровотечения из ВРВП и варикозно расширенных вен желудка, как правило, массивные (до 1 л и более), поэтому их клинические проявления достаточно яркие; они складываются из общих симптомов, свойственных любой кровопотере (резкая слабость, головокружение, потеря сознания, выраженная бледность кожных покровов, частый пульс слабого наполнения и напряжения, снижение артериального давления и т.д.), и симптомов, характерных для кровотечения в просвет ЖКТ: рвоты свежей или реже видоизмененной кровью («кофейная гуща») и черного дегтеобразного стула (мелена). Оценка центрального венозного давления, дефицита объема циркулирующей крови, диуреза, измерение артериального давления и подсчет частоты сердечных сокращений, а также лабораторные показатели позволяют получить очень важные объективные данные о степени тяжести кровотечения [2–5, 7].
Типы желудочного варикоза и риск кровотечений при каждом из них отражены в таблице 2.

Ведение больных с продолжающимся кровотечением: 10–15% пациентов имеют продолжающееся кровотечение или раннее повторяющееся кровотечение, несмотря на лечение вазоактивными препаратами (пропранолол) и перевязки варикозно расширенных вен. Трансюгулярное внутрипеченочное портосистемное стентирование (TIPS) представляет собой эндоваскулярную операцию по созданию искусственного канала в печени, который обеспечивает отток крови из воротной вены в нижнюю полую вену, минуя пораженную печеночную ткань. Оно должно использоваться как средство спасения при продолжающемся или раннем рецидивирующем кровотечении. В качестве временной меры возможно применение баллонной тампонады пищеводно-желудочных вен до 24 ч. Для профилактики ПЭ, часто развивающейся при кровотечениях, назначают лактулозу.
Консервативное лечение
1. Возмещение объема циркулирующей крови: цельная кровь, препараты крови, кровезаменители, сбалансированные солевые растворы.
2. Снижение портального давления, печеночного кровотока и градиента венозного давления при варикозном расширении вен: терлипрессин (аналог вазопрессина) и октреотид (аналог соматостатина), возможен прием бета-адреноблокатора пропранолола (помимо снижения портального давления, вызывает системный гипотензивный эффект), нитратов (нитроглицерина, изосорбида мононитрата). Бета-адреноблокаторы и нитраты могут использоваться для предотвращения кровотечения из варикозного расширения вен пищевода желудка.
3. Повышение свертываемости крови: менадиона натрия бисульфит внутримышечно, глюконат кальция внутривенно, этамзилат, фибриноген (2–4 г), свежезамороженная плазма (400–1000 мл).
4. Коррекция функционального состояния печени: витамины группы В, АТФ, концентрированные растворы глюкозы, антиоксиданты, гепатопротекторы.
После достижения гемостаза у пациентов с ЦП проводится детоксикация организма для устранения гепатогенной энцефалопатии.
Хирургическое лечение пищеводно-желудочного кровотечения: рекомендуемым методом гемостаза служит эндоскопическое лигирование вен пищевода, при невозможности его выполнения может быть использована эндоскопическая склеротерапия. Также применяется сочетание лигирования и тромбирования варикозных вен пищевода [2–5, 7].
ДРУГИЕ ОСЛОЖНЕНИЯ ЦИРРОЗА ПЕЧЕНИ
Портальная гипертоническая гастропатия
Представляет собой изменения слизистой оболочки желудка у пациентов с ПГ. Эти изменения включают рыхлость слизистой оболочки и наличие эктазированных кровеносных сосудов на поверхности; они могут приводить к желудочному кровотечению, хотя значительно менее выраженному, чем при разрыве ВРВП (Ж-13).
Инфекционные осложнения
Риск бактериальных инфекций у больных ЦП связан со многими факторами: снижением функции эндотелия и макрофагов (биологический фильтр крови) печени по удалению из кровотока микроорганизмов, портосистемным шунтированием (проникновение бактерий из кишечника), дисфункцией кишечника (дисбактериоз), ассоциированной с циррозом иммунной дисфункцией, генетическими факторами [2–4, 14].
Спонтанный бактериальный перитонит (СБП) – бактериальная инфекция в асцитической жидкости без интраабдоминального хирургически леченого источника инфекции. Пациенты с ЦП и асцитом вне больницы имеют риск СБП 1,5– 3,5%, при нахождении в стационаре он развивается у 10% госпитализированных. Смертность при выраженном СБП превышает 90%, но снижается до 20% при ранней его диагностике и лечении. Продолжительность жизни пациентов после эпизода СБП составляет 1 год в 30–50% случаев и 2 года – в 25–30%. К симптомам перитонита относятся абдоминальная боль, болезненность при пальпации, рвота или диарея, кишечная непроходимость, к симптомам воспаления – гипер- или гипотермия, озноб, изменение/повышение количества лейкоцитов. При СБП возможно ухудшение печеночных функциональных проб, печеночная энцефалопатия, шок, ухудшение функции почек, желудочно-кишечное кровотечение. В то же время СБП может быть и асимптомным, особенно у амбулаторных пациентов.
Диагностика СБП: микроскопия асцитической жидкости – нейтрофилы, бактериологический посев положительный. Диагностика основана на лапароцентезе. Диагностический парацентез для исключения СБП должен быть выполнен пациентам с асцитом при госпитализации, больным с желудочно-кишечным кровотечением, шоком, лихорадкой или другими признаками системного воспаления, ухудшением печеночной/почечной функции, печеночной энцефалопатией. СБП диагностируют при количестве нейтрофилов в асцитической жидкости более 500 в 1 мкл, которое определяют при микроскопии или проточной цитометрии. Глюкоза – соотношение в сыворотке и асцитической жидкости более 1, лактатдегирогеназа (ЛДГ) – более 225 Ед/л, лактат – более 4,5 ммоль/л. Положительная культура асцитической жидкости не является предпосылкой для диагноза СБП.
Лечение СБП: антибактериальная терапия (меропенем 1 г/8 ч внутривенно в сочетании с гликопептидом). Эффективность антибиотикотерапии определяют по исчезновению клинической симптоматики и уменьшению количества нейтрофилов в асцитической жидкости более чем на 25% через 2 дня терапии. Для профилактики гепаторенального синдрома и острого повреждения почек (со снижением СКФ <60 мл/мин/1,73 м2) пациентам с СБП также назначают альбумин 1,5 г/ кг при диагностике и повторно 1 г/кг через день однократно. Пациенты с развитием СБП должны быть включены в лист ожидания трансплантации [2–7, 14].
Гепаторенальный синдром
Гепаторенальный синдром (ГРС) – функциональная почечная недостаточность без органических изменений почек. Развивается на фоне декомпенсированного ЦП при тяжелом асците из-за нарушения кровообращения в почках, сопровождается олигурией/анурией, азотемией – повышением аммиака в крови, остаточного азота при нормальном уровне мочевины (на фоне азотемии в печени снижается синтез нетоксичной мочевины из токсичного конечного продукта распада белка – аммиака) [2, 4, 14, 16].
Возможно развитие двух типов синдрома. ГРС 1-го типа протекает с быстрой декомпенсацией, уровень сывороточного креатинина обычно превышает 2,5 мг/дл (221 мкмоль/л). Этот синдром чаще возникает на фоне СБП, алкогольного гепатита или выполнения объемного парацентеза без последующего восполнения альбумином. Без лечения или пересадки печени больные с ГРС 1-го типа живут не более 2 нед. ГРС 2-го типа развивается у пациентов с декомпенсацией заболевания печени и тесно связан с резистентным асцитом. При этом варианте заболевание характеризуется медленным течением, почечная недостаточность менее выражена (креатинин сыворотки не превышает 1,5– 2,5 мг/дл или 133–221 мкмоль/л).
Клинические симптомы ГРС: сочетание симптомов острой почечной недостаточности с прогрессирующей печеночной недостаточностью и портальной гипертензией.
Для установления диагноза ГРС Международное общество по изучению асцита рекомендует использовать следующие критерии: ЦП с асцитом, креатинин сыворотки крови выше 1,5 мг/ дл (>133 ммоль/л), отсутствие снижения сывороточного креатинина ниже 1,5 мг/дл (133 ммоль/л) после 2-дневной отмены диуретической терапии и введения жидкости с альбумином (рекомендуемая доза альбумина – 1 г/кг/сут до максимальной 100 г/сут), отсутствие других причин для развития почечной недостаточности (шок, сепсис, уменьшение объема циркулирующей плазмы, использование нефротоксичных лекарств). Необходимо исключить паренхиматозные заболевания почек в случае протеинурии (>500 мг/сут), микрогематурии (>50 эритроцитов в поле зрения) и/или изменения почек при ультрасонографии.
Примерно у 15% пациентов ГРС развивается в течение 6 мес от момента первой госпитализации по поводу асцита, у 40% – в течение 5 лет. Факторами, провоцирующими ГРС, являются инфекции, кровотечения, парацентез с удалением большого количества асцита, массивная диуретическая терапия.
Лечение ГРС осуществляется на фоне продолжающейся терапии печеночной недостаточности. Из фармакологических средств препаратами выбора считаются системные вазоконстрикторы и плазмозаменители. Вазоконстрикторы назначают ввиду того, что начальным звеном в патогенезе ГРС служит расширение артерий внутренних органов, вызванное активацией эндогенных вазоконстрикторных систем с частичным спазмом почечных сосудов. Внутривенное введение одного терлипрессина или в комбинации с альбумином как плазмозаместителем значительно улучшает функцию почек и снижает уровень сывороточного креатинина ниже 1,5 мг/дл (133 мкмоль/л) у 60–75% больных, леченных в течение 5 дней. Альбумин назначается в первый день в дозе 1 г/кг массы тела, в последующие дни – по 20–40 г, терлипрессин – по 0,5 мг внутривенно каждые 4 ч, максимальная доза – 2 мг каждые 4 ч. Возможно применение терлипрессина совместно с октреотидом (аналогом соматостатина и ингибитором глюкагона) и альбумином. Также вместе с альбумином может применяться норадреналин (другой агонист альфа-адренорецепторов) в дозе 0,5–3 мг/ч внутривенно через инфузомат либо дофамин 100 мг за 12 ч. При отсутствии за указанное время увеличения диуреза введение дофамина необходимо прекратить. Длительность лечения составляет 1–2 нед, цель – снижение уровня сывороточного креатинина ниже 126,6 мкмоль/л. В качестве временной терапии может применяться искусственная почка. Основной целью медикаментозного лечения ГРС служит нормализация функции почек с последующей трансплантацией печени [2–7, 14, 16].
Печеночная кардиомиопатия
Развитие цирротической кардиомиопатии (ЦКМП) может влиять на прогноз ЦП: в частности, на плохой прогноз указывает удлинение интервала QT. Возникновение печеночной КМП возможно при наличии острой печеночной недостаточности у пациентов с установленным ЦП, при этом она характеризуется следующими признаками: затуханием/изменением диастолического расслабления левого желудочка и/или увеличением объема левого предсердия, электрофизиологическими отклонениями, например удлиненным интервалом QT, тенденцией к снижению сердечного выброса при декомпенсации, систолической дисфункцией (фракция выброса левого желудочка <55%). В ситуации вазодилатации, вызванной воспалением, и недостаточного инотропного резерва может наступить быстро прогрессирующее нарушение системной гемодинамики с развитием ГРС, нарастанием выраженности асцита, ПЭ.
Единственным установленным эффективным лечением ЦКМП является трансплантация печени. Нормализация функции миокарда и его массы наблюдается уже через 6–12 мес после операции [3, 4, 8].
Гепатопульмональный синдром (ГПС)
У пациентов с хроническим заболеванием печени могут возникнуть четыре основных легочных осложнения: пневмония, печеночный гидроторакс, гепатопульмональный синдром (ГПС), портопульмональная гипертензия.
ГПС определяется как нарушение легочной оксигенации, вызванное внутрилегочной вазодилатацией и реже плевральной и легочной артериовенозной связью, которая возникает в клинических условиях гипертензии в портальной системе. При ПГ усиливается кровообращение в легких (открытие артериовенозных шунтов) и развиваются признаки гипоксемии – одышка и цианоз, которые уменьшаются в положении лежа на спине. Клинические проявления ГПС у пациентов с хроническим заболеванием печени в первую очередь включают одышку. Парциальное давление кислорода снижается <80 мм рт.ст., или альвеолярно-артериальный градиент кислорода составляет ≥15 мм рт.ст.
Лечение ГПС включает лечение портальной гипертензии, асцита, кислородотерапию, трансплантацию печени [2–4, 8].
Печеночный гидроторакс
Печеночный гидроторакс – это накопление транссудата в плевральной полости при отсутствии сердечной, легочной и плевральной патологии. Причиной этого осложнения служит проникновение асцитической жидкости через диафрагму за счет отрицательного давления в плевральной полости на вдохе в условиях ПГ и гипоальбуминемии. Плевральный выпот может приводить к дыхательной недостаточности и осложняться спонтанной бактериальной инфекцией с развитием эмпиемы. Печеночный гидроторакс ассоциируется с плохим прогнозом: медиана выживаемости составляет 8–12 мес.
Диагноз устанавливается путем исключения сердечной, легочной и плевральной патологии и основан на торакоцентезе, при котором необходимо исключить бактериальную инфекцию [2–7].
Дилюционная гипонатриемия
Гипонатриемия разведения, или дилюционная гипонатриемия, у пациентов с ЦП представляет собой клинический синдром и диагностируется на основании следующих признаков: снижения уровня сывороточного натрия ≤130 ммоль/л; увеличения внеклеточного объема жидкости; наличия асцита и/или периферических отеков.
Гипонатриемия разведения встречается в среднем у трети (30–35%) внутригоспитальных больных с ЦП и асцитом и служит негативным прогностическим признаком. Гипонатриемию разведения следует отличать от истинной гипонатриемии, которая развивается при уменьшении объема циркулирующей плазмы вследствие передозировки диуретических препаратов у больных без асцита и отеков. Предрасполагающими факторами к развитию дилюционной гипонатриемии считаются прием НПВП и выполнение объемного парацентеза без последующего введения плазмозамещающих растворов.
У больных ЦП дилюционная гипонатриемия, как правило, развивается в течение нескольких дней – недель, хотя возможны и острые состояния. Клинически гипонатриемия проявляется тошнотой, рвотой, апатией, анорексией, летаргией, судорогами, дезориентацией, головной болью. Неврологические симптомы, возникшие при этом состоянии, бывают трудно отличимы от проявлений ПЭ.
Лечение дилюционной гипонатриемии: ограничение объема жидкости до 1 л/сут (предотвращает дальнейшее падение уровня натрия), бессолевая диета [2–4, 6, 8].
Тромбоз воротной вены
Тромбоз воротной вены (ТВВ) при ЦП является частым осложнением (от 8 до 25%). У больных с декомпенсированной стадией цирроза, находящихся в листе ожидания трансплантации, она достигает 30% при наличии гепатоцеллюлярной карциномы. При ЦП ТВВ связывают с уменьшением скорости портального кровотока из-за развития портальной гипертензии и снижением синтеза естественных антикоагулянтов (протеинов С и S, антитромбина III) вследствие печеночной недостаточности.
Клинически ТВВ проявляется кровотечением из ВРВП, развитием рефрактерного асцита, тромбоза брыжеечной вены, вздутием живота и нарушением перистальтики кишечника, увеличением размеров селезенки, болью в животе, тошнотой, энцефалопатией, желтухой, лихорадкой и другими симптомами печеночной недостаточности.
Для постановки диагноза необходимо проведение УЗИ органов брюшной полости с УЗ-допплерографией системы воротной вены, КТ органов брюшной полости с ангиографией системы воротной вены.
Предлагаются различные подходы к терапии ТВВ. Использование антикоагулянтной терапии (низкомолекулярные гепарины, сулодексид), способствующей восстановлению проходимости сосуда, приводит к реканализации последнего в 25–69% случаев [2, 3, 6–8].
Гиперспленизм
Это осложнение возникает при большом разрушении в синусоидах селезенки эритроцитов, тромбоцитов, лейкоцитов вследствие увеличения селезенки и ПГ.
Клиническая картина гиперспленизма включает анемию, кровотечение, инфекцию.
Диагноз ставится по наличию спленомегалии (УЗИ или КТ брюшной полости), лабораторному подтверждению уменьшения одного из типов клеток крови. Вместе с тем гиперспленизм иногда может развиваться и при нормальных размерах селезенки. Его возникновение указывает на неблагоприятное течение основного заболевания, поскольку синдром часто связан с летальным исходом. Признаки гиперспленизма наблюдались у 60% пациентов с ЦП. Синдром является компонентом ПГ и сопровождается асцитом, варикозным расширением вен пищевода и симптомами печеночной недостаточности.
Гиперспленизм характеризуется большим количеством осложнений: наиболее распространенные побочные эффекты связаны с тромбоцитопенией, при этом развивается обширное внутреннее кровотечение, и наиболее опасным в этом плане является геморрагический инсульт (смертность около 30%). Тяжелая прогрессирующая анемия приводит к декомпенсации хронической сердечной недостаточности, обострению ишемической болезни сердца в виде нестабильной стенокардии и инфаркта миокарда. Из-за гранулоцитопении инфекционные заболевания приобретают тяжелое молниеносное течение, быстро переходя в септическое состояние и септический шок.
Лечение гиперспленизма: переливание цельной крови или отдельных ее компонентов, возможно назначение препаратов, действующих на отдельные ростки костного мозга – эритропоэтина, филграстима, тромбопоэтина. Наиболее радикальным методом лечения гиперспленизма служит эмболизация селезеночной артерии или ее ветвей, но эта операция связана с большим количеством осложнений – тромбозом, повышенной чувствительностью к бактериям. При гиперспленизме возможно эндоваскулярное вмешательство [2, 3, 5, 7].
Остеопороз
Остеопения и остеопороз – распространенные осложнения ЦП: частота их развития варьирует от 20 до 50%. Причина возникновения этого осложнения многофакторна (гипербилирубинемия, гипогонадизм, изменения в метаболизме кальция и витамина D, дефицит витамина К).
Остеопороз приводит к переломам костей и оказывает существенное влияние на продолжительность и качество жизни больных. Оценка состояния костной ткани (денситометрия поясничных позвонков и шейки бедра) рекомендована всем пациентов с хроническими заболеваниями печени. При наличии клинических проявлений остеопороза (боли в спине, снижение роста больного, усиление кифоза) показаны рентгенологические методы.
В лечении остеопороза у больных ЦП возможно применение альфакальцидола (аналога витамина D) 1,0 мкг в сочетании с 1 г кальция в день в течение 6 мес [3, 4].
Саркопения
Синдром саркопении (гипотрофия/слабость мышц, sarcopenia/frailty) связан с нарушением дезинтоксикационной и синтетической функции печени, нарушением питания при ЦП. В последние годы синдрому слабости при ЦП уделяется особое внимание как фактору, который не только снижает качество жизни, но и ухудшает прогноз для жизни и результаты трансплантации. Термин sarcopenia применяется как характеристика уменьшения мышечной массы, frailty характеризует общую слабость и снижение силы мышц. Саркопения при ЦП встречается в 18–43%, слабость – у 40–70% больных.
Диагностика саркопении состоит из антропометрии, оценки теста 6-минутной ходьбы, электрофизиологии, методов визуализации (КТ-, МРТ-измеренная мышечная масса). В частности, 6-минутный тест значительно снижается у пациентов, ожидающих трансплантации печени, и обратно коррелирует с тяжелым состоянием по шкале MELD. Результат предтрансплантационного теста 6-минутной ходьбы <250 м представляет собой фактор повышенного риска смертности и диктует необходимость включения пациента в лист ожидания трансплантации печени [3, 4, 6].
Гепатоцеллюлярная карцинома
Гепатоцеллюлярная карцинома (ГЦК) при ЦП развивается почти у 20% пациентов. Частота встречаемости этого заболевания составляет 2–3 случая на 100 000 населения.
Среди факторов риска ГЦК выделяют мужской пол, возраст старше 40 лет, курение, злоупотребление алкоголем. ГЦК является наиболее распространенным первичным раком печени и наиболее частой причиной смерти при ЦП.
Клиническая картина: поскольку ГЦК обычно развивается на фоне ЦП и его симптомов, она, наряду с прочим, характеризуется прогрессирующей потерей веса, повышенной слабостью, анорексией, лихорадкой, болями в правом подреберье. Иногда выслушиваются шум трения брюшины и систолический шум над печенью (из-за сдавления узлами артерий, питающих опухоль), возможно развитие эпизодов гипогликемии, отсутствие эффекта от лечения асцита, в ряде случаев пальпируется опухолевый узел, быстро увеличивается гепатомегалия.
Диагностика ГЦК: при ЦП альфа-фетопротеин в 3–4 раза выше нормы, при этом концентрация его максимально повышена именно при раке печени. В связи с этим данный биомаркер у больных с ЦП должен контролироваться 1 раз в 6 мес; выраженное повышение его концентрации (более 100 нг/мл) имеет диагностическое значение для выявления рака. Некоторые другие опухолевые маркеры (например, раковый эмбриональный антиген) также возрастают. Пациентам с ЦП проводится скрининг на ГЦК с использованием МРТ. Биопсия печени при отсутствии противопоказаний (геморрагический синдром, тяжелая портальная гипертензия) выполняется под контролем методов визуализации.
Осложнения ГЦК включают ТВВ, разрыв опухолевого узла с кровотечением в брюшную полость и развитие картины «острый живот».
При ГЦК назначается (в отсутствие противопоказаний – тяжелых осложнений ЦП, класса 3 по Чайлд–Пью) хирургическое лечение, чаще всего трансплантация печени. Возможно введение гранулярных цитостатиков по системе печеночных вен в сосуды опухоли.
Прогноз при ГЦК неблагоприятный: пятилетняя выживаемость при лечении варьирует в пределах 5–8% [3–7, 17].
ПРОГНОЗ ПРИ ЦИРРОЗЕ ПЕЧЕНИ
Шкала оценки тяжести ЦП Чайлда–Тюркотта–Пью (1972) точно предсказывает исходы у пациентов с этим заболеванием. Согласно данной шкале, выделяют 3 класса тяжести ЦП (табл. 3, 4). При сумме баллов менее 5 средняя продолжительность жизни пациентов составляет 6,4 года, при сумме 12 и более – 2 мес.
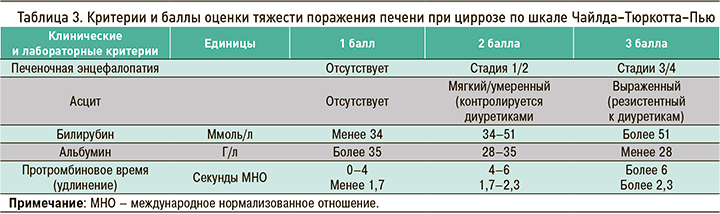
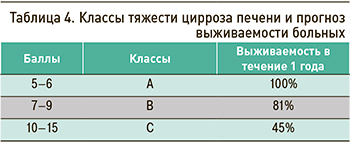
Лучший маркер для прогноза при ЦП – альбумин, а также факторы свертывания (протромбиновое время).
Шкала прогноза MELD (Model for End-stage Liver Disease, 2016) – это модель терминальной стадии болезни печени для определения риска летального исхода в 90-дневный срок, ранее разработанная для больных, нуждающихся в трансплантации печени.
Формула расчета значения MELD = 11,2 × ln (МНО) + 9,57 × ln (креатинин, мг/дл) + 3,78 × ln (билирубин, мг/дл) + 6,43, где ln – натуральный логарифм. Нижняя граница нормы для каждого показателя равна 1, максимальное значение для уровня креатинина ‒ 4. В случае если пациент находится на гемодиализе, уровень креатинина считают равным 4.
Перевод билирубина из мг/дл в ммоль/л: значение умножить на 18. Перевод креатинина из мг/дл в мкмоль/л: умножить на 88,4.
Прогноз считают плохим при значении индекса ≥32.
Шкала MELD также используется для прогноза выживаемости: у пациента с результатом по этой шкале ≤15 баллов прогнозируемая 3-месячная выживаемость составляет 95%, при ≥30 баллах – всего 65%. Рекомендуется рассчитывать показатель шкалы MELD при каждом визите пациента к врачу. При его значениях ≥15 баллов пациент подлежит включению в лист ожидания трансплантации печени [2–8].
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ЦИРРОЗА ПЕЧЕНИ
Декомпенсированный ЦП должен лечиться в специализированных стационарах/центрах трансплантации печени в соответствии с современными рекомендациями и с учетом индивидуальных показаний и противопоказаний к препаратам.
1. Устранение этиологического фактора (по возможности)
Противовирусная терапия: при инфекции HBV у пациентов с ЦП класса А по шкале Чайлд–Пью могут использоваться препараты интерферонового ряда, однако при их применении необходимо помнить о риске развития инфекционных осложнений и декомпенсации функции печени у этой категории больных. Предпочтение следует отдавать аналогам нуклеотидов/нуклеозидов (ламивудин и др.). При ЦП на фоне HCV лечение осуществляется по рекомендациям для лечения хронического гепатита С. Лицам с нарушением функции печени (ЦП классов В и С по шкале Чайлд–Пью) лечение проводится в специализированных центрах аналогами нуклеоти(зи)дов.
При алкогольном ЦП класса А и В применяют адеметионин в дозе 1200 мг/сут перорально на протяжении 2 лет, что достоверно уменьшает летальность или потребность в трансплантации. Это лекарственное средство указывает на мембранопротективное и антиоксидантное действие, подавляет продукцию провоспалительных цитокинов.
При первичном билиарном циррозе используются препараты урсодезоксихолевой кислоты, при аутоиммунном гепатите – глюкокортикоиды.
2. Устранение триггернных и отягощающих факторов ПЭ: остановка кровотечения, коррекция гиповолемии, поддержание кислотно-щелочного и электролитного баланса, санация кишечника, ликвидация инфекции, запоров и т.д.
3. Патогенетическая терапия: лечение ПГ (консервативное, хирургическое). На стадии разработки – применение антифиброзных препаратов, антицитокиновая терапия.
4. Диета: назначается с учетом этиологии и синдромов (жировое поражение печени, ПЭ, асцит, ГРС и др.). Базовая диета – стол № 5 по Певзнеру с полным отказом от алкоголя, ограничением/отказом от соли.
5. Симптоматическая терапия (по показаниям): назначение ферментных препаратов, лечение дисбактериоза, энцефалопатии, асцита, инфекции (в том числе СБП), ГРС, кровотечений, тромбозов. При цитопениях показаны гранулоцитарный колониестимулирующий фактор роста для увеличения числа нейтрофилов, при возникновении анемии – эритропоэтин, при развитии тромбоцитопении – тромбоцитарный фактор роста.
6. Радикальное лечение ЦП – трансплантация печени
Основные заболевания, ведущие к трансплантации печени в Европе: 57% – ЦП, злокачественные опухоли – 14%, холестатические поражения – 10%, острая печеночная недостаточность – 8%, другое (синдром Бадда–Киари; доброкачественные опухоли печени или поликистоз, паразитарные заболевания) – 4%. В ряде развитых стран на первое место по количеству трансплантаций выходит ЦП в исходе неалкогольной жировой болезни печени. На сегодня Европе после почти 100 000 трансплантаций шансы на выживание в течение года близки к 90%, а 5-летняя выживаемость составляет около 70%. Общее показание к трансплантации – наличие необратимого заболевания печени с прогнозом жизни менее 12 мес. Этот радикальный метод осуществляется в специализированных центрах и показан практически всем больным с терминальной стадией заболеваний печени, осложненных кровотечением из ВРВП/варикозно расширенных вен желудка, асцитом, ГРС, энцефалопатией, СБП. Дополнительными показаниями к операции служат выраженная утомляемость, невозможность вести нормальный образ жизни, заметное похудание и упорный кожный зуд.
Пациенты с ЦП, которые перенесли пищеводное или желудочное кровотечение как следствие ПГ и/или хотя бы один эпизод СБП, соответствуют минимальным критериям включения в лист ожидания трансплантации независимо от класса по Чайльд–Пью.
К основным противопоказаниям для проведения операции относятся внепеченочные злокачественные заболевания, метастатические поражения, активная ВИЧ-инфекция, активный алкоголизм, наркомания, внепеченочный сепсис, тяжелые сопутствующие заболевания, психологическая и социальная несостоятельность больного [2–6, 9–13, 18, 19].



