Широкомасштабные эпидемиологические исследования, проведенные ФГБУ «НИИ питания» РАМН, выявили значительные нарушения в структуре питания и пищевом статусе взрослых и детей в России [1]. Нарушения пищевого статуса служат независимым фактором риска, который отрицательно влияет на качество жизни и клинические исходы пациентов, снижая эффективность и переносимость лечебных мероприятий, увеличивая риск септических и инфекционных осложнений, приводя к повышению потребления ресурсов здравоохранения (в том числе к увеличению затрат на лечение больного и продолжительности пребывания в стационаре) и ухудшая показатели летальности [2–5]. Нарушения пищевого статуса могут быть связаны с наследственными факторами, определяющими недостаточность различных звеньев пищеварительной системы [2, 3]. По литературным данным и собственным нашим исследованиям, одним из факторов формирования нарушений пищевого статуса с дефицитом массы тела является дисплазия соединительной ткани (ДСТ) [6]. По некоторым данным, в небольших группах пациентов с недифференцированной ДСТ дефицит массы тела регистрируется в примерно 60% случаев [7].
Цель исследования – уточнить распространенность дефицита массы тела (индекс массы тела <18,5 кг/м2) у пациентов молодого возраста (18–44,9 лет) с ДСТ и охарактеризовать фенотип пациентов.
МАТЕРИАЛ И МЕТОДЫ
В соответствии с критериями включения (признаки недифференцированной ДСТ, возраст 18–45 лет, подписанное информированное согласие) и исключения (наследственные синдромы ДСТ у пациента и/или родственников первой линии родства, употребление наркотических средств, злоупотребление алкоголем на момент включения) в исследование вошли 494 человека, имеющих признаки ДСТ, в возрасте от 18 до 45 лет: 290 (58,70%) мужчин, средний возраст в группе 28,82±9,60.
Всем пациентам проводилось общеклиническое обследование (сбор жалоб, анамнеза, осмотр), скрининг на наличие ДСТ (алгоритм диагностики внешних и внутренних признаков ДСТ), абдоминальное ультразвуковое исследование, фиброгастродуоденоскопия. Диагноз ДСТ устанавливался по совокупности фенотипических признаков дисморфогенеза соединительной ткани [8]. Дефицит массы тела определялся при наличии индекса массы тела (ИМТ) <18,5 кг/м2 [9]. Данные записывались как М (среднее значение) ± s (среднеквадратическое отклонение).
Статистическая обработка результатов проводилась с использованием критериев, соответствующих типу признака и его распределения. Статистическая обработка материалов осуществлялась с использованием пакетов программ Statistica 10,0 (StatSoft). Сравнение двух независимых групп проводили при помощи U критерия Манна–Уитни. При сравнении частот признаков независимых выборок использовали критерий χ2 с поправкой Йейтса. Уровень значимости p <0,05 принимали как статистически значимый.
РЕЗУЛЬТАТЫ
В общей группе ДСТ диагностический коэффициент ДСТ (ДК ДСТ) составил 28,45±10,28. Доминирующим конституциональным типом был астенический (91,90%; n=454). Из признаков ДСТ преобладали проявления со стороны опорно-двигательного аппарата. У абсолютного большинства пациентов (90,28%; n=446) проявления диспластического процесса затрагивали 2–4 системы: 2 системы – у 36,23% (n=179), 3 системы – у 36,84% (n=182), 4 системы – у 17,21% (n=85). Изменения 1 и 5 систем (включая орган зрения и кожу) регистрировались соответственно в 5,06% (n=25) и 4,25% (n=21) случаев. Значительно реже встречалась вовлеченность 6 указанных выше систем органов (0,40%; n=2).
Средний в выборке ИМТ составил 19,50±3,32 кг/м2. У 223 (45,14%) пациентов показатель соответствовал дефициту массы тела, у 38 пациентов (7,69%) – избыточной массе тела. Дефицит массы тела регистрировался с одинаковой частотой среди мужчин и женщин – в 42,41 и 49,02% случаев соответственно (χ2 1,852; р=0,174).
Исходя из ИМТ, были сформированы 2 группы:
- группа 1 – ИМТ <18,5 кг/м2 (дефицит массы тела; n=223);
- группа 2 – ИМТ≥18,5 кг/м2 (n=271).
Группы не различались по полу, возрасту, выраженности проявлений ДСТ. Так, проявления со стороны более 1 системы встречались с одинаковой частотой – соответственно в 3,14 и 6,64% случаев (χ2 2,438; р=0,119); диагностические коэффициенты не различались – соответственно 27,44±8,95 и 29,28±11,21 (p >0,05). В то же время в группе 1 значимо чаще регистрировались деформации позвоночника – в 81,61% случаев (n=182) против 68,27% (n=185) в группе 2 (χ2 10,725; р=0,002). В группе 1 по сравнению с группой 2 значимо реже встречались гипермобильность суставов – 16,59% (n=37) против 26,94% (n=73) случаев (χ2 6,979; р=0,009), диспластикозависимые изменения кожи –23,32% (n=52) против 33,95% (n=92) случаев (χ2 6,189; р=0,014).
При анализе диспластикозависимых изменений желудочно-кишечного тракта (ЖКТ), которые выявлялись в общей группе в 140 случаях (28,34%), по большинству признаков значимых различий между группами не выявлено. Отмечено, что в группе 1 практически у каждого второго пациента регистрировались признаки билиарного сладжа, что было достоверно чаще, чем в группе 2. Группы не различались по частоте выявления хронического гастрита и/или дуоденита, гастроэзофагеальной рефлюксной болезни (ГЭРБ). В то же время в группе 1 значимо чаще регистрировалась функциональные расстройства ЖКТ – функциональная диспепсия и синдром раздраженной кишки (табл. 1).
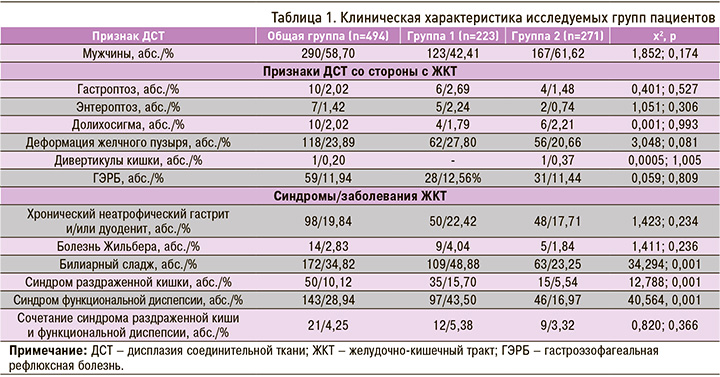
У части пациентов обеих групп было проведено анкетирование, касающееся особенностей пищевого поведения. Отмечено, что большинство пациентов обеих групп питалось нерегулярно, доминировал прием пищи небольшими порциями (перекусы), в том числе регулярное потребление фастфуда, недостаточное потребление овощей/фруктов и молочных продуктов, а также быстрая еда с длительностью приема пищи менее 20 мин (табл. 2). При этом в группе 1 треть респондентов привычно не завтракали, и этот показатель был значимо больше, чем в группе 2. В обеих группах нередко пациенты страдали отсутствием аппетита по утрам, но чаще такая характеристика наблюдалась в группе 1. В этой же группе респонденты значимо чаще отмечали отсутствие аппетита перед едой и в течения дня, указывая, что при этом они либо пропускали прием пищи, либо «ели, потому что надо» или «за компанию». О перекусах перед сном чаще говорили представители группы 2.
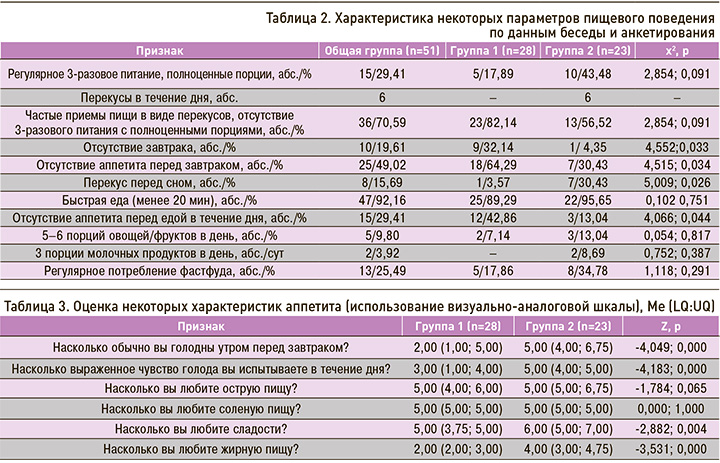
Всем пациентам, проходившим анкетирование, также было предложено оценить некоторые особенности пищевого поведения с применением визуально-аналоговой шкалы (табл. 3).
ОБСУЖДЕНИЕ
Европейские исследователи определяют дефицит массы тела, если ИМТ составляет <18,5 кг/м2 (у пациентов пожилого возраста и старше <22 кг/ м2). По результатам исследований, дефицит массы тела при такой отрезной точке связан с плохим исходом заболевания и более высокими показателями смертности, как и значения ИМТ, превышающие 30 кг /м2 [3]. При оценке ИМТ существуют известные ограничения: отсутствие учета состава тела, явных и скрытых отеков, пола. Безусловно, ИМТ не отражает фактическое потребление пищи пациентом и тем более баланс нутриентов, а также (особенно в случае тяжелых заболеваний, сопровождающихся задержкой жидкости) может не выявить потенциально патологическую потерю массы тела при прочих равных условиях. При знании и учете этих ограничений масса тела, рост и полученный в результате ИМТ служат важными параметрами, которые высоко воспроизводимы и относительно легко получаемы у различных пациентов, в том числе с острыми и хроническими заболеваниями. Учитывая особенности обследованных лиц (пациенты молодого возраста с ДСТ, без тяжелых хронических и острых заболеваний, способных влиять на интерпретацию данных), мы исходили из оценки ИМТ в формировании групп с различным пищевым статусом.
К причинам нарушений пищевого статуса относят недостаточное, избыточное или несбалансированное питание, нарушение пищеварительной функции (усвоение пищевых веществ), нарушение утилизации пищевых веществ, нарушение обмена веществ, усиление катаболизма и потери нутриентов [2]. Как верно указывают эксперты в области питания, проблемы дефицита массы тела, алиментарного дефицита связаны не только с недостаточностью или несбалансированностью пищевого рациона, но и состоянием обменных процессов в организме (метаболический статус организма), недостаточностью пищеварительной системы (пищевой статус). В последнем случае причины нарушения пищеварения могут быть связаны с наследственными факторами, определяющими недостаточность различных звеньев пищеварительной системы. Системный дисморфогенетический процесс – облигатный признак ДСТ, не может не затрагивать в той или иной степени ЖКТ. Известно, что признаки ДСТ со стороны ЖКТ включают несостоятельность жомов (кардия желудка, баугиниева заслонка), моторно-тонические нарушения (рефлюксы), нарушения фиксации органов (гастроптоз, колоноптоз), изменения размеров и длины полых органов, дивертикулы пищевода и различных отделов кишечника [8]. В нашем наблюдении те или иные диспластикозависимые изменения ЖКТ наблюдались в 28,34% случаев и регистрировались с одинаковой частотой у пациентов групп 1 и 2. В то же время среди пациентов с ДСТ и дефицитом массы тела значимо чаще встречались функциональные расстройства (синдром раздраженной кишки, синдром функциональной диспепсии) и билиарный сладж. Ранее было установлено, что для пациентов с ДСТ в целом наиболее характерен именно синдром диспепсии в клиническом варианте постпрандиального дистресс-синдрома с изменением кислотопродуцирующей функции желудка по билиарному и гипоацидному вариантам [10].
Также следует отметить, что, по данным некоторых исследований, степень тяжести и выраженность клинических проявлений белково-энергетической недостаточности у лиц молодого возраста с ДСТ коррелирует с концентрацией медиаторов жировой ткани, уровнем провоспалительных цитокинов. При этом у пациентов с более выраженным снижением ИМТ, дефицитом подкожного жира и мышечной массы отмечается наличие сочетанных мутаций генов FTO (A+23525T) ТТ и LEPR (Arg223Gln) G/G [11]. Кроме того, при ДСТ исследователями выделяется так называемый абдоминальный гемодинамический синдром, характеризующийся низкими показателями регионального абдоминального кровотока на фоне уменьшения диаметра и/или аномалий абдоминальных сосудов. При этом показано, что степень гемодинамических изменений в постпрандиальном периоде коррелировала с выраженностью признаков недостаточности питания и тяжестью гастроэнтерологических синдромов [6]. Оценка регионального кровотока, цитокинового и метаболического профиля в нашей группе пациентов не проводилась.
Выраженность нарушений пищеварения закономерно усугубляется пищевым дефицитом. Традиционно оценка состояния питания проводится у взрослых пациентов, отнесенных к группе пищевого риска. Она начинается со скрининга на риск недостаточности питания в декретированных группах: среди больных старшей возрастной группы с коморбидной патологией, пациентов с тяжелыми заболеваниями внутренних органов, больных в пред- и постоперационном периоде и т.д. Хотя многими авторами отмечено снижение ИМТ в группе взрослых пациентов молодого возраста с ДСТ, целенаправленных исследований этого клинического феномена по-прежнему недостаточно. ДСТ на сегодня не рассматривается как категория риска мальнутритивных состояний. Выявленная нами распространенность снижения массы тела относительно популяционных границ нормы среди пациентов молодого возраста с ДСТ ориентирует специалистов на необходимость оценки состояний питания в этой группе, что позволит определить как минимум, действительно ли существует проблема питания, выявить причины и определить ее серьезность.
Безусловно, оценка состояния питания должна включать оценку компонентов аппетита, документирование приема пищи, в том числе качественные и количественные аспекты, измерение потребления энергии, основных нутриентов (прежде всего полноценного белка) и микроэлементов. Подобных исследований в доступной нам литературе мы не обнаружили. Только приближаясь к этой проблеме, мы попытались охарактеризовать некоторые параметры питания пациентов с ДСТ и дефицитом массы тела. Обращается на себя внимание тот факт, что абсолютное большинство респондентов (36/51) питались нерегулярно, в каждом пятом случае у них привычно отсутствовал завтрак, имел место вариант питания с частыми приемами пищи малого объема (перекусы), причем в четверти случаев с потреблением фастфуда. Кроме того, для них была характерна быстрая еда, недостаточное потребление клетчатки и молочных продуктов. Каждый второй респондент при самооценке отмечал отсутствие аппетита по утрам, что, возможно, и объясняет в части случаев отсутствие утреннего приема пищи. В нашем наблюдении среди пациентов с ДСТ и дефицитом массы тела достоверно чаще выявлялись некоторые негативные характеристики питания. Так, значительно чаще, в трети случаев, отсутствовал завтрак, при этом у большинства (64,29%) отсутствовал аппетит перед утренним приемом пищи. Оценка некоторых дополнительных характеристик аппетита и питания с применением визуально-аналоговой шкалы показала, что в этой группе чувство голода утром, как и в течение дня, было снижено, в сравнении с группой 2; также в 1 группе ниже была оценка пристрастия к сладостям и жирной пище.
В дальнейших исследованиях было бы интересно уточнить, связаны ли такие особенности пищевых пристрастий с переносимостью соответствующих видов пищи, их усвоением. Тем более что при интервьюировании некоторые респонденты активно указывали на появление тошноты и/или чувства переполнения желудка и/или резкой слабости и/или изменения характера стула после приема определенных видов пищи (сладости, жирная, острая пища). Из-за небольшого количества и неструктурированности информации подобные сведения мы не включали в наш анализ.
Очевидно, что данные наблюдения, представляя существенный клинический интерес, не объясняют в полной мере весь комплекс патофизиологических изменений при нутритивном дефиците, который может формироваться у части пациентов с ДСТ. Необходимы дальнейшие исследования в этой области; наши же наблюдения нуждаются в дальнейшей детализации, сравнительном анализе с группой респондентов без ДСТ.
ЗАКЛЮЧЕНИЕ
Таким образом, в группе пациентов молодого возраста с ДСТ снижение массы тела регистрировалось в 45% случаев, встречаясь с одинаковой частотой среди мужчин и женщин. Диспластикозависимые изменения ЖКТ встречались в 28,34% случаев. Группа пациентов с ДСТ и дефицитом массы тела отличается большей частотой функциональных расстройств (синдром раздраженной кишки, синдром функциональной диспепсии) и билиарного сладжа, большей частотой негативных характеристик питания (отсутствие завтрака, отсутствие аппетита перед утренним приемом пищи), снижением чувства голода утром и в течения дня, сниженной оценкой пристрастия к сладостям и жирной пище.



