ВВЕДЕНИЕ
Анкилозирующий спондилит (АС) – хроническое воспалительное заболевание из группы спондилоартритов, характеризующееся обязательным поражением крестцово-подвздошных сочленений и/или позвоночника с частым вовлечением в патологический процесс периферических суставов, энтезисов, других органов [1]. Согласно различным исследованиям, примерно половина пациентов с АС имеет поражение одного или нескольких периферических суставов [2].
В последние десятилетия изучение ревматических заболеваний идет в тесной связи с исследованиями поражения сердечно-сосудистой системы. В частности, эксперты отмечают, что среди пациентов с АС в 2 раза чаще встречается ишемическая болезнь сердца (ИБС) [3, 4]. Само заболевание также может сопровождаться развитием внескелетных проявлений со стороны сердечно-сосудистой системы, к которым относятся аортит, нарушения проводимости, ухудшение функции левого желудочка [5]. Поражение миокарда в виде систолической и диастолической дисфункции может длительно протекать бессимптомно, в дальнейшем переходя в клинически выраженную сердечную недостаточность. Однако в литературе мало публикаций, касающихся вовлечения в патологический процесс при скелетно-мышечных заболеваниях правых отделов сердца. Современные тенденции в медицине требуют поиска возможностей для ранней доклинической диагностики заболеваний и патологических состояний. Поэтому становится актуальным вопрос, каковы особенности поражения миокарда, процесса его ремоделирования у пациентов с различными клиническими вариантами АС и, в частности, при наличии внеаксиальных проявлений.
Цель исследования – определить взаимосвязь между внеаксиальными проявлениями и кардиальной патологией у пациентов с АС.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 153 пациента с верифицированным АС, соответствовавшим модифицированным Нью-Йоркским критериям этого заболевания [6]. Средний возраст участников составил 43,3±9,8 лет, мужчин было 111 (72,5%), женщин – 42 (27,5%). Пациенты проходили стационарное лечение в ревматологическом отделении ГАУЗ «Республиканская клиническая больница Минздрава Республики Татарстан».
Критериями включения в исследование были возраст старше 18 лет, наличие верифицированного АС, длительность заболевания не менее 1 года.
Критериями исключения из исследования служили наличие других воспалительных болезней суставов, злокачественные новообразования и лимфопролиферативные заболевания, беременность и период лактации, достоверно установленные сахарный диабет, ИБС, кардиомиопатии, клапанные пороки сердца.
До включения в исследование пациенты подписывали информированное согласие установленной формы на участие в нем.
На основании клинико-анамнестических данных выполнялась общая оценка активности болезни, которая осуществлялась с помощью суммарного показателя – индекса BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) и индекса ASDASСОЭ (Ankylosing Spondylitis Disease Activity Score). Оценка функциональных нарушений осуществлялась с применением суммарного индекса BASFI (Bath Ankylosing Spondylitis Functional Index).
При исследовании клинической картины у пациентов определялись наличие внеаксиальных (артрит, энтезит/энтезопатия, дактилит) и внескелетных (аортит, нарушения проводимости и т.д.) проявлений. В зависимости от наличия или отсутствия внеаксиальных проявлений все пациенты были разделены на 2 группы: 1-я группа (n=78; 51%) – с их наличием, 2-я группа (n=75; 49%) – с отсутствием таковых. Обе группы были сопоставимы по возрасту и полу.
Всем пациентам, помимо рутинных лабораторных методов исследования, для выявления кардиальных нарушений проводили векторкардиографию и двухмерную трансторакальную эхокардиографию (ЭхоКГ). При векторкардиографии нами измерялись плоскостные показатели – площадь петли P, площадь петли QRS, площадь петли Т, а также пространственные параметры – вольтаж максимального вектора (МВ), его азимут и угол подъема [7]. Стоит упомянуть, что векторкардиография – это пространственное динамическое исследование электрического поля сердца. В основе метода лежит принцип получения пространственной фигуры, являющейся графическим изображением изменений величины и направления электродвижущей силы в течение всего сердечного цикла [8].
В ходе ЭхоКГ вычислялись индекс массы миокарда левого желудочка (ИММЛЖ), относительная толщина стенки левого желудочка, Е/а (соотношение скорости раннего диастолического наполнения к скорости позднего диастолического наполнения) трансмитрального потока, Е/а транстрикуспидального потока и фракция выброса по Симпсону.
Статистический анализ проводился с помощью программы STATISTICA 10.0 для Windows (Stat.Inc, США). Межгрупповые различия количественных признаков анализировались с использованием U-теста Манна–Уитни. Корреляции признаков оценивались по r-критерию Спирмена. Описательные характеристики непараметрических данных представлены в виде Ме [Q1; Q3], где Me – медиана, Q1 и Q3 – 1-й и 3-й квартили. Параметрические данные отображены как M±σ, где М – среднее арифметическое, σ – стандартное отклонение. Для всех использованных статистических критериев был принят критический уровень значимости р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
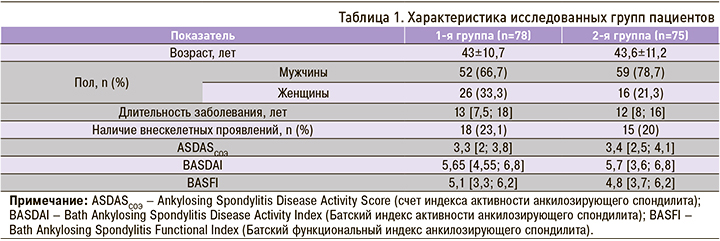
Характеристика групп пациентов, участвовавших в исследовании, представлена в таблице 1. Как видно из нее, в 1-й группе женщин было больше, чем во 2-й, хотя это различие и не являлось статистически значимым (р <0,1). Учитывая, что АС – заболевание преимущественно мужчин, такую тенденцию среди пациентов женского пола нельзя оставить без внимания. По наблюдениям ряда авторов, подобная тенденция отмечается и в других странах [9]. Поэтому пациенток женского пола, страдающих АС, следует особенно тщательно обследовать на предмет выявления внеаксиальных проявлений заболевания.
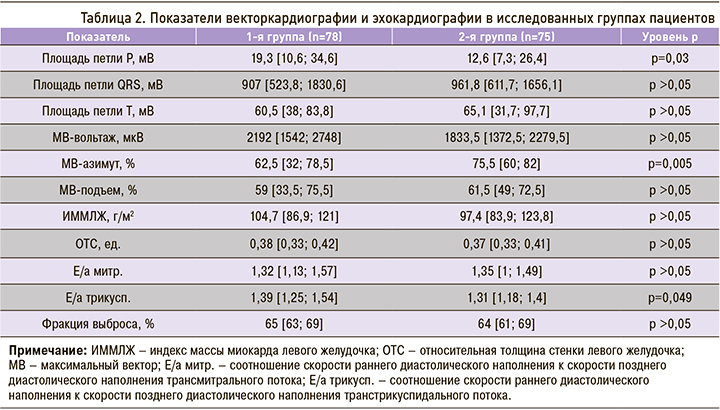
Результаты инструментальных методов исследования, полученные в ходе исследования, приведены в таблице 2.
Площадь петли Р, которая характеризует электрическую активность предсердий, была достоверно выше в 1-й группе. Это свидетельствует об увеличении электрически активного миокарда предсердий за счет их гипертрофии и дилатации. В то же время азимут в этой группе был ниже, чем во 2-й. Следует отметить, что изменения, обнаруживаемые при векторкардиографии, не всегда прямо соответствуют изменениям при ЭхоКГ, однако они свидетельствуют об электрофизиологическом ремоделировании миокарда, которое предшествует структурно-геометрическому.
При сравнении обеих групп нами было выявлено, что в 1-й группе лиц уровень Е/a транстрикуспидального потока оказался достоверно выше, чем во 2-й, что позволяет говорить о нарушении диастолической функции правых отделов сердца у пациентов с АС и внеаксиальными проявлениями.
Корреляционный анализ показал, что в группе лиц с внеаксиальными проявлениями АС ИММЛЖ прямо коррелировал с углом подъема максимального вектора (r=0,34; р=0,03). Это объясняется тем, что с увеличением массы миокарда происходит и отклонение максимального вектора электродвижущей силы сердца, в данном случае за счет левого желудочка [10]. Относительная толщина стенки левого желудочка обратно коррелировала с площадью петли QRS (r=-0,36; р=0,02). Это говорит о том, что утолщение стенок левого желудочка сопровождается снижением электрически активной части миокарда. Причин этому может быть множество, но одна из наиболее вероятных у пациентов с АС – это фиброз миокарда [11]. Соотношение Е/а транстрикуспидального кровотока имело обратную связь с площадью петли QRS (r=0,52; р=0,0003); это свидетельствует о том, что нарушение диастолической функции правого желудочка сопровождается снижением электрической активности миокарда желудочков. Учитывая полученные выше результаты корреляционного анализа, можно предполагать, что фиброз миокарда как наиболее вероятная причина снижения электрической активности способствует снижению диастолической функции правого желудочка. В связи с этим можно также предположить, что у пациентов с внеаксиальными проявлениями АС необходимо тщательно мониторировать диастолическую функцию сердца, делая особенный акцент на правых отделах.
Следует подчеркнуть, что в 1-й группе исследования параметры ЭхоКГ и векторкардиографии не имели связи с индексами активности ASDASСОЭ, BASDAI и функционального состояния BASFI.
Иную картину мы получили при проведении корреляционного анализа во 2-й группе. У лиц без внеаксиальных проявлений АС ИММЛЖ и относительная толщина стенки левого желудочка прямо коррелировали с возрастом (r=0,39; р=0,003 и r=0,33; р=0,01 соответственно). Полученные результаты подтверждают аналогичные данные в публикациях различных авторов, где было доказано, что возраст играет роль в процессе ремоделирования миокарда. Так, по мнению Chahal N.S. et al., с возрастом происходит увеличение жесткости сосудистого русла, которое способствует повышению постнагрузки на миокард, формированию гипертрофии с увеличением интерстициального фиброза и индекса массы миокарда [12]. Относительная толщина стенки имела слабую прямую связь с индексом активности ASDASСОЭ (r=0,29; р=0,03) и обратно коррелировала с модулем максимального вектора (r=-0,33; р=0,04), т.е. сопровождалась снижением электрической активности миокарда на фоне повышения активности заболевания.
Любопытно, что оба значения Е/а как трансмитрального, так и транстрикуспидального кровотока в обеих группах имели обратную связь с возрастом (r=-0,5; р=0,0003 и r=-0,4; р=0,001 соответственно для 1-й группы; r=-0,34; р=0,01 и r=-0,35; р=0,01 соответственно для 2-й группы). В норме с увеличением возраста соотношение Е/а должно увеличиваться, тогда как в нашем исследовании у лиц с АС без внеаксиальных проявлений мы наблюдали обратную картину [13]. Иными словами, чем моложе пациент, тем выше у него склонность к развитию диастолической дисфункции обоих желудочков, причем это происходит на фоне менее выраженной гипертрофии миокарда, так как ранее нами было установлено, что с возрастом повышается масса миокарда и быстрее развивается гипертрофия.
Принимая во внимание тот факт, что в обеих группах были лица не только с внеаксиальными, но и внескелетными проявлениями АС, нами было принято решение выделить в каждой группе и сравнить между собой подгруппы без внескелетных проявлений. В соответствии с нумерацией каждой группы мы обозначили и выделенные подгруппы: 1-я (n=60) – лица с внеаксиальными и без внескелетных проявлений АС; 2-я (n=60) – лица без внеаксиальных и внескелетных проявлений АС.
Сравнительный анализ продемонстрировал, что площадь петли Р была выше в 1-й подгруппе, чем во 2-й: 19,9 [10,7; 44,9] и 11,7 [6; 22,7] мВ соответственно (р=0,003). Угол азимута в 1-й подгруппе был ниже, чем во 2-й: 59 [31; 74] и 76,5 [64; 81] соответственно (р=0,001). Также в 1-й подгруппе соотношение Е/а транстрикуспидального потока оказалось выше, чем во 2-й: 1,4 [1,25; 1,56] и 1,24 [1,16; 1,43] соответственно (р=0,046). Полученные результаты были аналогичны таковым при анализе групп вне зависимости от наличия внескелетных проявлений. Однако один параметр продемонстрировал различие после исключения лиц с внескелетными проявлениями. Речь о модуле максимального вектора: в 1-й подгруппе он оказался выше и составил 2312 [1710; 2941] мкВ, тогда как во 2-й он равнялся 1610 [1268; 2162] мкВ соответственно (р=0,003). Это свидетельствует о том, что внескелетные проявления также могут вносить вклад в развитие ремоделирования миокарда.
ЗАКЛЮЧЕНИЕ
Таким образом, у пациентов с АС развивается электрофизиологическое ремоделирование миокарда, имеющее свои особенности в зависимости от клинической формы основного заболевания. В частности, при АС с внеаксиальными проявлениями происходит повышение электрической активности предсердий, которое сопровождается нарушением диастолической функции правого желудочка. Также нами выявлено, что лица молодого возраста с АС больше подвержены развитию диастолической дисфункции обоих желудочков. Разобщенность параметров векторкардиографии и эхокардиографии указывает на то, что у лиц с АС утолщение миокарда происходит за счет электрически неактивной части. Это может быть связано с развитием фибротических процессов.



