Рассеянный склероз (РС) – прогрессирующее аутоиммунное воспалительное заболевание, которое привлекает внимание многих исследователей и занимает центральное место при изучении проблем демиелинизирующих заболеваний. За последние годы достигнуты существенные успехи в изучении механизмов демиелинизации и нейродегенерации, понимании роли иммунной системы в развитии РС, однако еще много вопросов не нашли своего решения; заболевание до настоящего времени является неизлечимым, а его лечение не всегда достигает ожидаемого эффекта [1, 2]. Клинические проявления РС отличаются выраженным полиморфизмом, они могут выявляться с различной частотой как в начале заболевания, так и в развернутой стадии.
Депрессивные расстройства у больных РС встречаются значительно чаще, чем в популяции в целом. В литературе имеются сведения о влиянии депрессии на активность течения заболевания, подтверждаемом данными магнитно-резонансно-томографического (МРТ) исследования [3]. Однако клинические формы депрессивных расстройств при различных типах течения РС недостаточно изучены.
Для лечения больных РС широко применяются препараты иммуномодулирующей терапии, что может влиять на течение РС при его сочетании с коморбидной аутоиммунной патологией. Актуальность изучения различных аспектов этого заболевания определяется его большой медико-социальной значимостью.
Цель исследования – изучить особенности течения РС с коморбидной аутоиммунной патологией щитовидной железы и депрессивными расстройствами.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 122 пациента с достоверным диагнозом РС по критериям McDonald (2010), из них 87 больных (60 женщин, 27 мужчин) с ремиттирующим типом РС (РРС), 35 (25 женщин, 10 мужчин) – со вторично-прогрессирующим типом РС (ВПРС). Средний возраст дебюта заболевания составил 32±5,5 лет, длительность течения РС – 8±2,5 года.
Больные были разделены на две группы, сопоставимые по полу и возрасту:
- 1-я группа – 72 больных РС без коморбидной патологии (61 пациент с РРС, 11 с ВПРС);
- 2-я группа – 50 больных РС с аутоиммунной патологией щитовидной железы (36 пациентов с РРС, 14 с ВПРС).
Дисфункция щитовидной железы у пациентов 2-й группы проявлялась гипотиреозом на фоне тиреоидита и узлообразования в виде клинических и субклинических форм.
Всем пациентам было проведено тестирование с использованием разработанной в Московском НИИ психиатрии Росздрава скрининговой анкеты для выявления расстройств аффективного спектра в общей медицинской практике, опросника психического состояния (в соответствии с рекомендациями ВОЗ для диагностики психических расстройств в первичной медицинской практике 2000 г., рекомендациями Минздрава России, Московского НИИ психиатрии Росздрава 2008 г.). В исследовании применяли шкалы Бека, самооценки депрессии, шкалы оценки тревожности Спилбергера–Ханина. Диагноз аутоиммунного заболевания щитовидной железы устанавливался эндокринологом.
 Всем больным выполнялось МРТ-обследование с использованием высокопольного томографа Siemens с мощностью магнитного поля 1,5 Тл. Исследовались очаги до и после введения контрастного вещества. Накопление очагами контраста расценивалось как признак активности. Степень выраженности функциональных расстройств больных РС оценивалась по шкале инвалидизации J. Kurtzke (EDSS) в баллах (табл. 1).
Всем больным выполнялось МРТ-обследование с использованием высокопольного томографа Siemens с мощностью магнитного поля 1,5 Тл. Исследовались очаги до и после введения контрастного вещества. Накопление очагами контраста расценивалось как признак активности. Степень выраженности функциональных расстройств больных РС оценивалась по шкале инвалидизации J. Kurtzke (EDSS) в баллах (табл. 1).
Скорость прогрессирования заболевания рассчитывалась как отношение показателей степени инвалидизации по шкале EDSS в баллах к длительности болезни в годах. Выделяли три варианта темпа прогрессирования РС (Малкова H.A., 1988):
- медленный – скорость прогрессирования <0,3 балла в год;
- умеренный – скорость прогрессирования 0,3–0,7 баллов в год;
- быстрый – скорость прогрессирования >0,7 балла в год.
Средний балл по шкале EDSS составлял 3,0. Состояние вегетативной дизрегуляции выявляли с помощью анализа вариабельности ритма сердца с регистрацией кардиоритмограммы (КРГ) в положении лежа и в условиях активной ортостатической пробы в соответствии с Рекомендациями рабочей группы Европейского кардиологического общества и Североамериканского общества стимуляции и электрофизиологии (1996) на аппарате «ВНС-Спектр» («Нейрософт», Иваново). Все пациенты РС применяли в рамках иммуномодулирующей терапии интерфероны-бета. Лечение проводилось согласно стандартам (Приказ Минздрава России от 24.12.2012 № 1542Н «Об утверждении стандарта первичной медико-санитарной помощи при рассеянном склерозе»).
Эффективность иммуномодулирующей терапии определялась с применением критериев NEDA-3 (критерии отсутствия активности РС) с последующим анализом данных средней частоты обострений (СЧО) в год, нарастания инвалидизации по шкале EDSS и появления новых очагов или очагов, накапливающих контраст при МРТ-исследовании с контрастным усилением гадолинием в Т2 (двух и более), или очагов, накапливающих контраст в Т1-режиме. Иммуномодулирующая терапия интерферонами-бета считалась эффективной, если у пациента не было обострений РС (или значительно снижалась СЧО), нарастания инвалидизации по EDSS и новых контрастных очагов на МРТ-изображениях (соответствие критериям NEDA-3).
До назначения иммуномодулирующей терапии исходный уровень СЧО у пациентов с РРС составлял 1,25±0,75 в год (от 0 до 2), при ВПРС – 2,54±1,45 (от 2 до 3).
Статистический анализ проводился с помощью программ Microsoft Excel, Statistiсa 6.0 на персональном компьютере. Использовались методы определения статистической значимости различий средних величин. В случаях с нормальным распределением признаков применялся t-критерий Стьюдента, корреляционный анализ осуществлялся по методу Спирмена. Все участники оформляли письменное добровольное информированное согласие на участие в исследовании.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате обследования больных РС в группах наблюдения было выявлено депрессивное расстройство различной частоты и степени выраженности;
- у пациентов 1-й группы с РРС – в 34,43% случаев, с ВПРС – в 81,82%;
- у пациентов 2-й группы с РРС – в 55,56% случаев, с ВПРС – в 100%.
 В 1-й группе исследования легкая форма депрессивного расстройства (10–15 баллов) встречалась у 60,0% пациентов, умеренная (16–19 баллов) – у 30,0%, тяжелая (>19 баллов) – у 10,0%. Во 2-й группе аналогичные показатели составили 35,29; 38,24 и 26,47%.
В 1-й группе исследования легкая форма депрессивного расстройства (10–15 баллов) встречалась у 60,0% пациентов, умеренная (16–19 баллов) – у 30,0%, тяжелая (>19 баллов) – у 10,0%. Во 2-й группе аналогичные показатели составили 35,29; 38,24 и 26,47%.
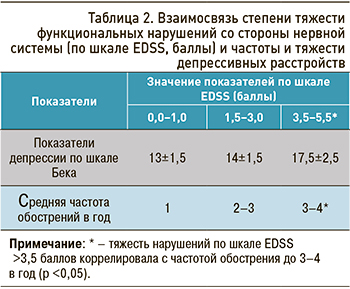
У больных РРС преобладала депрессия тревожного типа – 68,29%, у пациентов с ВПРС – меланхолического (41,86%) и ипохондрического (37,21%) типа. Усугубление выраженности расстройств по шкале EDSS протекало с нарастанием тяжести депрессивных расстройств и СЧО (табл. 2).
У больных РС с коморбидной аутоиммунной патологией щитовидной железы и депрессивными расстройствами были выявлены более выраженные пирамидные нарушения (2,8±1,0 баллов) в сравнении с показателями у больных РС 1-й группы (2,0±1,0 баллов) по шкале EDSS (p <0,05). Скорость прогрессирования РС во 2-й группе также была выше (0,4–0,7 баллов в год), чем в 1-й (0,3–0,5 баллов в год) (p <0,05). У больных РС с патологией щитовидной железы и депрессивными расстройствами отмечалось преимущественное поражение височных долей по данным МРТ.
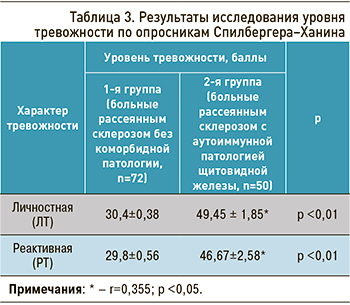 Исследование по опроснику Спилбергера–Ханина выявило достоверно более высокие показатели личностной и реактивной тревоги у больных РС 2-й группы (табл. 3).
Исследование по опроснику Спилбергера–Ханина выявило достоверно более высокие показатели личностной и реактивной тревоги у больных РС 2-й группы (табл. 3).
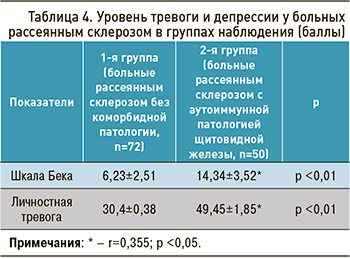
При исследовании уровня личностной тревоги и депрессии у больных РС 2-й группы установлена прямая корреляционная связь тяжести депрессивных расстройств с тревожными проявлениями (табл. 4).
В результате обследования вариабельности ритма сердца у больных с депрессивными расстройствами при КРГ установлены достоверные различия между 1-й и 2-й группами в выраженности вегетативной дисфункции. При сравнительном анализе соотношений быстрых и медленных волн у больных с коморбидной аутоиммунной патологией щитовидной железы установлена тенденция к более низким показателям, что характеризуется понижением общей мощности спектра (ОМС) и влияния вагальных и симпатических составляющих на модуляцию сердечного ритма с одновременным повышением гуморально-метаболических (эрготропных церебральных) влияний. Если ОМС в 1-й группе составила 1898,4±2,7 мс2/Гц, то во 2-й она понижалась до 958,6±4,7 мс2/Гц (p <0,001).
 У больных с депрессивными расстройствами во 2-й группе выявлена зависимость вегетативной дисфункции от степени выраженности инвалидизации: с нарастанием выраженности функциональных расстройств и повышением значений по шкале EDSS нарастал и процентный вклад волн VLF-диапазона. У больных с EDSS от 3,5 до 4,5 баллов вклад VLF-волн достигал 67±1,65% (p <0,001), с EDSS 2,0–3,0 балла – 48±0,75% (p <0,001), с EDSS 0,5–1,5 балла – 32±1,26% (p <0,001). Полученные данные свидетельствовали о наиболее высокой степени угнетения симпатико-парасимпатических влияний у больных 2-й группы с более выраженными показателями инвалидизации; у них отмечалась выраженная активизация эрготропных церебральных структур с переходом модулирующей регуляции сердечного ритма на гуморально-метаболический уровень, что характеризует более низкий вариант обеспечения гомеостаза и снижение реабилитационных возможностей организма.
У больных с депрессивными расстройствами во 2-й группе выявлена зависимость вегетативной дисфункции от степени выраженности инвалидизации: с нарастанием выраженности функциональных расстройств и повышением значений по шкале EDSS нарастал и процентный вклад волн VLF-диапазона. У больных с EDSS от 3,5 до 4,5 баллов вклад VLF-волн достигал 67±1,65% (p <0,001), с EDSS 2,0–3,0 балла – 48±0,75% (p <0,001), с EDSS 0,5–1,5 балла – 32±1,26% (p <0,001). Полученные данные свидетельствовали о наиболее высокой степени угнетения симпатико-парасимпатических влияний у больных 2-й группы с более выраженными показателями инвалидизации; у них отмечалась выраженная активизация эрготропных церебральных структур с переходом модулирующей регуляции сердечного ритма на гуморально-метаболический уровень, что характеризует более низкий вариант обеспечения гомеостаза и снижение реабилитационных возможностей организма.
Через 24 мес иммуномодулирующей терапии в 1-й группе исследования более низкий показатель СЧО в сравнении с исходным регистрировался в 65,57% случаев у пациентов с РРС и в 33,33% у больных с ВПРС. Обострений не было в 73,77% случаев у больных с РРС и в 27,27% у больных ВПРС. Нарастание инвалидизации не произошло, признаки активности РС при МРТ-исследовании установлены не были, что расценивалось как оптимальный ответ на иммуномодулирующую терапию.
В 26,23% случаев у больных РРС и в 61,62% случаев у больных ВПРС эффективность лечения оказалась ниже. СЧО составила 1,45±0,55 в год (от 0 до 2), средний балл по шкале EDSS имел тенденцию к повышению – 1,85±0,45. При МРТ-обследовании у всех больных определялись новые очаги на Т2, при обострениях РС среди уже имевшихся ранее очагов были очаги, накапливающие контраст в Т1-режиме. Это свидетельствовало о сохраняющейся активности РС у этих больных, хотя ее уровень был ниже исходного (расценено как субоптимальный ответ на иммуномодулирующую терапию). В 11,11% случаев при ВПРС отмечались повышение СЧО (1,65±0,54 от 2 до 4 раз в год), рост инвалидизации с EDSS до 2,75±1,75 (от 2 до 4,5), появление новых гиперинтенсивных очагов на Т2, что было расценено как отсутствие оптимального ответа на иммуномодулирующую терапию.
У больных 2-й группы через 24 мес иммуномодулирующей терапии показатели эффективности лечения по критериям NEDA-3 были достоверно ниже. При РРС оптимальный ответ был получен только в 40,00% случаев, субоптимальный – в 15,00%, отсутствие оптимального ответа на иммуномодулирующую терапию наблюдалось у 45% больных. При ВПРС оптимальный ответ на терапию был получен в 28,57% случаев, субоптимальный – в 14,29% случаев, отсутствие оптимального ответа отмечалось у 57,14% больных.
У больных 2-й группы с отсутствием оптимального ответа на иммуномодулирующую терапию длительность первой ремиссии была менее одного года, скорость прогрессирования РС – 0,74 балла в год. При этом выявлялись множественные очаги демиелинизации головного мозга, гипоинтенсивные очаги на Т1-ВИ («черные дыры»), признаки атрофии мозгового вещества при МРТ, высокие показатели личностной тревоги (≥45 баллов по шкале Спилбергера–Ханина) и депрессивных расстройств (17,5 5±2,5 баллов по шкале Бека), наличие неадекватного вегетативного обеспечения деятельности и снижение реабилитационного ресурса при обследовании ВРС со снижением ОМС менее 958,6±4,7 мс2/Гц.
ЗАКЛЮЧЕНИЕ
У больных с коморбидной аутоиммунной патологией щитовидной железы и депрессией установлена высокая активность и скорость прогрессирования РС, более выраженные неврологические нарушения, снижение адекватного вегетативного обеспечения деятельности и реабилитационного ресурса. Полученные данные могут характеризовать неэффективность применения иммуномодулирующей терапии и быть использованы для определения неблагоприятного прогноза патогенетического лечения РС.



