ВВЕДЕНИЕ
Модификация алгоритмов ведения пациентов с хронической сердечной недостаточностью (ХСН) признается актуальной темой для исследований на сегодняшний день. Это продиктовано увеличением распространенности синдрома, высокой смертностью и инвалидизацией среди пациентов данной группы [1]. Ключевым моментом в течении ХСН, в значительной степени влияющим на прогноз пациентов, является возникновение острой декомпенсации [2].
Под декомпенсацией ХСН понимают нарастание выраженности симптомов, указывающих на усиление гипоперфузии и застойных явлений, которые требуют увеличения объема проводимой терапии [3]. Отсюда следует, что контроль выраженности симптомов и даже серийная оценка показателей стандартного протокола эхокардиографического исследования для этой патологии не позволяют своевременно обеспечить профилактику декомпенсации ХСН, а только подтверждают ее наличие на момент обследования. Все это способствовало поиску новых методов, которые бы позволяли не только проводить первичную раннюю диагностику ХСН, но и эффективно контролировать течение синдрома. Одно из наиболее перспективных направлений в этой области – изучение биомаркеров ХСН.
До настоящего времени эталонным биомаркером ХСН считается N-концевой мозговой натрийуретический пропептид (N-terminal pro-brain natriuretic peptide, NT-proBNP). Данные о его уровне в сыворотке крови позволяют выполнять дифференциальную диагностику при подозрении на острую сердечную недостаточность, а также осуществлять мониторинг и контроль терапии при установленной ХСН [4]. Вместе с тем NT-proBNP как биомаркер диагностики и контроля при ХСН имеет ряд ограничений и недостатков в использовании, что закономерно побудило исследователей к поиску других биомаркеров, характеризующих различные звенья патогенеза ХСН [5]. Одним из таких веществ является растворимый супрессор туморогенности 2 (soluble suppression of tumorigenicity 2).
Цель исследования – оценить возможности использования растворимого супрессора туморогенности 2 (sST2) в качестве предиктора неблагоприятного течения ХСН.
МАТЕРИАЛ И МЕТОДЫ
Исследование являлось проспективным, одноцентровым, наблюдательным. Набор пациентов осуществлялся на базе БУЗ ВО «Воронежская городская клиническая больница скорой медицинской помощи № 1». Итоговая выборка состояла из 120 пациентов с диагнозом ХСН.
Критериями включения в исследование служили возраст пациента от 40 до 80 лет, а также наличие диагноза ХСН, установленного в соответствии с клиническими рекомендациями Минздрава России «Хроническая сердечная недостаточность» (2020). На момент включения в исследование пациенты имели стабильное течение этого заболевания.
В критерии невключения входили кардиомиопатии, ревматические и врожденные клапанные пороки сердца, стабильная стенокардия напряжения IV функционального класса (ФК), прогрессирующая стенокардия / инфаркт миокарда давностью <3 мес, персистирующая и постоянная формы фибрилляции предсердий, хроническая обструктивная болезнь легких стадий C и D, бронхиальная астма, хроническая болезнь почек стадии С3б и выше, анемия тяжелой степени, заболевания щитовидной железы с нарушением функции, цирроз печени, злокачественные новообразования.
План исследования был одобрен локальным этическим комитетом ФГБОУ ВО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава России. Все пациенты, включенные в выборку, подписали добровольное информирование согласие на участие в исследовании.
Характеристика включенных в исследование пациентов представлена в таблице 1.
На первом этапе исследования были проведены сбор жалоб и анамнеза, а также клинические и лабораторно-инструментальные методы обследования. Лабораторные диагностические методики включали общий и биохимический анализ крови, иммуноферментный анализ с определением уровней NT-proBNP, sST2 и тиреотропного гормона (ТТГ). Для определения уровня этих веществ в крови применялись наборы реактивов NTproBNP-ИФА-БЕСТ (Вектор-Бест, Россия), Presage® ST2 (Critical Diagnostics, США) и TSH TEST system (Monobind Inc, США) соответственно. В качестве инструментального метода обследования использовалась трансторакальная эхокардиография.
На втором этапе исследования, который был выполнен через 12 мес, были собраны данные о клиническом течении и исходах ХСН. Регистрировались случаи декомпенсации заболевания (нестабильного течения за период наблюдения), а также летальные исходы от всех причин.
Статистическая обработка данных проводилась с помощью программы программ STATGRAPHICS Centurion 18 (Statgraphics Technologies, Inc., США). Для проверки нормальности распределения данных оценивались значения эксцесса и асимметрии. Данные, которые имели нормальное распределение, приведены в виде выборочного среднего (М) ± стандартного отклонения (СО). В случае распределения, отличного от нормального, значения даны в виде медианы (Ме) и межквартильного размаха (interquartile range, IQR) между 25-м и 75-м процентилями. Категориальные данные представлены в процентах. Сравнение независимых групп осуществлялось с использованием критерия Краскела–Уоллеса и поправки Бонферрони. Связи между исследуемыми показателями оценивались с применением коэффициента Спирмена. Сила корреляционной связи указывалась согласно шкале Чеддока. Статистически значимыми считались значения p <0,05.
РЕЗУЛЬТАТЫ
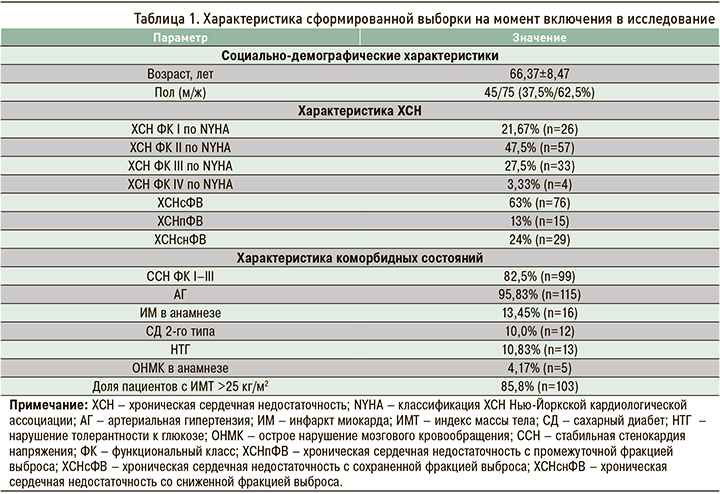
Медиана уровня sST2 в исследуемой выборке составила 32,15 [22,39; 38,59] нг/мл. После распределения пациентов на 4 группы в соответствии с ФК ХСН для каждой из этих групп были определены медианы уровней sST2 и произведено их сравнение. В группе, которую составили пациенты с I ФК ХСН, этот показатель оказался равен 24,72 [17,9; 34,38] нг/мл, в группе II ФК ХСН – 28,62 [20,84; 36,24] нг/мл, в группе III ФК медиана – 37,11 [31,2; 45,59] нг/мл. Наибольшее значение медианы sST2 было установлено в группе пациентов с IV ФК ХСН– 37,74 [32,14; 46,89] нг/ мл. Медианы уровней исследуемого биомаркера статистически значимо различались в группах (p=0,0002). Межгрупповые сравнения с поправкой Бонферрони позволили подтвердить различия по этому показателю между пациентами со II и III ФК ХСН. Частотные гистограммы распределения пациентов в группах по ФК ХСН и уровню sST2, представлены на рисунке 1.
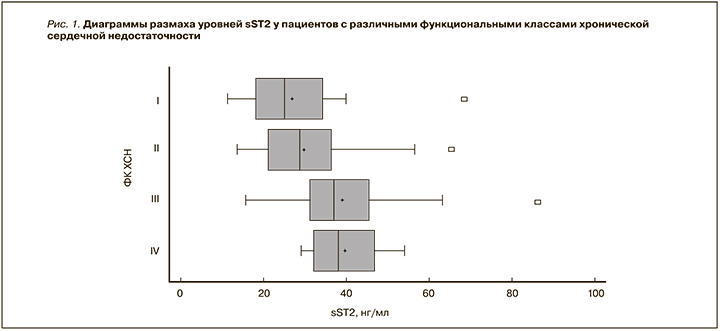
Корреляционный анализ уровней sST2 и NT-proBNP с другими исследуемыми показателями позволил установить ряд статистически значимых связей. Кроме того, была обнаружена очень слабая положительная статистически значимая корреляция между значениями sST2 и NT-proBNP (r=0,29, p=0,0018). Результаты корреляционного анализа представлены в таблице 2.
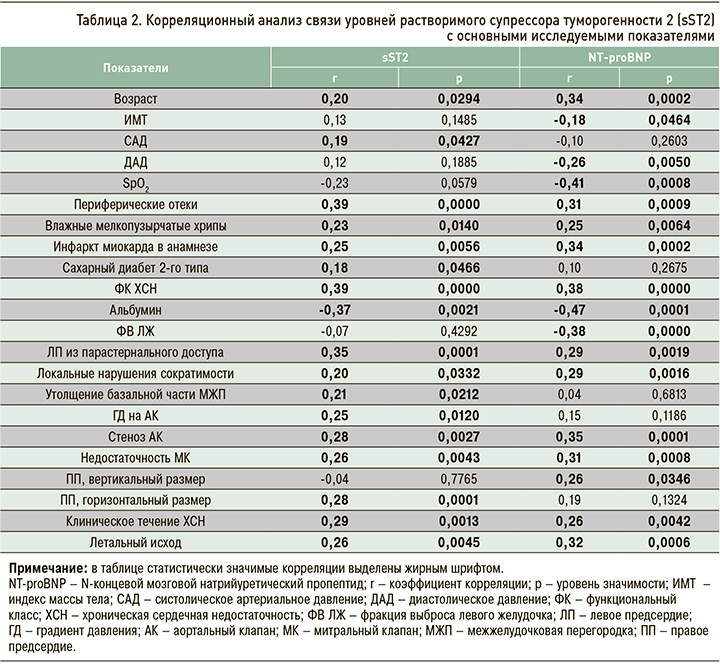
При анализе клинического течения ХСН за период наблюдения (12 мес) было выявлено стабильное течение синдрома у 45,83% исследуемых (n=55). Следовательно, периоды декомпенсации были зафиксированы у 54,17% пациентов (n=65). Как видно из рисунка 2, доля пациентов со стабильным течением синдрома убывала с возрастанием ФК ХСН.
Летальный исход возник у 5,83% исследованных пациентов (n=7).
На следующем этапе анализа данных пациенты были разделены на 4 группы по отношению к уровню sST2 при помощи медианы, верхнего и нижнего квартилей. В сформированных группах также было рассчитано абсолютное и относительное число пациентов с нестабильным течением ХСН и летальными исходами. Результаты этих расчетов представлены в таблице 3. Из указанных в ней данных следует, что наименьшее число случаев нестабильного течения ХСН и летальных исходов было зафиксировано у пациентов, находившихся в интервале наиболее низких значений sST2. По мере увеличения показателей этого биомаркера доля пациентов с неблагоприятными исходами ХСН возрастала и достигала своего максимума при уровне sST2, превышающем верхний квартиль.
ОБСУЖДЕНИЕ
Как было показано ранее, sST2 служит биомаркером, отражающим процессы воспаления, напряжения, гипертрофии и фиброза в сердечной мышце [6]. Поэтому повышение экспрессии этого вещества, которое может быть зафиксировано в сыворотке крови, позволяет судить о развитии указанных патологических процессов и, как следствие, о прогрессировании ХСН.
Оценка прогностических возможностей sST2 проводилась неоднократно в различных исследованиях. Имеются данные, подтверждающие роль sST2 как значимого предиктора декомпенсации, госпитализации и смерти при ХСН [7]. В других работах указывалось, что наибольшей прогностической силой sST2 обладает у пациентов III и IV ФК ХСН [8]. Однако, по другим данным, уровни этого биомаркера не были связаны с течением синдрома, но в то же время коррелировали с показателями качества жизни [9].
В представленном исследовании продемонстрировано увеличение доли пациентов с неблагоприятным течением ХСН по мере возрастания уровней sST2, которое также соответствовало повышению ФК ХСН.
Результаты, полученные в ходе корреляционного анализа, также согласуются с гипотезой о sST2 как предикторе декомпенсации и летального исхода при ХСН. На это указывают прямые корреляционные связи уровней исследуемого биомаркера и выбранных прогностических точек. Кроме того, прямые корреляции с проявлениями застойных явлений (периферические отеки, влажные мелкопузырчатые хрипы в легких) и обратная корреляция с показателем насыщения периферической крови кислородом подтверждают зависимость между увеличением содержания sST2 и нарастанием тяжести ХСН.
Следует также отметить отсутствие статистически значимой связи между показателями sST2 и фракцией выброса левого желудочка и наличием таковой связи у NT-proBNP. Это согласуется с результатами ряда исследований, которые указывают на сохранение прогностической силы sST2 вне зависимости от фенотипа ХСН, тогда как NT-proBNP не всегда позволяет адекватно оценить состояние больного ХСН с сохраненной фракцией выброса [10].
Факторами, усложняющими интерпретацию уровня NT-proBNP в крови, являются пожилой возраст и высокий индекс массы тела (ИМТ). Увеличение возраста связано с повышением значений этого биомаркера, а ожирение приводит к его снижению [11]. При этом sST2 менее чувствителен к повышению возраста и ИМТ исследуемой группы пациентов; более того, в некоторых работах было показано, что влияние этих параметров на уровни биомаркера отсутствует вовсе [12, 13]. Вероятно, что при выраженном ожирении экспрессия sST2 будет значительно повышаться [14]. Это объясняется эндогенным воспалением, которое развивается и прогрессирует в условиях ожирения и сопровождается повышением sST2 в крови. Патогенетическая связь рассматриваемого биомаркера также прослеживается при ряде других состояний, которые выступают факторами риска ХСН и одновременно служат причиной развития эндогенного воспаления. К ним относятся артериальная гипертензия и сахарный диабет 2-го типа [15].
ЗАКЛЮЧЕНИЕ
Медиана уровня sST2 в исследуемой выборке составила 32,15 [22,39; 38,59] нг/мл. В группе пациентов с I ФК ХСН этот показатель равнялся 24,72 [17,9; 34,38] нг/мл, со II ФК – 28,62 [20,84; 36,24] нг/мл, с III ФК – 37,11 [31,2; 45,59] нг/мл, с IV ФК – 37,74 [32,14; 46,89] нг/мл. Было показано увеличение доли пациентов с неблагоприятным течением ХСН по мере возрастания концентраций sST2, которое также соответствовало повышению ФК ХСН.
Полученные данные подтверждают возможности прогнозирования течения ХСН с помощью значений уровня sST2. Это, в свою очередь, может позволить оценивать риски неблагоприятного течения и эффективность применяемых методов терапии у пациентов данной группы.



