ВВЕДЕНИЕ
IgM РФ – чувствительный, но недостаточно специфичный маркер для диагностики ревматоидного артрита (РА), так как он может обнаруживаться не только при других ревматологических заболеваниях, но и при острых и хронических инфекциях, злокачественных новообразованиях, профессиональных заболеваниях и даже у здоровых лиц.
НЕСПЕЦИФИЧЕСКОЕ ПОВЫШЕНИЕ РЕВМАТОИДНОГО ФАКТОРА У ЗДОРОВЫХ ЛИЦ
Среди здоровых молодых людей неспецифическое повышение РФ встречается у 4% европеоидов, одинаково часто среди мужчин и женщин [1–3]. Самая высокая частота РФ-позитивности наблюдается среди североамериканских индейцев (до 30%), что, возможно, обусловлено генетическими и экологическими факторами [2]. В старшей возрастной группе повышенный уровень РФ отмечается значительно чаще. По обобщенным данным, РФ выявляется у 5% лиц в возрасте 60–70 лет и у 10–25% – старше 70 [4].
В старшем возрасте увеличение уровня РФ имеет место преимущественно при хронических заболеваниях. Полагают, что повышение РФ у пожилых людей может быть связано с возрастной дерегуляцией иммунных процессов [5].
Также известно, что уровни РФ у здоровых лиц и пациентов с РА отличаются. В первом случае этот биомаркер обнаруживается в низких или средних титрах и, по-видимому, вырабатывается CD5-экспрессирующими В-лимфоцитами. Такие антитела представляют собой полиреактивные IgM без каких-либо признаков матричного созревания. Транзиторная выработка подобных РФ может быть вызвана поликлональными активаторами В-лимфоцитов, такими как бактериальные липополисахариды и вирус Эпштейна–Барр. В то же время высокие титры РФ у здоровых лиц считают предикторами РА [3].
ПОВЫШЕНИЕ УРОВНЯ РЕВМАТОИДНОГО ФАКТОРА ПРИ ИНФЕКЦИОННЫХ ПОРАЖЕНИЯХ
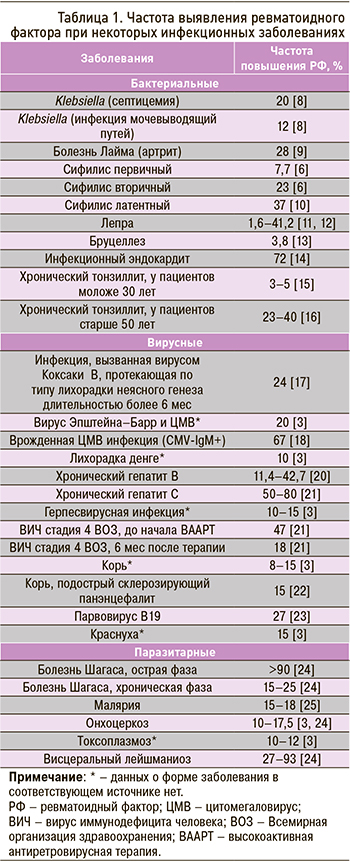
Транзиторное повышение РФ отмечается при многих инфекционных заболеваниях (табл. 1). Это свидетельствует о том, что B-лимфоциты с готовностью реагируют выработкой РФ на воздействие инфекционных триггеров. При этом одни микроорганизмы чаще вызывают его продукцию, чем другие. Так, РФ, как правило, не выявляется на фоне гриппа. Гораздо более важную роль, по-видимому, играет не столько сам патоген, сколько продолжительность его триггерного воздействия. Персистирующие микроорганизмы (например, вирусы, вызывающие латентную или хроническую инфекцию, либо бактерии, постоянно присутствующие в индивидуальной среде) очень привлекательны в качестве объяснения стойко повышенных титров РФ при таких заболеваниях, как РА, системная склеродермия и рассеянный склероз. В качестве потенциальных триггеров обсуждаются бактериальные липополисахариды, вирус Эпштейна–Барр, вирус гепатита С и другие патогены [3, 6].
Известно, что РФ повышает клиренс иммунных комплексов. Кроме того, В-лимфоциты, вырабатывающие РФ, способны функционировать как антигенпрезентирующие клетки и участвовать в развитии иммунного ответа на инфекционный антиген. Учитывая эти данные, высказывается предположение, что в случае инфекционных заболеваний продукция РФ носит защитный характер [8]. На сегодняшний день не ясно, почему в одних случаях РФ выполняют защитную функцию, способствуя элиминации патогена, а в других становятся частью аутоиммунного процесса. В целом известно лишь то, что защитную роль выполняют низкоаффинные РФ, а высокоаффинные РФ или РФ, способные формировать криоглобулины, вызывают патологические изменения [6].
ВИРУСНЫЕ ИНФЕКЦИИ
Вирусные гепатиты В и С
РФ нередко определяется у носителей вируса гепатита В. Среди бессимптомных носителей этого вируса он выявляется в 20% случаев, при этом частота РФ-позитивности в группе с нарушением функции печени достоверно выше, чем у пациентов без такового [26].
На фоне хронического вирусного гепатита С РФ обнаруживается в 50–80% случаев [27]. В ряде государств из-за высокой распространенности этого заболевания оно является самой частой причиной повышения РФ. Например, в странах Южной Европы инфицированность вирусным гепатитом С достигает 1,5–3%. Таким образом, при выявлении повышенного РФ целесообразно обследовать пациента на наличие этой инфекции.
Дифференциальная диагностика вирусного гепатита С и РА зачастую затруднительна, поскольку первый может сопровождаться артралгиями или артритами. Кроме того, у пациентов с вирусным гепатитом С, сопровождающимся артритом, повышение РФ наблюдается значительно чаще, чем у больных гепатитом C без артрита [27].
Предполагается, что появление РФ при вирусах гепатита В и С обусловлено хроническим раздражением иммунной системы персистирующим вирусом (хронической антигенной стимуляцией) [27]. Было установлено, что на фоне успешного лечения гепатита С титры РФ снижаются. Однако на сегодняшний день нет данных о конкретном протеине в структуре вируса гепатита С, вызывающем выработку РФ. Кроме того, у 70% пациентов с хроническим гепатитом С не отмечается устойчивого повышения уровня РФ [6].
Вирусные артриты
Считается, что примерно 1% всех острых артритов имеет вирусную этиологию. Суставные синдромы описаны в рамках острых вирусных гепатитов В и С, краснухи (в том числе как поствакцинальная реакция), инфекций, вызванных парвовирусом В19, вирусами Коксаки и ECHO, альфавирусами. В редких случаях возможно развитие острых артритов на фоне эпидемического паротита и герпесвирусных инфекций [28]. У пациентов с острыми вирусными артритами нередко выявляются различные аутоиммунные антитела (в том числе РФ) в низких титрах, что необходимо учитывать при проведении дифференциальной диагностики; в ряде случаев целесообразно выполнять вирусологические исследования [15].
Другие вирусные инфекции
На фоне ВИЧ-инфекции возможно появление низких титров РФ. По разным данным, такая картина наблюдается в 0–55% случаев [29]. По состоянию на 2021 г., в России зарегистрировано 1 528 356 ВИЧ-инфицированных человек [30].
Сведения о выявляемости РФ на фоне других вирусных инфекций отражены в таблице 1.
БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ
Сифилис
В 2016 г. в России показатель заболеваемости сифилисом составил 21,3 на 100 тыс. населения [31]. У пациентов с сифилисом РФ выявляется в 7–23% случаев, причем частота его обнаружения увеличивается пропорционально давности заболевания [10]. При латентном сифилисе частота выявления РФ достигает 37% [10], а у детей с врожденным сифилисом – 92% [32].
Лепра
В настоящее время число пациентов с лепрой в мире составляет 211 000, большинство из которых – жители Индии, Бразилии и Индонезии [33], а также восточной Африки, южных штатов США и Мексики [34]. В России зарегистрировано около 200 пациентов с лепрой, более 60% из которых – жители Астраханской области [35].
Клиническая картина лепры многообразна, она включает набор ревматологических фенотипов и выработку широкого спектра аутоиммунных антител [36, 37]. Этим объясняются значительные трудности дифференциальной диагностики у многих пациентов. В частности, известно, что в 75% случаев в рамках лепры развивается суставной синдром [36], в том числе симметричный полиартрит, а повышение РФ наблюдается в 1,6–41,2% [11, 12].
Бруцеллез
Глобальная распространенность бруцеллеза значительно варьирует, при этом на один зарегистрированный случай приходится 26 незарегистрированных. В России заболеваемость составляет 0,2–0,7 на 100 тыс. населения [38].
У 26% заболевших бруцеллезом развивается артрит [40], при этом повышение РФ среди них отмечается 3,8% случаев [13].
Туберкулез
Заболеваемость туберкулезом в России на 2017 г. достигала 48,3 на 100 тыс. населения [40].
У пациентов с активным легочным туберкулезом повышенный уровень РФ выявляется в 20–60% случаев [8, 41, 42]. Кроме того, в структуре заболевания возможен суставной синдром, картина которого в ряде случаев может напоминать РА. В сочетании с повышенным уровнем РФ это может создавать значительные диагностические трудности [8, 40].
ПАРАЗИТАРНЫЕ ЗАБОЛЕВАНИЯ
Повышение РФ нередко отмечается на фоне некоторых паразитарных болезней, что, вероятно, является защитным механизмом.
Малярия
Ежегодно в мире регистрируется около 200 млн больных малярией. В России это заболевание имеет завозной характер (100–200 случаев в год) [43].
Острая и хроническая малярия ассоциированы с выработкой большого количества аутоиммунных антител, в том числе РФ, который выявляется у 17,2% пациентов [25, 44].
В исследованиях in vitro было показано, что при внесении РФ в сыворотку человека, инфицированного малярией, повышается агглютинация шизонтов иммуноглобулинами G, а также замедляется выделение шизонтами мерозоитов. Полагают, что РФ, который определяется у некоторых пациентов в острой и хронической фазе малярии, способствует усилению клиренса плазмодиев [14, 45].
Болезнь Шагаса
Количество инфицированных трипаносомозом в мире составляет порядка 6–8 млн человек [46, 47].
Острая фаза болезни Шагаса характеризуется высокой паразитемией, а также высокими титрами РФ у большинства пациентов (>90%), которые сохраняются примерно в течение года. Хроническая стадия заболевания сопровождается низким уровнем паразитемии и непостоянным повышением РФ, которое выявляется примерно у 25% пациентов [24]. Также на животных моделях было показано, что наличие IgM РФ усиливало специфический IgG иммунный ответ в отношении Trypanosoma cruzi, предотвращая развитие заболевания в случае инфицирования [24].
Лейшманиоз
Ежегодно в мире возникает 1,3 млн новых случаев лейшманиоза [48]. В России регистрируются только единичные его завозные случаи [49].
При висцеральном лейшманиозе возможно повышение РФ, однако данные о частоте этого сильно разнятся (27–93%) [24].
Онхоцеркоз
В мире насчитывается 20,9 млн лиц, инфицированных O. Volvulus [50]. В России онхоцеркоз, как и другие филяриозы, регистрируется только как завозная патология [51].
При онхоцеркозе повышенный уровень IgM РФ выявляется в 10–17,5% случаев [3, 24].
Шистосомоз
В мире более 140 млн человек инфицированы шистосомами, из них 90% проживают в Африке. В России шистосомоз встречается только как завозная инфекция [51, 52].
РФ обнаруживается в 21% случаев шистосомоза с поражением почек. Предполагается, что РФ соединяется с циркулирующими иммунными комплексами, увеличивая их размер и уменьшая стабильность, и тем самым усиливает их элиминацию из кровотока [24].
Таким образом, повышенный уровень РФ нередко выявляется у пациентов с различными инфекционными заболеваниями. Это необходимо учитывать при проведении дифференциального диагноза, особенно в тех случаях, когда в структуре заболевания присутствует суставной синдром. Повышение РФ, как правило, носит преходящий характер и направлено на ускорение элиминации патогенов, а также на ограничение избыточного иммунного ответа путем облегчения клиренса антител и иммунных комплексов [7].
ВАКЦИНАЦИЯ И РЕВМАТОИДНЫЙ ФАКТОР
В начале 1960-х гг. впервые было показано преходящее повышение уровня РФ при введении здоровым лицам различных вакцин, в том числе от дифтерии, полиомиелита, ветряной оспы и эпидемического паротита [53].
На фоне вакцинации от столбняка к 7-му дню после вакцинации происходит повышение IgM- РФ в 1,5 раза от исходного уровня, а к 18-му – его снижение к исходному уровню [54]. Аналогичные данные получены и в исследовании, посвященном ревакцинации от столбняка. В нем выявлено повышение числа клеток, секретирующих IgM-РФ, при ревакцинации столбнячной вакциной с максимумом на 6-й день; к норме уровень этих клеток возвращался на 10-й день. Важно отметить, что сывороточный уровень РФ в данном исследовании не выходил за пределы референсного интервала. Согласно предположению авторов, такое явление связано с поликлональной активацией В-клеток, сходством антигенов токсина столбняка и IgG, что приводит к образованию кросс-реактивных антител с РФ-активностью или со специфическим иммунным ответом против IgG-покрытых иммунных комплексов [55].
Сходные данные были получены и для противотифозной вакцины [56]. В то же время не отмечалось повышения уровня РФ на фоне применения вакцин Регевак В (против гепатита В) и Пневмо-23 (против пневмококка) [57, 58]. В целом повышение РФ после различных видов вакцинации отмечается в 10–15% случаев [59].
В настоящее время широко исследуется синдром ASIA (аутоиммунный/воспалительный синдром, вызванный адъювантами). Он объединяет группу состояний, в основе которых лежит реакция иммунной системы на различные адъюванты [60]. В частности, у пациентов с синдромом ASIA, вызванным силиконовыми имплантатами молочных желез, повышенные уровни РФ встречаются в 4–11% случаев [61].
ПОВЫШЕНИЕ РЕВМАТОИДНОГО ФАКТОРА ПРИ НЕИНФЕКЦИОННЫХ НЕРЕВМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Саркоидоз
Распространенность саркоидоза в России варьирует от 8,2–73 на 100 тыс. населения; наиболее высокие показатели отмечаются в Карелии [62].
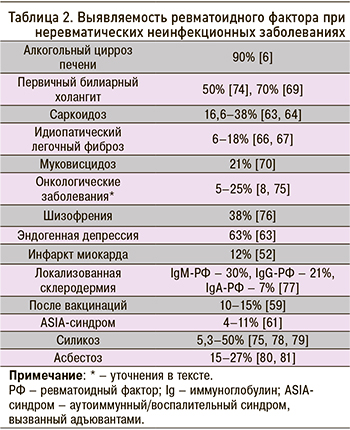
На фоне саркоидоза повышение РФ встречается у 16,6–38% пациентов [63, 64]. При этом РФ чаще выявляется в активной фазе заболевания, чем в ремиссии, а у женщин в два раза чаще, чем у мужчин. Кроме того, частота обнаружения РФ возрастает пропорционально давности заболевания и стадии легочного поражения [64].
Идиопатический легочный фиброз
Распространенность идиопатического легочного фиброза в России составляет около 9–11 случаев на 100 тыс. населения [65]. Повышенный уровень РФ выявляется у 6–18% пациентов с этим заболеванием [66, 67].
Первичный билиарный холангит
Глобальная распространенность первичного билиарного холангита варьирует от 19 до 402 случаев на 1 млн человек [68]. Повышение РФ выявляется у 70% пациентов [69].
Онкологические заболевания
Сведения о частоте выявления РФ при онкопатологии в основном представлены в ранних работах, основанных на малых выборках. Сообщается об обнаружении этого маркера у пациентов с множественной миеломой (4–18%) [70], лейкозами и лимфомами (4–19%) [71], болезнью Вальденстрема (10%) [7], переходноклеточным и плоскоклеточным раком мочевого пузыря (47 и 71% соответственно) [71], колоректальным раком (20%), раком желудка (20%) и поджелудочной железы (14,2%) [72], а также немелкоклеточным раком легких (26%) [73].
Роль РФ в патогенезе неопластического процесса не ясна и нуждается в глубоком изучении. С одной стороны, показано, что повышенный уровень РФ коррелирует с повышенным риском развития рака и рецидива опухоли, а также со сниженным ответом на противоопухолевую иммунотерапию. С другой стороны, секреция РФ может быть результатом регуляторно-искажающей активации B-клеток из-за хронического воспаления, осуществляемого присутствием самой опухоли, и в этом сценарии секреция РФ может служить дополнительным механизмом, используемым опухолью в ее воспалительной среде, чтобы избежать иммунного надзора [7].
Данные о частоте выявления РФ при неревматических неинфекционных заболеваниях суммированы в таблице 2.
РЕВМАТОИДНЫЙ ФАКТОР ПРИ ПРОФЕССИОНАЛЬНЫХ ЗАБОЛЕВАНИЯХ
Выявление РФ описано у пациентов с силикозом и асбестозом.
Силикоз развивается примерно у 0,2% из числа работников, длительно контактировавших с кремниевой пылью [82], однако существует мнение, что эти данные могут быть занижены [83]. У пациентов с силикозом РФ выявляется в 5,3–50% случаев [75, 77, 78, 84].
Частота обнаружения РФ у пациентов с асбестозом варьирует от 15 до 27% [79–81].
ИСКАЖЕНИЕ РЕЗУЛЬТАТОВ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ НА ФОНЕ РЕВМАТОИДНОГО ФАКТОРА
Таким образом, повышение РФ наблюдается при множестве разных заболеваний. В ряде случаев это может вызывать диагностические трудности, особенно если в клинической картине присутствует суставной синдром или другие ревматологические проявления. В то же время РФ может оказывать собственное влияние на процесс лабораторной диагностики ряда заболеваний, поскольку его присутствие в исследуемой сыворотке, особенно в высокой концентрации, может приводить к искажению лабораторных данных. Это наблюдается при использовании методов, основанных на реакции антиген–антитело. Искажение результатов может возникнуть вследствие так называемой гетерофильной интерференции, обусловленной гетерофильными антителами сыворотки человека. Это полиреактивные, человеческие антитела, взаимодействующие с антителами других видов, в том числе с Fc-фрагментом антител тест-системы. Гетерофильные антитела широко распространены в популяции; было показано, что среди госпитализированных пациентов они выявляются у 0,2– 15% [85]. Одним из таких гетерофильных антител является РФ.
Влияние гетерофильных антител чаще всего обнаруживается при иммуноферментном анализе (ИФА) типа «сэндвич» реже при конкурентном ИФА.
В системах с двумя антителами РФ способен соединять их без участия выявляемого антигена, что приводит к ложноположительному результату. В системах с одним антителом РФ связывается с антителом тест-системы, препятствуя его связыванию с антигеном, что влечет за собой ложноотрицательный результат теста [85]. В частности, описаны ложноположительные результаты теста на тропонин I, тиреоглобулин, лютеинизирующий гормон, фолликулостимулирующий гормон, пролактин, тиреотропный гормон, гонадотропный гормон у пациентов с высоким уровнем РФ [86]. Помимо этого, известно о возможности ложноположительных результатов при тестировании антигенов/антител к ВИЧ [87], антител к SARS-CoV-2 [88].
Показано, что интерференция с РФ может приводить к занижению уровня альфа-фетопротеина при оценке его уровня методом хемилюминесценции [89].
Существуют различные способы предотвращения искажающих эффектов РФ в отношении результатов лабораторных исследований: поэтапное удаление иммуноглобулинов, серийные разведения образца, использование реагентов, блокирующих гетерофилы и применение захватывающих и/или детектирующих антител, не свойственных млекопитающим [90, 91]. В последнее время большинство коммерческих наборов содержат реагенты, блокирующие гетерофильные антитела, однако в связи с их разнообразием предотвращение искажающего эффекта не гарантировано, поэтому при необходимости рекомендуется повторить тест, используя другой тип анализа [85].
ЗАКЛЮЧЕНИЕ
Итак, повышение уровня РФ может наблюдаться не только при ревматических, но и неревматических заболеваниях. Среди них различные инфекционные процессы, онкологические, аутоиммунные, профессиональные и другие поражения, что необходимо учитывать при получении у пациента положительного результата на РФ. Кроме того, повышение РФ возможно у здоровых лиц, прежде всего в пожилом возрасте.
Наибольшие трудности дифференциального диагноза отмечаются при заболеваниях, в структуре которых возможно сочетание повышенного уровня РФ и ревматоидоподобного суставного синдрома (бактериальный эндокардит, гепатиты В и С, саркоидоз, первичный билиарный холангит, злокачественные новообразования, сифилис, проказа, туберкулез, бруцеллез, острые вирусные инфекции). Среди неревматических заболеваний следует обратить особое внимание на вирусные гепатиты, при которых частота выявления РФ значительна, что учитывается в некоторых алгоритмах диагностики при повышении этого биомаркера.



