В рамках коморбидности сахарный диабет (СД) 2 типа остается одним из наиболее важных неинфекционных заболеваний ввиду большого разнообразия сопутствующей соматической патологии у таких пациентов, высокой частоты встречаемости, неуклонного роста числа больных [1]. По прогнозам Международной федерации диабета (IDF), при сохранении нынешних темпов прироста заболеваемости число пациентов с СД к 2045 г. превысит 628,6 млн человек [2]. Это связано с увеличением возраста населения, эскалацией процесса урбанизации, увеличением распространенности среди населения гиподинамии, неправильного питания и других факторов риска. Так, распространенность метаболического синдрома (МС), по современным данным, в 2 раза превышает распространенность СД, и в ближайшие 25 лет ожидается увеличение темпов его роста на 50% [3]. Наличие у пациентов инсулинорезистентности приводит к выраженным дисметаболическим нарушениям, что в последующем сопровождается развитием СД 2 типа, гипертонической болезни, атеросклероза сосудов и ряда других заболеваний, что во многом определяет высокий уровень коморбидной сердечно-сосудистой патологии у этой категории пациентов [4].
ЭПИДЕМИОЛОГИЯ САХАРНОГО ДИАБЕТА 2 ТИПА И ЕГО КАРДИОВАСКУЛЯРНЫХ ОСЛОЖНЕНИЙ
Согласно оценкам экспертов, реальная распространенность СД 2 типа у взрослого населения России в 2 раза превышает зарегистрированную и составляет 5,4% – таковы данные эпидемиологического исследования NATION, проведенного Эндокринологическим научным центром за период 2013–2015 гг. [5]. По результатам другого исследования – ЭССЕ-РФ – 10-летний риск развития СД 2 типа в российской популяции, в соответствии с критериями FINDRISC, равен 5,3% (4,4% у мужчин и 5,7% у женщин). При этом сердечно-сосудистые заболевания (ССЗ) у пациентов с СД 2 типа служат наиболее частой причиной летальных исходов и ранней инвалидизации. Подавляющее число пациентов с СД 2 типа (до 75–80%) умирают от сердечно-сосудистых осложнений (ССО). Например, ожидаемая продолжительность жизни 60-летнего мужчины с СД 2 типа на 6–12 лет меньше, чем у его сверстника, не страдающего этим заболеванием, главным образом за счет увеличения на 58% риска сердечно-сосудистой смерти.
Компоненты метаболического синдрома оказывают прямое влияние на уровень коморбидной патологии у пациентов с СД 2 типа. В общей структуре коморбидности у больных СД 2 типа преобладают заболевания центральной и периферической нервной системы, сердечно-сосудистой и мочеполовой системы. С возрастом у пациентов с СД 2 типа происходит повышение среднего балла «индекса коморбидности», определенного по системам CIRS, Kaplan-Feinstein, Charlson, и соответственно увеличение уровня сопутствующей патологии. У 76% исследуемых пациентов имеются неблагоприятные прогностические показатели риска летального исхода в течение ближайшего года и 10-летней выживаемости, которые отмечены в 100% случаев в возрастных группах старше 60 лет [6].
При изучении структуры коморбидности у пациентов амбулаторно-поликлинического регистра кардиоваскулярных заболеваний в одном из регионов России (РЕКВАЗА) в 2019 г. были получены данные о встречаемости ССЗ среди лиц с инициальными нарушениями углеводного обмена (нарушенной гликемией натощак, нарушенной толерантностью к глюкозе) и установленным диагнозом СД 2 типа в сравнении с пациентами, имеющими нормогликемический профиль (рис. 1). Отмечено, что, по данным многолетних наблюдений, у больных СД 2 типа сохраняется стабильно более высокая частота постинфарктного кардиосклероза (12,4%), острого нарушения мозгового кровообращения (12,0%) и ишемической болезни сердца (58,4%) [7].
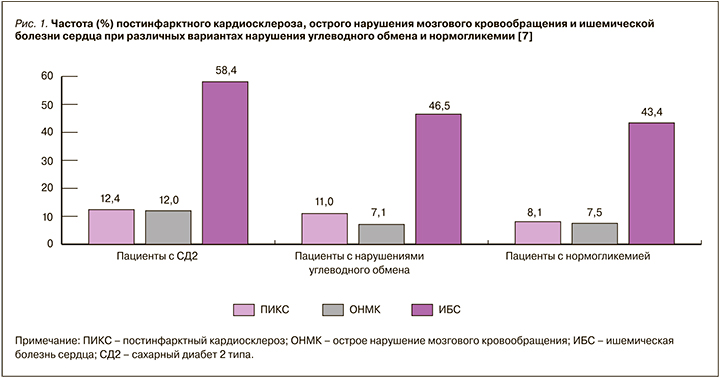
Следует подчеркнуть, что в этом же исследовании ожирение встречалось у 18,6% пациентов общей когорты (1000 пациентов с кардиоваскулярной патологией, отобранных методом случайной выборки): в 52,7% случаев оно выявлялось в группе пациентов с СД 2 типа, в 38,4% – у больных с нарушениями углеводного обмена и только в 8,6% – у пациентов с нормальным гликемическим профилем.
За последние годы у пациентов с ССЗ и СД 2 типа улучшился контроль за гликемией, артериальным давлением (АД) и показателями липидного профиля, что привело к значительному сокращению ССО и микрососудистых осложнений, повысило продолжительность жизни населения. Так, по данным Федерального регистра Российской Федерации (2013–2016), отмечено существенное снижение случаев ишемической болезни сердца (ИБС) при СД 1 типа с 14,9 до 3,5%, при СД 2 типа – с 20,1 до 11,7%; инфаркта миокарда (ИМ) при СД 1 типа – с 5,7 до 1,3%, при СД 2 типа – с 7,6 до 3,5%; цереброваскулярных заболеваний при СД 1 типа – с 4,9 до 1,7%, при СД 2 типа – с 7,6 до 4,3% соответственно [8]. Вместе с тем более 50% больных СД 2 типа в настоящее время по-прежнему не достигают целевых уровней гликемии, что требует пересмотра тактики врачей, особенно амбулаторного звена, при лечении таких пациентов.
В соответствии с отечественными и международными клиническими рекомендациями для улучшения качества терапии и достижения целевых показателей у пациентов СД 2 типа крайне важно обеспечить условия для своевременного принятия решения о начале лечения пациента с сопутствующими ССЗ с применением противодиабетических препаратов, рекомендуемых для снижения сердечно-сосудистого риска.
Возможности достижения хорошего контроля гликемии, особенно при использовании «традиционных» противодиабетических препаратов у пациентов с СД 2 типа, ограничены ухудшающейся функцией β-клеток с постепенным ухудшением показателей гликемии. Это создает предпосылки для прогрессирования поздних диабетических осложнений. Даже раннее начало инсулинотерапии в таких случаях не позволяет достичь снижения риска ССО и связано с большой частотой гипогликемии и увеличение массы тела, которые провоцируют возрастание числа острых сердечно-сосудистых событий.
В настоящее время наибольшее внимание привлекают сахароснижающие препараты, реализующие концепцию «многоцелевой» терапии: они позволяют не только адекватно контролировать углеводный обмен при минимальном риске развития гипогликемий, но и обладают внегликемическими эффектами в виде дополнительного снижения массы тела, АД и улучшения показателей липидного спектра. Следовательно, приоритетными факторами при выборе сахароснижающих средств при лечении пациентов с ССЗ и СД 2 типа служат не только их эффективность и безопасность для пациента (как краткосрочные, так и отдаленные), но и способность положительно влиять на кардиоваскулярные факторы риска, а также улучшать клинические исходы (смертность, частоту инфарктов, инсультов, госпитализаций и др.).
САХАРНЫЙ ДИАБЕТ 2 ТИПА КАК ОСНОВНОЙ ФАКТОР КАРДИОВАСКУЛЯРНОГО РИСКА
По данным крупных популяционных исследований (Фрамингемское исследование, MRFIT, Paris Prospective Study), СД выступает независимым фактором риска ССЗ. Угроза ССО и смертности при СД в 2–5 раз превышает популяционный риск даже в отсутствие классических факторов риска, таких как артериальная гипертензия, гиперлипидемия и курение. Это объясняется развитием специфического поражения миокарда – диабетической кардиомиопатии вследствие макро- и микрососудистых осложнений диабета.
СД значительно повышает сердечно-сосудистую заболеваемость и частоту ССО: относительный риск ИБС возрастает в 2 раза, коронарной смерти – в 2,31 раза, нефатального ИМ – в 1,82 раза, ишемического инсульта – в 2,27 раза [9]. Все это указывает на наличие специфических, ассоциированных с СД факторов риска, требующих углубленного изучения и оптимизации лечебной тактики.
Важнейшим фактором риска развития ССО у пациентов СД 2 типа служит хроническая гипергликемия. Результаты крупных зарубежных проспективных исследований DCCT (Diabetes Control and Complications Trial) и EDIC (The Epidemiology of Diabetes Interventions and Complications Research Study) на популяции пациентов СД 1 типа продемонстрировали, что снижение уровня гликированного гемоглобина (HbA1c) сопровождается снижением риска специфических микрососудистых осложнений. Раннее улучшение гликемического контроля с помощью интенсификации схем инсулинотерапии сопровождается уменьшением угрозы развития и прогрессирования диабетических ангиопатий [10]; этот эффект получил название «положительная метаболическая память». Результаты исследований показали, что важно не только обеспечить снижение уровня глюкозы до целевых уровней, но также предупредить развитие гипогликемий и значительной вариабельности уровня глюкозы в крови, поскольку указанные состояния инициируют окислительный стресс, хроническое воспаление, дисфункцию эндотелия и играют важную роль в развитии диабетических осложнений. Известно, что снижение уровня HbA1c примерно на 1% у пациентов СД 2 типа приводит к уменьшению частоты развития ИМ на 14%, а общей летальности – на 21%. Напротив, повышение этого показателя на 1% способствовало увеличению сердечно-сосудистой заболеваемости на 18% [11]. Высокая вариабельность уровня гликемии выступает независимым предиктором усугубления коронарного атеросклероза и повышает вероятность развития желудочковых аритмий у пациентов с СД 2 типа [12].
Показано, что наличие СД 2 типа у больных ИБС приводит к достоверному повышению уровня трансформирующего фактора роста фибробластов (TGFβ1), а также маркеров неспецифической воспалительной реакции интерлейкина-6 (IL-6) и С-реактивного белка (СРБ) в артериальной и венозной крови. Установлена тесная взаимосвязь уровня TGFβ1 с показателями липидного обмена (холестерином липопротеинов низкой плотности (ЛПНП) и триглицеридами (ТГ) крови), а также между степенью поражения коронарных сосудов и уровнем провоспалительных факторов и конечных продуктов гликирования в зависимости от наличия СД. Полученные данные подтверждают взаимосвязь нарушений со стороны соединительной ткани, углеводного и липидного обмена в патогенезе атеросклероза у пациентов с СД 2 типа [13, 14].
Вместе с тем строгий контроль гликемии у пациентов высокого кардиоваскулярного риска с длительно протекающим СД 2 типа может ухудшать прогноз этих пациентов (исследования ACCORD, ADVANCE, VADT), особенно при терапии препаратами, способными увеличивать частоту гипогликемий (препараты сульфонилмочевины, инсулин). Это потребовало установления индивидуальных целевых значений гликемии для пациентов СД 2 типа в глобальных алгоритмах управления гликемией, начиная с 2012 г.
Исходя из вышеизложенного, можно сделать вывод, что «золотым стандартом» профилактики развития и прогрессирования кардиоваскулярной патологии при СД 2 типа является своевременное начало терапии с применением препаратов, обес-печивающих длительное поддержание стабильного гликемического профиля, наиболее близкого к физиологическому, при минимальном риске гипогликемий, а также в отсутствие негативных эффектов на сердечно-сосудистую систему. Пересмотр базовых подходов к терапии СД 2 типа в новом совместном алгоритме ADA/EASD (2018) рекомендует в лечении пациентов с ССЗ применять препараты класса ингибиторов натрий-глюкозного ко-транспортера 2-го типа (иНГЛТ-2) или агонистов рецептора глюкагоноподобного пептида 1 (аГПП-1). Кроме надежного антигипергликемического действия, они обладают кардио- и нефропротективными свойствами [15].
ГЛИКЕМИЧЕСКИЕ И НЕГЛИКЕМИЧЕСКИЕ ЭФФЕКТЫ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА 1
Инкретины в настоящее время, наряду с метформином, рассматривают как возможные препараты первой линии в стартовой терапии СД, в том числе в комбинации с другими антигипергликемическими препаратами [16]. Активация рецепторов ГПП-1 приводит к стимуляции глюкозозависимой секреции инсулина β-клетками, подавляет глюкозозависимую секрецию глюкагона, снижает массу тела преимущественно за счет висцеральной жировой ткани, усиливая (через центральные механизмы) чувство насыщения и повышая расход энергии.
В настоящее время известно, что ГПП-1 потенцирует функцию β-клеток поджелудочной железы, стимулируя транскрипцию гена инсулина, а также экспрессию мРНК внутриклеточных транспортеров глюкозы – глюкокиназы и GLUT2, обеспечивающих периферическую утилизацию глюкозы. Он усиливает глюкозозависимую секрецию инсулина, подавляет апоптоз β-клеток, активируя их гипертрофию и пролиферацию (на животных моделях), а также повышает их дифференцировку и неогенез из эпителиальных клеток-предшественников, что сопровождается увеличением массы β-клеток. Кроме того, ГПП-1 снижает секрецию глюкагона через прямое воздействие на панкреатические α-клетки, в том числе за счет увеличения секреции соматостатина, что приводит к снижению выделения глюкозы из печени [17].
Рецепторы ГПП-1, помимо β-клеток поджелудочной железы, обнаружены в нервной системе, эндотелиальных клетках, макрофагах и кардиомиоцитах [18]. Фермент дипептидилпептидаза-4 (ДПП-4) расщепляет нативный ГПП-1, а его ингибиторы увеличивают продолжительность действия ГПП-1. В связи с этим предполагалось, что воздействие аГПП-1 на эти рецепторы может оказывать благоприятное влияние на сердечно-сосудистую систему, а ингибиторы ДПП-4 исследовались на предмет кардиопротективного эффекта. Инкретинонаправленная терапия, включающая агонисты ГПП-1 и ингибиторы ДПП-4, продолжает тщательно изучаться с позиции предупреждения развития и прогрессирования ССО у пациентов с СД 2 типа.
Накопленные к настоящему времени результаты клинических и экспериментальных исследований позволяют говорить о целом ряде плейо-тропных эффектов инкретиномиметиков на сердечно-сосудистую систему. В экспериментальных исследованиях показано, что ГПП-1 при СД оказывает эндотелиопротективное, а при ишемически-реперфузионном поражении миокарда кардиопротективное действие. Также установлена связь рецептора ГПП-1 с важнейшими внутриклеточными сигнальными каскадами (через активацию протеинкиназы A и B), посредством чего реализуется влияние этого регуляторного фактора на функционирование, а также процессы апоптоза и регенерации клеток-мишеней [19]. Результаты экспериментальных и клинических работ свидетельствуют о том, что протективный эффект ГПП-1 в отношении эндотелиоцитов может реализоваться путем активации эндотелиальной синтазы оксида азота, подавления фактора некроза опухолей альфа (ФНО-α), ингибитора активатора плазминогена-1, различных ростовых факторов и молекул адгезии (eNOS) [20].
АГОНИСТЫ РЕЦЕПТОРОВ ГПП-1: ОБЩИЕ СВОЙСТВА
В настоящее время в клинической практике используются лекарственные препараты из класса аГПП-1, которые можно условно разделить на препараты короткого (имеющих разные периоды полувыведения, но требующие введения 1–2 раза/сут) и длительного действия, кратность введения которых составляет 1 раз в неделю.
Все препараты класса аГПП-1 характеризуются глюкозозависимой стимуляцией секреции инсулина в сочетании с угнетением секреции глюкагона, а также усилением чувства насыщения в течение длительного времени после приема пищи. При монотерапии пациентов СД 2 типа препараты этой группы демонстрируют низкий риск гипогликемии, способность уменьшать массу тела, а также снижать риск развития сердечно-сосудистых и почечных событий.
К особенностям аГПП-1 короткого действия относятся более выраженное замедление опорожнения желудка и преимущества в отношении контроля постпрандиальной гликемии. Агонисты ГПП-1 длительного действия в целом характеризуются более высокой эффективностью контроля над гликемией и достижения целевых показателей HbA1c. Также они снижают колебания постпрандиальной гликемии, для некоторых препаратов характерно улучшение конечных показателей в первичной конечной точке МАСЕ и уменьшение выраженности альбуминурии. Кроме того, аГПП-1 длительного действия более эффективно уменьшают уровень тощаковой гликемии, чем коротко действующие препараты.
В целом применение в клинической практике препаратов из группы аГПП-1 характеризуется хорошей переносимостью и низкой частотой нежелательных явлений. К последним в основном относятся тахикардия и различные диспепсические явления, такие как тошнота, дискинезия желчевыводящих путей. В редких случаях отмечены случаи развития острого панкреатита. При назначении терапии следует проводить обучение пациентов, а также учитывать, что хронические заболеваниях почек могут быть для отдельных представителей класса причиной корректировки дозы либо отмены препарата [21].
КАРДИОВАСКУЛЯРНЫЕ ЭФФЕКТЫ АГОНИСТОВ РЕЦЕПТОРОВ ГПП-1: ВЛИЯНИЕ НА ТОЛЕРАНТНОСТЬ К ИШЕМИИ МИОКАРДА
Многочисленные исследования показали, что нативный ГПП-1 и аГПП-1 обладают прямым воздействием на миокард [25]. ГПП-1 непосредственно регулирует деятельность сердечно-сосудистой системы путем активации специфических рецепторов ГПП-1, а также с помощью ГПП-1 (9–36 амид), который представляет собой кардиоактивный метаболит, образующийся при опосредованном расщеплении молекулы ГПП-1 ферментом ДПП-4.
Взаимодействие ГПП-1 со специфичным рецептором приводит к увеличению потребления глюкозы кардиомиоцитами и усилению контрактильности миокарда [23]: это способствует увеличению потребления глюкозы кардиомиоцитами и влечет за собой опосредованное увеличение коронарного кровотока. Проведенные экспериментальные исследования позволили подтвердить прямое кардиопротективное влияние ГПП-1 (опосредованное через аГПП-1) на миокард в состоянии ишемии [24, 25]. При этом установлено, что эффекты прямого влияния эксендина-4 на миокард не были сопоставимы по мощности с таковыми при введении нативного ГПП-1, что, вероятнее всего, связано с высокой резистентностью к деградации под действием ДПП-4 [6]. В недавних экспериментальных исследованиях было показано влияние ГПП-1 на ишемическую дисфункцию миокарда при СД. Так, назначение мышам с СД аналога ГПП-1 лираглутида в течение 7 дней сопровождалось значительным уменьшением размера инфаркта и частоты разрыва сердца после ИМ [27].
У пациентов, преимущественно без СД 2 типа с острым ИМ, перенесших баллонную ангиопластику со стентированием, на фоне введения ГПП-1 было продемонстрировано значительное (на 11%) улучшение фракции выброса левого желудочка (ФВ ЛЖ) на фоне снижения на 21% индекса локальной сократимости по сравнению с группой контроля [28].
Болюсная инфузия ГПП-1 за 30 мин до стресс-эхокардиографии с добутамином предотвращала развитие постишемической дисфункции миокарда, а у пациентов, перенесших плановое чрескожное коронарное вмешательство, инфузия ГПП-1 (1,2 пмоль/кг/мин) улучшала диастолическую и систолическую функцию ЛЖ в момент окклюзии коронарной артерии баллоном [29].
Введение эксенатида пациентам с острым ИМ (с СД 2 типа и без него) в течение 132 мин после восстановления кровотока в ишемизированных участках путем баллонной ангиопластики способствовало уменьшению окончательного размера зоны инфаркта через 3 мес наблюдения, при этом не было отмечено изменения других гемодинамических параметров. Кардиопротективное действие эксенатида наблюдалось независимо от уровня гликемии у пациентов как с наличием, так и отсутствием СД [30]. Также через 1 мес наблюдалось уменьшение инфарктной зоны при ИМ с подъемом сегмента ST у пациентов, получавших эксенатид подкожно 10 мкг в течение 5 мин после чрескожного коронарного вмешательства, и далее по 10 мкг 2 раза/сут в течение последующих 2 дней [31].
ВЛИЯНИЕ АГОНИСТОВ РЕЦЕПТОРОВ ГПП-1 НА СЕРДЕЧНУЮ НЕДОСТАТОЧНОСТЬ
Клинические исследования показали благоприятное влияние ГПП-1 на течение хронической сердечной недостаточности (ХСН), несмотря на то что эти данные также ограничены отсутствием доказательных сведений о преобладании прямых или опосредованных эффектов аГПП-1 на сердце. Уже ясно, что нативный ГПП-1 действует через свой метаболит ГПП-1 (9–36 амид), способствуя улучшению коронарного кровотока. Однако пока нет надежных данных о том, что полученные эффекты реализуются через стимуляцию аГПП-1 в гладкомышечных клетках коронарных сосудов или в предсердиях и каковы будут последствия длительного воздействия на миокард ГПП-1 в условиях сердечной недостаточности [32].
Длительное применение (в течение 5 нед) ГПП-1 как у больных СД 2 типа, так и лиц без этого заболевания на фоне ХСН III и IV функциональных классов (по NYHA) способствовало значимому повышению ФВ ЛЖ, потребности миокарда в кислороде, улучшению функционального состояния миокарда, а также сопровождалось улучшением качества жизни пациентов по результатам опросника Minnesota Living with Heart Failure Quality of Life (MNQOL) [33].
ВЛИЯНИЕ АГОНИСТОВ РЕЦЕПТОРОВ ГПП-1 НА ЭНДОТЕЛИАЛЬНУЮ ДИСФУНКЦИЮ, СОСУДИСТУЮ СИСТЕМУ И КЛЕТОЧНУЮ ПРОЛИФЕРАЦИЮ
Известно, что эндотелиальная дисфункция с последующим воспалением и выработкой цитокинов лежит в основе развития атеросклероза, главного субстрата ССЗ.
В экспериментальных работах было продемонстрировано, что ГПП-1 обладает прямым дозозависимым сосудорасширяющим эффектом.
В эксперименте при применении миметика ГПП-1, эксендина-4, также наблюдалось расширение аорты у крыс, однако величина ответа была намного меньше, чем это наблюдалось при введении нативного ГПП-1. Назначение лираглутида мышам с эндотелиальной дисфункцией и атеросклерозом сопровождалось улучшением функции эндотелия [34]. Длительное введение нативного ГПП-1 и эксендина-4 грызунам с СД ассоциировано с восстановлением дисфункции эндотелия, а у крыс с сердечной недостаточностью приводило к значительному увеличению сердечного выброса за счет периферической вазодилатации [35].
Обработка эндотелиальных клеток пупочной вены человека лираглутидом [36], а также коронарных артерий человека ГПП-1 и эксендином-4 [37] приводила к увеличению фосфорилирования эндотелиальной NO-синтазы и соответственно к повышению продукции оксида азота (NO). Кроме того, ГПП-1 и лираглутид вызывали уменьшение экспрессии генов воспаления, таких как молекула адгезии сосудистого эндотелина-1, снижали уровни ФНО-α и конечных продуктов гликирования, тем самым уменьшая выраженность оксидативного стресса.
Недавно установлено, что эксендин (9–39) и нативный ГПП-1 оказывают воздействие преимущественно на эндотелиальные клетки посредством активации путей передачи сигнала, активизируемых ГПП-1 (9–36 амид) или его метаболитом ГПП-1 (28–36 амид) [38]. Эта гипотеза была подтверждена в эксперименте на мышах, лишенных аГПП-1, в котором вазодилатация наблюдалась в ответ на введение нативного ГПП-1 и ГПП-1 (9–36 амида) [26].
В рандомизированном исследовании при оценке функции эндотелия у пациентов с нарушением толерантности к глюкозе и впервые выявленным СД 2 типа [39] показано, что использование даже одной дозы эксенатида приводило к значительному повышению функции эндотелия в постпрандиальном периоде по сравнению с плацебо. Аналогичные результаты были получены в других наблюдениях, в которых болюсное введение ГПП-1 приводило к эндотелийзависимой вазодилатации артерий предплечья у здоровых добровольцев [24] и у пациентов с СД 2 типа в сочетании со стабильной ИБС [40].
Исходя из имеющихся данных доклинических и клинических исследований, был сделан вывод, что влияние ГПП-1 опосредуется действием ГПП-1 (9–36 амида) или сопутствующими продуктами его метаболизма, которые оказывают вазодилатирующий эффект независимо от влияний на рецепторы ГПП-1.
Помимо воздействия на миокард и эндотелиальные клетки, ГПП-1 может также оказывать влияние на развитие атеросклероза путем прямого воздействия на моноциты или макрофаги. Активные метаболиты ГПП-1 и гастроинтестинального пептида (ГИП) подавляют продукцию моноцитов и их адгезию в сосудистых эндотелиальных клетках, проникновение моноцитов/макрофагов через сосудистую стенку, трансформацию макрофагов и пролиферацию сосудистых гладкомышечных клеток [41].
ВЛИЯНИЕ АГОНИСТОВ РЕЦЕПТОРОВ ГПП-1 НА ДИСЛИПИДЕМИЮ, АРТЕРИАЛЬНОЕ ДАВЛЕНИЕ И ЧАСТОТУ СЕРДЕЧНЫХ СОКРАЩЕНИЙ
У здоровых добровольцев инфузия ГПП-1 (1,2 пмоль/кг/мин) в течение 6,5 ч привела к ингибированию постпрандиального повышения плазменной концентрации триацилглицерола и свободных жирных кислот (СЖК) [42]. Кроме того, у пациентов с впервые выявленным СД 2 типа однократная подкожная инъекция эксенатида (10 мкг) способствовала снижению концентрации постпрандиального триацилглицерола и аполипопротеина В48 в ответ на употребление обогащенного жиром (45% жиров по массе) завтрака [43]. У больных СД 2 типа одновременное введение ГПП-1 (25 нмоль подкожно непосредственно перед едой) в сочетании с инсулином в течение 5 дней приводила к уменьшению плазменных концентраций ЛПОНП и триацилглицерола, одновременно с этим увеличивая размеры частиц ЛПНП. При этом 4-часовая инфузия ГПП-1 (1,2 пмоль/кг/мин) после 10-часового голодания способствовала снижению плазменной концентрации СЖК [44].
Использование аГПП-1 в реальной клинической практике продемонстрировало улучшение показателей липидов натощак. Метаанализ показал, что применение эксенатида сопровождалось снижением ЛПНП, а лираглутида – ТГ, СЖК и ЛПНП [45].
При терапии аГПП-1 в клинической практике имеются убедительные данные об их влиянии в большей степени на уровень систолического АД (САД), чем диастолического (ДАД): так, по данным некоторых исследований, эксенатид не оказывал влияния на ДАД [46], тогда как лираглутид и ситаглиптин способствовали незначительному снижению этого показателя [47]. В ретроспективном мета-анализе шести исследований эксенатид приводил к снижению САД на 2–4 мм рт.ст. по сравнению с плацебо или инсулинотерапией [46]. В исследовании пациентов с СД 2 типа, которым проводилась непрерывная инфузия эксенатида на протяжении 1 года, наблюдалось значительное уменьшение САД (на 3,8–6,2 мм рт.ст.) [48]. Аналогичные результаты были получены при применении лираглутида: САД снижался на 2–3 мм рт.ст. по сравнению с глимепиридом [49].
Преимущественная локализация экспрессии рГПП-1 в предсердиях и гладкомышечных клетках сосудов указывает на потенциальные места воздействия. Поэтому предполагается, что эффективное снижение АД у пациентов с СД 2 типа может быть обусловлено сосудорасширяющим [26] и натрийуретическим действием ГПП-1 [50]. Важно отметить, что аГПП-1 не снижают АД у лиц с отсутствием артериальной гипертензии: в клинических исследованиях не отмечалось случаев гипотензии на фоне приема аГПП-1.
Терапия аГПП-1 сопровождалась более выраженным учащением частоты сердечных сокращений при использовании препаратов длительного действия (лираглутида, эксенатида один раз в неделю; среднее увеличение 4–9 ударов в минуту), чем при применении препарата короткого действия (эксенатид 2 раза/сут, среднее увеличение 0–3 удара в минуту) [51].
Обобщая сведения о кардиоваскулярных эффектах аГПП-1, следует отметить, что в широкой клинической практике была показана способность этих препаратов положительно модулировать факторы сердечно-сосудистого риска. При их назначении у пациентов с СД 2 типа наблюдалось умеренное снижение АД, массы тела и жировой ткани (преимущественно за счет висцерального жира), улучшение липидного профиля за счет снижения уровней ТГ и холестерина ЛПНП (рис. 2). Кроме того, аГПП-1 вызывали снижение уровня факторов воспаления (ФНО-α, IL-1 и IL-6, СРБ), а также повышали уровень адипонектина, положительно влияющего на метаболический профиль пациентов с СД 2 типа [75, 76]. Наличие разностороннего влияния аГГП-1 на патогенетические факторы прогрессирования ССЗ позволяет сделать вывод о дополнительных преимуществах этого класса препаратов при выборе терапии СД 2 типа для коморбидных пациентов и потенциальном снижение риска развития ССО.

КАРДИОПРОТЕКТИВНЫЕ ЭФФЕКТЫ АГОНИСТОВ РЕЦЕПТОРОВ ГПП-1 В ИССЛЕДОВАНИЯХ СЕРДЕЧНО-СОСУДИСТОЙ БЕЗОПАСНОСТИ
Как было показано ранее, при проведении клинических и экспериментальных исследований получены многочисленные данные о положительном эффекте аГПП-1 на факторы сердечно-сосудистого риска, гемодинамические показатели и кардиальную функцию у пациентов с СД 2 типа. Вместе с тем в последние годы по результатам завершившихся масштабных исследований кардиоваскулярной безопасности [53] получены убедительные данные о дифференциации различных препаратов класса аГПП-1 по их влиянию на конечные сердечно-сосудистые и почечные точки (рис. 3).
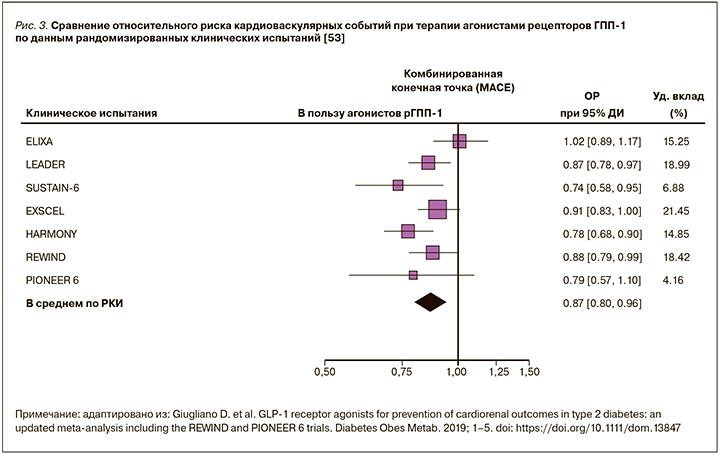
Например, показано, что такие препараты, как эксенатид пролонгированного действия (ПД), лираглутид, албиглутид и семаглутид, у больных СД 2 типа, значительная часть которых относилась к категории высокого сердечно-сосудистого риска, снижали сердечно-сосудистую и/или общую летальность, а также (кроме эксенатида ПД) частоту достижения комбинированной сердечно-сосудистой точки. Кроме того, практически все указанные средства положительно влияли на частоту развития вторичных почечных точек, что указывало на значимый нефропротективный потенциал класса в целом. Лишь при изучении сердечно-сосудистой безопасности ликсисенатида в плацебо-контролируемом исследовании ELIXA (июнь 2010 г. – октябрь 2013 г., >6000 пациентов с СД 2 типа в сочетании с острым инфарктом миокарда) у пациентов с СД 2 типа и ОКС этот препарат показал нейтральный эффект в отношении первичных и вторичных конечных точек. Иными словами, он не оказывал влияния на риск сердечно-сосудистых событий по сравнению с плацебо у пациентов с СД 2 типа и ОКС [54]
В исследовании EXSCEL, включавшем более 9000 пациентов с СД 2 типа, на фоне длительного назначения эксенатида-ПД отмечалось тенденция к снижению частоты достижения комбинированной конечной точки 3Р-MACE в сравнении с группой плацебо, однако разница не достигла статистической значимости для подтверждения гипотезы превосходства препарата над плацебо. Вместе с тем эксенатид-ПД достоверно снижал риск смерти от всех причин на 14% в сравнении с плацебо, что стало подтверждением его способности улучшать прогноз больных СД 2 типа [55]. Также было показано, что эксенатид-ПД уменьшал степень утолщения интимы сосудов после их повреждения, вероятно, вследствие подавления PDGF-индуцированной пролиферации гладкомышечных клеток [56].
В исследовании HARMONY, в которое вошли более 9400 пациентов с СД 2 и ССЗ, альбиглутид (не зарегистрирован в России) продемонстрировал достоверное снижение риска достижения исхода в комбинированной конечной точке 4P-MACE (смерть от ССЗ, нефатальный инфаркт миокарда или инсульт или срочная реваскуляризация при нестабильной стенокардии) на 22% (p=0,0005), а нефатального инфаркта миокарда – на 25% (p=0,003) [57].
В исследовании LEADER (более 9000 больных с СД 2 типа и уже имеющимися ССЗ) терапия лираглутидом длительностью в среднем 3,8 лет привела к достоверному снижению риска наступления комбинированной сердечно-сосудистой конечной точки 3P-MACE на 13%, смертности от ССЗ – на 22%, композитной конечной точки (коронарная реваскуляризация, нестабильная стенокардия, госпитализация по поводу сердечной недостаточности) – на 20%. Кроме того, было отмечено уменьшение риска наступления микрососудистого события (нефропатии) на 22% и общей смертности на 15% [53] прежде всего за счет снижения частоты декомпенсации ХСН. При этом максимальное снижение риска ССО наблюдалось у более тяжелых пациентов, которые перенесли сердечно-сосудистое событие ранее и имели хроническую болезнь почек 3 стадии. Столь значимые результаты у пациентов с СД 2 типа на фоне лечения лираглутидом позволили внести новое показание в инструкцию к препарату – «снижение риска сердечно-сосудистой смерти у взрослых пациентов с сахарным диабетом 2 типа и сердечно-сосудистым заболеванием».
Аналогичное исследование SUSTAIN-6 (3297 пациентов с СД 2 типа и высоким сердечно-сосудистым риском) с длительностью наблюдения в среднем 2 года позволило сделать вывод, что терапия семаглутидом приводила к значимому снижению (на 26%) частоты 3-MACE (в особенности инсультов) относительно плацебо [58]. В то же время этот препарат не уменьшал частоту общей и сердечно-сосудистой смертности, нефатального инфаркта миокарда и госпитализации по поводу сердечной недостаточности.
Наблюдавшееся в исследованиях LEADER и SUSTAIN-6 снижение массы тела, АД и ЧСС было сравнительно невелико и не могло в полной мере объяснить достигнутое уменьшение частоты ССО и смертности в группе обследованных. По-видимому, наряду с коррекцией факторов сердечно-сосудистого риска лираглутид и семаглутид обладают прямым кардио- и нефропротективным эффектами.
Недавно были опубликованы результаты клинических исследований, в которых изучалось действие новой пероральной формы семаглутида.
В исследовании PIONEER 4 «Эффективность и безопасность орального семаглутида в сравнении с лираглутидом и в сравнении с плацебо у пациентов с СД 2 типа» были рандомизированы 711 пациентов с HbA1c 7,0–9,5% на стабильной терапии метформином в дозе ≥1500 мг или максимально переносимой, частично с терапией иНГЛТ-2. Они получали пероральный семаглутид 1 раз/сут в дозе до 14 мг, лираглутид подкожно 1 раз/сут в дозе 1,8 мг или плацебо в течение 52 нед. Было установлено, что пероральный семаглутид не уступал лираглутиду в снижении HbA1c (р <0,0001) и превосходил плацебо (р <0,0001), а также более выраженно снижал массу тела по сравнению с лираглутидом (в среднем на 1,5 кг; р <0,0001) и плацебо (в среднем на 4,0 кг; р <0,0001). В плане безопасности и переносимости пероральный семаглутид был сравним с лираглутидом [59].
Вместе с тем при оценке кардиобезопасности пероральной формы семаглутида в исследовании PIONEER 6 у 3183 пациентов СД 2 типа высокого сердечно-сосудистого риска (возраст ≥50 лет с установленным ССЗ или хроническим заболеванием почек или возраст ≥60 лет только с сердечно-сосудистыми факторами риска) было продемонстрировано, что влияние этого препарата на конечные сердечно-сосудистые точки не отличается плацебо (p <0,001) [53].
В исследование REWIND (Researching cardiovascular Events with a Weekly INcretin in Diabetes), которое проводилось с целью оценки влияния аГПП-1 пролонгированного действия дулаглутида в еженедельной дозе 1,5 мг на риск развития ССО у взрослых больных СД 2 типа по сравнению с плацебо, было включено более 9900 пациентов со средней продолжительностью заболевания около 10 лет [60]. Особенностью исследования REWIND было то, что лишь 31% пациентов исходно имели ССЗ (перенесенный инфаркт миокарда, ишемический инсульт, нестабильную стенокардию, операции по реваскуляризации коронарных, сонных или периферических сосудов, госпитализацию по поводу ИБС с нестабильной стенокардией или зарегистрированной ишемией миокарда). Анализ результатов исследования REWIND показал достоверное снижение на фоне терапии дулаглутидом уровня HbA1c в среднем на 0,61% (p <0,0001), систолического АД – на 1,7 мм рт.ст. (p <0,0001), массы тела – на 1,5 кг (p <0,0001), ХС-ЛПНП в крови – на 0,05 ммоль/л (p <0,001). Кроме того, дулаглутид значительно уменьшал частоту развития первичной композитной сердечно-сосудистой точки 3P-MACE (развитие летального исхода от кардиоваскулярного события или нефатальных инфаркта миокарда и инсульта) на 12% (p <0,026) преимущественно за счет нефатального инсульта, риск которого снизился на 24% (p <0,017). Также отмечалась тенденция к снижению частоты сердечно-сосудистой смерти на 9% (p=0,21). Субанализ данных REWIND с целью оценки влияния на эффективность дулаглутида различных факторов показал, что этот препарат снижал частоту 3Р-MACE у пациентов с СД 2 типа независимо от наличия у них в анамнезе ССЗ (p=0,97). Дулаглутид также достоверно снижал на 15% (p=0,0004) частоту достижения композитной почечной точки, включавшей новые случаи макроальбумиурии, уменьшение на 30% скорости клубочковой фильтрации (СКФ) или начало заместительной почечной терапии. Полученные данные позволяют сделать вывод о наличии у дулаглутида отчетливого кардио- и нефропротективного эффектов. Эти эффекты он продемонстрировал первым среди всех представителей класса аГПП-1 в популяции больных СД 2 типа, большая часть которых ранее не имела ССЗ атеросклеротического генеза.
Таким образом, результаты исследований кардиоваскулярной безопасности аГПП-1 выявили отсутствие влияния этого класса препаратов на конечные сердечно-сосудистые точки у пациентов с СД 2 типа высокого сердечно-сосудистого риска. Наиболее убедительный кардиопротективный эффект продемонстрировали лираглутид и дулаглутид, положительное действие на отдельные сердечно-сосудистые конечные точки было показано при использовании эксенатида пролонгированного действия, а также семаглутида (инъекционной формы) и албиглутида. Это делает обоснованным приоритетное использование указанных препаратов в современных алгоритмах терапии пациентов с СД 2 типа.
ЗАКЛЮЧЕНИЕ
В настоящее время требуются дополнительные усилия для увеличения продолжительности жизни населения России до целевого показателя. В соответствии с Национальным проектом «Здравоохранение» для этого требуется достичь к 2024 г. снижения смертности населения трудоспособного возраста до 350 случаев на 100 тыс. населения, в том числе за счет снижения смертности от болезней системы кровообращения до 450 случаев на 100 тыс. населения [61].
По мнению экспертного кардиологического и эндокринологического сообщества, дальнейшее снижение смертности среди пациентов с ССЗ возможно при улучшении контроля над течением коморбидной патологии, которая значимо модифицирует риски развития жизнеугрожающих осложнений среди этой группы пациентов. При этом наиболее распространенной и пока недооцененной по потенциалу влияния на эти события остается проблема терапии СД 2 типа с применением высокоэффективных и безопасных современных лекарственных средств.
Анализ фармакотерапии СД 2 типа в России показывает преобладание традиционной схемы инициации и интенсификации терапии с использованием, наряду с метформином, препаратов сульфонилмочевины и инсулинов. Очевидно, что раннее назначение в схемах лекарственной терапии СД 2 типа инновационных препаратов, включая аГПП-1, обладающих доказанными кардиоваскулярными преимуществами, может внести существенный вклад в достижение целевых параметров сердечно-сосудистой и общей смертности среди населения нашей страны.



