Сосудистые заболевания головного мозга во всем мире занимают второе место среди причин смерти, вызывая до 11,13% летальных исходов, и являются наиболее частой причиной стойкой утраты трудоспособности [1, 2]. Двигательные нарушения в форме пареза или паралича конечностей у огромного числа больных, перенесших инсульт, вызывают тяжелую стойкую инвалидизацию и значительно снижают качество жизни.
В настоящее время восстановительная терапия при инсульте, как правило, ориентирована на постинсультный дефект в головном мозге и недостаточно учитывает изменения в периферической нервной системе, мышцах, фасциях, связках, суставах, капсулярных структурах, развивающиеся на фоне инсульта и описанные впервые Ж.М. Шарко еще в XIX в. [4, 5–9, 10]. Патогенез вторичных периферических нарушений при инсульте остается недостаточно изученным, что ограничивает возможности восстановления утраченных функций и снижения двигательного дефицита, а также профилактики постинсультных болевых синдромов, контрактур, формирования патологического двигательного стереотипа, стойкой утраты локомоторных функций, снижения качества жизни и социальной активности пациента [4, 6–7].
Выявление структурно-функциональных особенностей афферентных проводящих путей у пациентов с двигательным дефицитом на паретичной и здоровой конечностях поможет уточнить механизм формирования постинсультных морфофункциональных изменений, определяющий возможности восстановления моторных функций в процессе комплексной многопрофильной реабилитации больных.
Цель исследования – оценка структурно-функционального состояния сенсорных проводящих путей спинного и головного мозга на паретичной и здоровой стороне у пациентов с гемипаретическим синдромом в остром и раннем восстановительном периодах ишемического инсульта.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 50 пациентов (28 мужчин и 22 женщины) в возрасте от 47 до 65 лет, находившихся в остром, а в последующем – в раннем восстановительном периоде ишемического инсульта. Диагноз верифицирован с помощью анамнеза, клинической картины, данных мультиспиральной компьютерной томографии (МСКТ) головного мозга, лабораторных показателей, ультразвуковой допплерографии сосудов головы и шеи. У всех пациентов наблюдался двигательный дефицит, в форме пареза от легкого до умеренного, который был обусловлен наличием очага ишемии в бассейне средней мозговой артерии, контралатеральной парезу стороне, подтвержденного нейровизуализационным методом. В исследование не включались больные с травматическими повреждениями ЦНС, оперативными вмешательствами на верхних конечностях в анамнезе.
Оценку соматосенсорных вызванных потенциалов проводили стандартным методом, путем биполярной стимуляции срединного нерва монофазным прямоугольным импульсом тока длительностью не более 1 мс. Электрод фиксировался на запястье так, чтобы анод был дистальнее катода. Интенсивность стимуляции подбирали вручную таким образом, чтобы при стимуляции было видно небольшое рефлекторное движение большого пальца. Частота стимуляции выбиралась равной 3–5 Гц. Заземляющий электрод размещался проксимально для уменьшения артефакта от стимуляции [11].
Схема отведений:
- первый электрод располагался в точке Эрба, находящейся в надключичной ямке, над средней частью ключицы, для регистрации периферического ответа от плечевого сплетения;
- второй электрод размещали на шейном уровне CVII;
- для регистрации в корковых отделах использовали электроды, находящиеся на 2 см сзади от электродов С4 или С3 (в зависимости от стимулируемой руки: левой или правой) международной системы «10–20%». Такие электроды являются активными и присоединяются к первому (отрицательному) входу усилителя.
В качестве референтного электрода использовали скальповый электрод Fz (на границе волосистой части лба) системы «10–20%». В качестве референта для электрода в точке Эрба использовался контралатеральный электрод. Сопротивление электродов не превышало 5 кОм. Чувствительность записи составляла 10 мкВ/дел, эпоха анализа – 50–60 мс, число усреднений – 500.
Идентификация компонентов ответа: при записи с точки Эрба (Erbi-Fz) регистрировали основной компонент N9, отражающий периферическую активацию нейронов в ганглии плечевого сплетения.
При записи с CVII-Fz регистрировали ряд компонентов:
- N11-потенциал, отражающий активацию восходящих путей на спинальном уровне;
- N13-потенциал, отражающий постсинаптическую активацию ядер продолговатого мозга;
- P18-потенциал дальнего поля, регистрируемый на ипсилатеральной стороне от стимулируемого нерва и в стороне от контралатерального N20, отражает активность генераторов в таламусе или таламокортикальной радиации.
При записи с Ccontr-Fz выделяли ряд компонентов (негативно-позитивный комплекс N20–P23), которые являются потенциалами ближнего поля и отражают первичную корковую активацию соматосенсорной коры. Поздний комплекс компонентов N30–P45 имеет более широкое распределение по полушариям и представляет собой активацию от ассоциативных областей мозга и неспецифических таламических структур.
Статистический анализ результатов исследования проводился с помощью пакета программ Statisticа 6.0 с применением параметрического и непараметрического методов (критерии Стьюдента, Манна–Уитни). В качестве порогового уровня статистической значимости было принято значение р=0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для изучения особенностей проведения афферентной волны возбуждения по путям общей чувствительности, проходящим преимущественно в задних столбах спинного мозга через стволовые отделы и спиноталамический тракт в кору, был проведен анализ ответов на коротко латентную соматосенсорную стимуляцию срединного нерва на всем протяжении соматосенсорного пути: от периферических до корковых отделов на здоровой и паретичной конечностях в остром и раннем восстановительном периодах.
При анализе данных соматосенсорных вызванных потенциалов (ССВП) в обследованной группе из 50 больных на здоровой и паретичной конечностях в остром и раннем восстановительном периодах ишемического инсульта были выявлены достоверные изменения ряда электрофизиологических показателей, характеризующих состояние афферентных сенсорных систем (табл.).
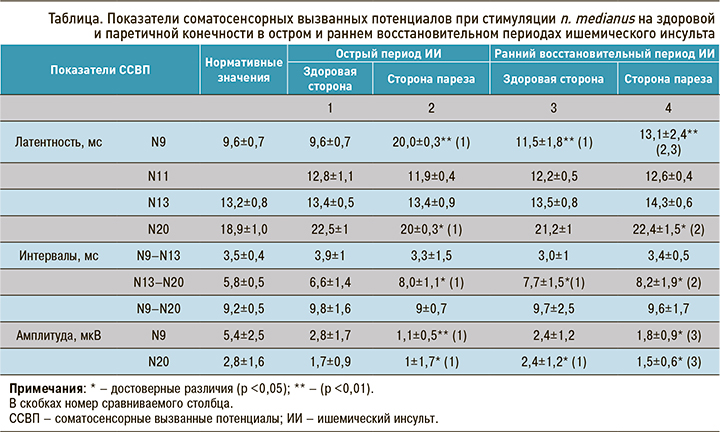
При тестировании срединного нерва в остром периоде ишемического инсульта на паретичной стороне в сравнении с контралатеральной конечностью отмечено достоверное значимое увеличение латентности и уменьшение амплитуды компонента N9 до 20,0±0,3 мс (р <0,01), что свидетельствует о замедлении проведения возбуждения по афферентным путям через плечевое сплетение. На здоровой конечности также отмечалось замедление проведения и снижение амплитуды компонента плечевого сплетения, но в меньшей степени.
Выявлено двустороннее увеличение межпикового интервала N13–N20, которое составило 8,0±1,1 и 6,6±1,4 мс на паретичной и здоровой конечности соответственно, характеризующее время центрального проведения от нижних отделов ствола до соматосенсорной зоны коры головного мозга.
Увеличена латентность пика N20 как на здоровой, так и паретичной конечности, и резко снижена амплитуда компонента на паретичной стороне до 1±1,7 мкВ (р <0,01), что характеризует задержку первичной корковой активации соматосенсорной коры обоих полушарий и наличие очага инфаркта в контралатеральном от паретичной конечности полушарии головного мозга.
При тестировании срединного нерва в раннем восстановительном периоде ишемического инсульта как на паретичной, так и здоровой конечности наблюдалось достоверное увеличение латентности пика N9, которая составила 13,1±2,4 и 11,5±1,8 мс соответственно (р <0,01), а также снижение его амплитуды до 1,8±0,9 и 2,4±1,2мкВ (р <0,05). При этом задержка проведения импульса по волокнам плечевого сплетения на стороне пареза была менее выражена, чем в остром периоде.
На стороне пареза выявлено увеличение латентности компонента N13 до 14,3±0,6 мс, отражающее задержку постсинаптической активации ядер продолговатого мозга.
В раннем восстановительном периоде ишемического инсульта как на стороне пареза, так и здоровой конечности было отмечено увеличение латентности межпикового интервала N13–N20, которая составила 8,2±1,9 и 7,7±1,5 мс соответственно (р <0,05). Это свидетельствует о нарушении проведения афферентного сигнала между шейным утолщением и первичной соматосенсорной зоной коры головного мозга.
Латентность пика N20 была повышена с обеих сторон, при этом оказалась более выражена на паретичной конечности и составила 22,4±1,5 мс (р <0,05), амплитуда компонента на паретичной стороне была резко снижена до 1,5±0,6 мкВ (р <0,01). Это свидетельствует о двусторонней задержке первичной корковой активации соматосенсорной коры и постинфарктных изменений вещества мозга.
При сравнительной оценке состояния афферентных сенсорных систем с помощью метода ССВП как в остром, так и в раннем восстановительном периодах ишемического инсульта выявлено нарушение проводимости по афферентным проводящим структурам на периферическом уровне на стороне пареза, обусловленное демиелинизирующим процессом, на здоровой конечности – в раннем восстановительном периоде.
В обоих периодах ишемического инсульта отмечено двустороннее увеличение времени центрального проведения от нижних отделов ствола до соматосенсорной зоны коры головного мозга и задержка первичной корковой активации последней. При этом более грубые показатели изменения амплитуды и латенции коркового компонента наблюдались на стороне пареза, что обусловлено поражением центрального звена и зоной инфаркта головного мозга.
ЗАКЛЮЧЕНИЕ
В ходе исследования было выявлено, что на стороне пареза поражение периферического звена афферентного пути отмечается уже в остром периоде ишемического инсульта, тогда как на здоровой конечности эти изменения наблюдаются в раннем восстановительном периоде. Замедление проведения по структурам центрального звена афферентного пути и задержка первичной корковой активации соматосенсорной зоны коры головного мозга наблюдались в обоих периодах с двух сторон, при этом более грубые изменения наблюдались на стороне пареза.
Нами установлено, что на стороне пареза в обоих периодах ишемического инсульта страдает нейрональный компонент нервно-мышечного аппарата, что усугубляет восстановление утраченных функций, а на условно здоровой стороне аналогичные изменения, менее выраженные, выявляются в раннем восстановительном периоде.
Таким образом, все пациенты с ишемическим инсультом, имеющие двигательные нарушения, нуждаются в ранней реабилитационной коррекции: базисной, дифференцированной реперфузионной и нейропротективной терапии; медикаментозном лечении, направленном на улучшение нейрональной проводимости и ремиелинизации, микроциркуляции; применении физиотерапии, массажа, лечебной физкультуры с вовлечением как больной, так и здоровой конечности.
Установленные особенности вовлечения периферической нейрональной составляющей сложного многокомпонентного постинсультного гемипареза способствуют расширению возможностей реабилитационной коррекции на ранних стадиях восстановления.



