ВВЕДЕНИЕ
Сахарный диабет (СД) в последние десятилетия приобрел характер быстро растущей пандемии, поражая людей различных социально-экономических групп в развитых и развивающихся странах [1]. По данным Международной диабетической федерации (IDF), в настоящее время насчитывается почти 500 млн взрослых с СД, и ожидается, что в течение следующей четверти века их число возрастет до 700 млн [2]. Диабетические осложнения остаются основной причиной заболеваемости и смертности у этих больных, при этом лидирующую позицию среди сопутствующих ему патологий занимают сердечно-сосудистые заболевания (ССЗ) [3]. Хотя причинно-следственная связь гипергликемии с неблагоприятными сердечно-сосудистыми катастрофами и была четко установлена, результаты исследований ACCORD, ADVANCE и VADT продемонстрировали преимущества интенсивного контроля уровня глюкозы в отношении микрососудистых конечных точек, но не показали значительного улучшения макрососудистых исходов [4–6]. Наряду с традиционными кардиометаболическими факторами риска, такими как артериальная гипертензия (АГ), дислипидемия и ожирение, СД синергически увеличивает риск ССЗ и при отсутствии своевременного и эффективного лечения связан с развитием потенциально опасных для жизни осложнений – хронической болезни почек (ХБП), инфаркта миокарда (ИМ), инсульта и слепоты.
Основной причиной смерти пациентов с СД 2-го типа (около 40–60%, по данным эпидемиологических исследований) являются атеросклеротические ССЗ (АССЗ) [2]. АССЗ при СД включают цереброваскулярные заболевания, ишемическую болезнь сердца (ИБС) и атеросклеротическое поражение артерий нижних конечностей (ЗАНК). Наличие СД 2-го типа (СД 2) повышает риск развития острого нарушения мозгового кровообращения (ОНМК) в 1,5–3 раза, а ИБС в 2–4 раза [7]. Также в исследовании Weitz J.I. et al. было установлено, что среди пациентов с ЗАНК частота сердечно-сосудистых событий за 5-летний период, включая ИМ и ОНМК, составляет 20%, а общая смертность и частота высоких ампутаций – 30% [8].
Другое грозное осложнение СД 2 – ХБП, наличие которой значительно повышает риск не только сердечно-сосудистых катастроф, но и смертности [9]. В настоящее время результаты многочисленных исследований привели к признанию ХБП независимым фактором риска развития ССЗ и эквивалентом ИБС по риску сердечно-сосудистых осложнений. Так, исследование Afkarian M. et al. показало, что у пациентов с СД 2 и ХБП общий риск смертности на 23% выше, чем у больных без диабета и ХБП [10]. К сожалению, несмотря на широкое применение стандартных методов лечения в течение последних нескольких десятилетий, темпы прогрессирования ХБП до терминальной стадии заболевания остаются высокими. Следовательно, важным аспектом ведения и лечения пациентов с СД 2 служит ранняя профилактика и своевременное назначение нефропротективной терапии.
К числу тяжелых сопутствующих патологий у данной когорты пациентов, ухудшающих прогноз и качество жизни, относится и хроническая сердечная недостаточность (ХСН). Эпидемиологические и клинические данные, полученные за последние два десятилетия, свидетельствуют, что помимо ИМ и других сердечно-сосудистых событий, связанных с атеросклерозом, СН является основным фактором сердечно-сосудистой заболеваемости и смертности у пациентов с СД. Риск развития СН при СД 2 в 2–4 раза выше по сравнению с больными без нарушения углеводного обмена [11]. В свою очередь, наличие СН утяжеляет течение СД, значительно ухудшает качество жизни и связано с увеличением частоты госпитализаций и смертности пациентов с диабетом.
Таким образом, ранее выявление и профилактика кардиоренометаболических осложнений имеет большое значение для предотвращения развития и прогрессирования осложнений у пациентов с СД 2.
Целью настоящего исследования стало изучение распространенности АССЗ, ХБП, ХСН и их сочетания у пациентов с СД 2, проходивших стационарное лечение, и выявление предикторов указанных кардиоренальных осложнений.
МАТЕРИАЛ И МЕТОДЫ
Проведено наблюдение и ретроспективный анализ 1150 пациентов с СД 2, госпитализированных на стационарное лечение в Городскую клиническую больницу им. В.П. Демихова за период 2020–2021 гг. Впоследствии больные были стратифицированы на группы в зависимости от длительности заболевания: в 1-ю группу вошли пациенты со стажем СД 2 менее 5 лет, во 2-ю – со стажем более 10 лет.
Всем пациентам проводилось необходимое обследование согласно существующим стандартам и порядку оказания медицинской помощи с последующей оценкой данных клинико-лабораторных и инструментальных показателей. Анализ гликемических параметров проводился по уровню гликированного гемоглобина (HbA1c), глюкозы крови натощак (ГН) и постпрандиальной глюкозе (ППГ). Липидный профиль оценивался по уровню холестерина липопротеидов низкой плотности (ХС ЛНП), холестерина липопротеидов высокой плотности (ХС ЛВП) и триглицеридов (ТГ). Также проводились оценка антропометрических данных пациентов (рост, масса тела и индекс массы тела), определение расчетной скорости клубочковой фильтрации (рСКФ) по формуле CKD-EPI. Выполнялись электрокардиографическое и эхокардиографическое исследование сердца.
Систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводился в программах Jamovi и IBM SPSSS Statistics 23 (IBM, USA). Проверка нормальности распределения количественных признаков выполнялась при помощи критерия Колмогорова–Смирнова. При описании признаков использовали медиану с указанием межквартального диапазона [25-й и 75-й перцентили]. Данные из совокупностей сравнивались с помощью критерия Манна–Уитни. Для сравнения качественных данных применялась таблица сопряженности по критерию χ2 Пирсона и точному критерию Фишера. Различия расценивались как статистически значимые при p <0,05.
Для анализа взаимосвязи признаков и построения моделей была использована логистическая регрессия с обратным (LR) пошаговым исключением, предварительным удалением коллинеарных факторов, расчетом отношения шансов (ОШ) и 95% доверительного интервала (ДИ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общая характеристика пациентов с СД 2, включенных в исследование
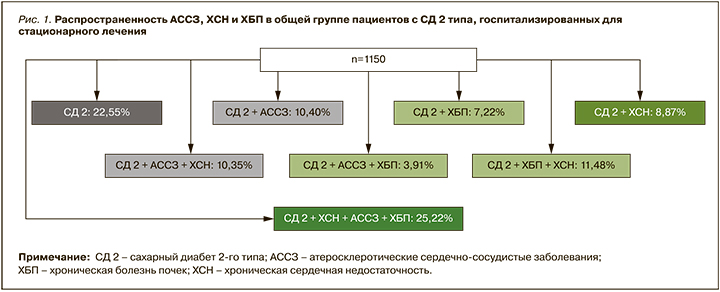
Всего в анализ вошло 1150 пациентов с СД 2 (рис. 1) – 483 (42%) мужчины и 667 (58%) женщин. Средний возраст больных составлял 65 [57; 74] лет. Медиана индекса массы тела (ИМТ) была равна 31,2 [26,3; 35,8] кг/м2. Преобладающая доля пациентов (56%) страдала ожирением (ИМТ более 30 кг/м2), однако 44% имели избыточный/нормальный вес (ИМТ менее 30 кг/м2; р <0,001).
Средний показатель HbA1c у участников исследования равнялся 9,6 [7,9; 10,9] %, при этом HbA1c выше 7% имели 88,6% пациентов; среднее значение ГП крови натощак составило 7,6 [6,4; 9,2] ммоль/л, ППГ – 11,4 [9,7;14] ммоль/л. У 69,8% участников регистрировалась дислипидемия. Пациенты характеризовались повышенным ХС ЛНП (2,89 [2,04; 3,75] ммоль/л) и ТГ (1,85 [1,4; 3,0] ммоль/л) на фоне низкого уровня ХС ЛВП (0,998 [0,840;1,20] ммоль/л; табл. 1).

В ходе анализа сопутствующих заболеваний у отобранных пациентов с СД 2 было установлено, что наиболее распространенным среди них была АГ, которой страдали 1007 (87,6%) участников исследования (рис. 2). Второе место по частоте встречаемости занимала ХСН, наблюдавшаяся у 644 (56%) пациентов: из них 505 (43,91%) человек имели ХСН с сохраненной фракцией выброса (ХСНсхФВ), 139 (12,09%) – ХСН со сниженной или умеренно сниженной ФВ (ХСНсн/усФВ). Медиана ФВ составила 56 [47; 61].
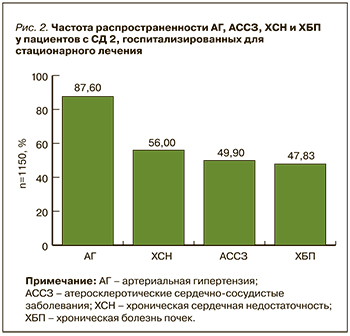
АССЗ были выявлены у 574 (49,9%) участников: среди них на долю ИМ приходилось 24,7%, нарушений мозгового кровообращения – 18,9%, ЗАНК – 17%, стенокардии – 6%. Нарушение функции почек, согласно рСКФ, было установлено у 550 (47,83%) пациентов, из которых 275 (23,91%) человек имели стадию заболевания С3а, 203 (17,65%) – С3б, еще 72 (6,26%) – тяжелую почечную недостаточность со снижением рСКФ менее 30 мл/мин/см2 (см. рис. 1).
Таким образом, несмотря на относительно небольшую продолжительность СД 2, среди участников исследования отмечалась очень высокая распространенность таких значимых, ассоциированных с высокой инвалидизацией и летальностью заболеваний, как ХСН, АССЗ и ХБП, причем у четверти пациентов имело место сочетание всех трех нозологий. Одновременно среди госпитализированных пациентов у 22,55% не было обнаружено кардиоренальных осложнений, несмотря на то, что по своей клинической характеристике они существенно не отличались от лиц с развившимися осложнениями. Оценивая более детально структуру коморбидной картины, мы установили, что у 10,40% пациентов СД 2 развивались преимущественно АССЗ, у 8,87% СД 2 ассоциировался только с ХСН без другой сосудистой патологии. ХБП как первое и единственное осложнение выявлялась у 7,22% больных СД 2. Обращает на себя внимание, что у большой доли пациентов с СД 2 (25,22%) наблюдалось одновременное развитие сочетанной патологии: так, АССЗ и ХСН выявлялись у 10,35%, отражая преимущественно повреждение кардиоваскулярной системы. В 11,48% ХБП сочеталась с ХСН с развитием кардиоренального синдрома, а вот сочетание ХБП и АССЗ наблюдалось только у 3,91% (см. рис. 1). Полученные данные позволяют говорить о возможности формирования различных патологических сценариев у пациентов СД: в ряде случаев имеет место преимущественное поражение кардиоваскулярной системы (АССЗ, ХСН или их сочетание) без поражения почек, тогда как у других происходит формирование сочетанной кардиоренальной патологии, при которой ХБП может сочетаться как с ХСН, так и с АССЗ.
При оценке комплексной медикаментозной терапии включенных в анализ пациентов с СД 2 было установлено, что более половины из них (59,4%) получали ингибиторы АПФ или блокаторы рецепторов ангиотензина (БРА), 41% – бета-блокаторы, 33% – диуретики (тиазидные/петлевые), 15% – блокаторы кальциевых каналов. Прием статинов осуществляли только 24,2% пациентов. В качестве сахароснижающей терапии преобладающая доля участников исследования (36,3%) получала инсулинотерапию в базис-болюсом режиме, 18,5% – комбинацию базального инсулина с сахароснижающими препаратами (ССП). Вместе с тем, несмотря на высокий уровень HbA1c, в 24,2% случаев сохранялась высокая доля монотерапии различными ССП: так, только метформин получали 14,2% пациентов, ингибитор дипептидилпептидазы-4 (ИДПП-4) – 2,7%, агонист рецепторов глюкагоноподобного пептида 1 (арГПП-1) – 0,17%, ингибитор натрий глюкозного котранспортера 2 (иНГЛТ-2) – 1,48%, препарат сульфомочевины (ПСМ) – 5,65%. Двойную комбинацию метформина с ПСМ применяли 11,74%, с иДПП4 – 2,96% пациентов. Сочетание метформина с преферентно рекомендованными иНГЛТ-2 имело место у 2,09% пациентов, с арГПП-1 – у 1,91%. Применение комбинации из трех ССП было отмечено в 2,3% случаев. Таким образом, несмотря на то что все пациенты имели уровень HbA1с значительно выше целевого диапазона и характеризовались высоким сердечно-сосудистым риском, значительная доля больных оставалась на монотерапии ССП, а назначение преферентных классов сахароснижающих средств, обладающих органопротективными свойствами, была низкой.
В рамках оценки роли продолжительности СД 2 в развитии АССЗ, ХСН и ХБП из всех включенных в анализ пациентов были отобраны и разделены на соответствующие группы лица со стажем заболевания менее 5 и более 10 лет. Такое распределение было выполнено на основании признанных клинических, патогенетических и других различий между больными с недавно развившимся и длительно текущим СД. В итоге в 1-ю группу вошли 499 больных (43,39%) с небольшой продолжительностью СД (<5 лет), во 2-ю – 531 пациент (46,17%) с более чем 10-летним стажем заболевания.
Характеристика пациентов с длительностью СД 2 менее 5 лет
В группе пациентов с длительностью СД 2 менее 5 лет было 259 (51,9%) мужчин и 240 женщин (48,1%), средний возраст пациентов составил 60 [52,5; 69] лет. Средняя продолжить заболевания равнялась 1,5 года, у 56,91% пациентов отмечался впервые выявленный СД 2. Все участники из этой группы характеризовались высокой гипергликемией: уровень HbA1c в среднем по группе составил 10 [7,95;11,2] %, у подавляющего большинства (87,18%) он значительно превышал 7% (целевой порог). Концентрация ГН в среднем по группе равнялась 7,5 [6,4; 8,95] ммоль/л, ППГ – 11,1 [9,4; 13,8] ммоль/л.
Среди основных факторов риска ССЗ были выявлены АГ (83,37%), дислипидемия (73,55%) и ожирение (52,51%). Хотя медиана ИМТ в среднем по группе и составила 30,9 [26,3; 36] кг/м2, у 47,49% пациентов наблюдалась избыточная/нормальная масса тела (а не ожирение). При анализе липидного профиля уровень ХС ЛПН соответствовал показателю 3,12 [2,24; 3,76] ммоль/л, ТГ – 1,9 [1,4; 2,8] ммоль/л, ХС ЛВП – 1,01 [0,855; 1,26] ммоль/л (см. табл. 1).
Обращает на себя внимание тот факт, что самым распространенным сопутствующим заболеванием в группе пациентов с длительностью СД 2 <5 лет была ХСН (42,09%), причем преобладающая часть больных имела ХСНсхФВ (33,07%), в то время как на долю ХСНсн/усФВ пришлось 9,02% случаев. Медиана ФВ в данной группе равнялась 57 [50; 62] %. АССЗ было диагностировано у 36,27% пациентов, из них у 15,63% был в анамнезе перенесенный ИМ, у 13,03% – ОНМК, у 9,62% – ЗАНК, у 4,01% – стенокардия. При анализе функции почек диагноз ХБП был выставлен 38,68% больных, среди которых 23,25% имели стадию болезни С3а, 10,22% – С3б, 5,21% – тяжелую стадию почечной недостаточности (рис. 3).
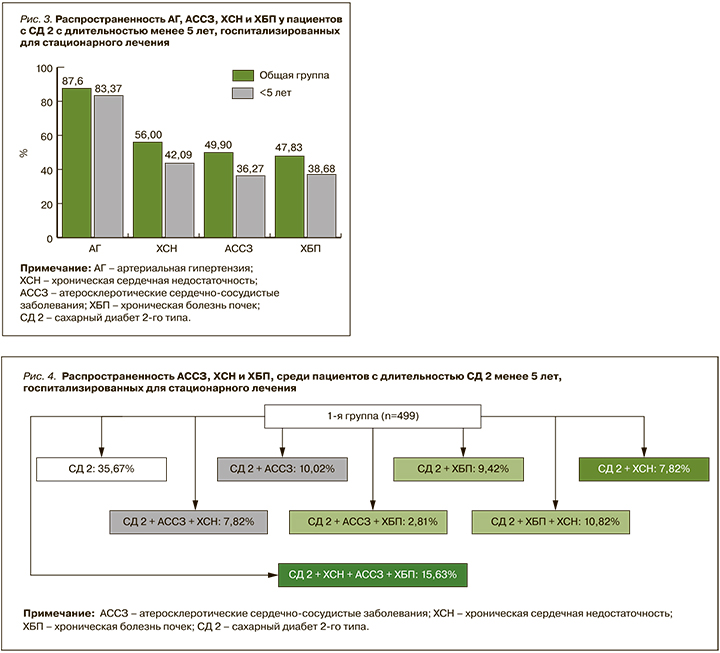
Таким образом, несмотря на очень небольшую продолжительность СД 2 (в среднем 1,5 года), только у 35,67% госпитализированных в стационар пациентов не было тяжелых кардиоренальных осложнений. На фоне выраженной гипергликемии у большинства больных наблюдалась очень высокая суммарная распространенность ХСН (42,09%), АССЗ (36,27%) и ХБП (38,68%; рис.4).
Отметим, что представленные нами результаты показывают не только очень быстрое формирование тяжелой коморбидной патологии на фоне неудовлетворительного контроля СД, но и ее неоднородную структуру. Это определяет не только выбор сахароснижающей терапии, но и отдаленный прогноз. Наши данные свидетельствуют, что у одних пациентов СД 2 ассоциировался с развитием только кардиоваскулярных нарушений, у других – с одновременным повреждением сердечно-сосудистой системы и почек. Так, какое-либо АССЗ диагностировалось у 10,02% больных СД, его сочетание с ХСН было выявлено у 7,82%, еще у 7,82% развивалась изолированная ХСН. Формирование развернутой кардиоренальной патологии происходило не менее часто: у 10,82% больных одновременно развивались ХБП и ХСН, в 2,81% случаев наблюдалось сочетание ХБП с АССЗ, а у 15,63% больных одновременно регистрировались все 3 заболевания. Изолированное развитие ХБП без патологии со стороны сердечно-сосудистой системы имело место у 9,4% больных.
Характеристика пациентов с длительностью СД 2 более 10 лет
В эту группу вошли 531 пациент (46,17%), среди которых было 356 (67,04%) женщин и 175 мужчин (32,96%). Средний возраст равнялся 70 [62; 77,5] лет, медиана длительности СД – 15 [12; 20] лет.
Подобно 1-й группе, преобладающая доля пациентов с длительностью СД 2 более 10 лет страдала ожирением и имела неудовлетворительные показатели углеводного обмена. Средний показатель HbA1c составил 9,2 [7,9; 10,4] %, причем в 90,1% его уровень был выше 7%. Медиана уровня ГН равнялась 7,8 [6,45 ;9,7] ммоль/л, ППГ – 11,8 [10,0; 14,2] ммоль/л.
При исследовании метаболических параметров, как и в 1-й группе, наблюдалась высокая частота АГ (93,6%), нарушений липидного спектра (66,85%) и ожирения (59,95%). Медиана значения ИМТ составила 31,2 [27,3; 36] кг/м2; 59,95% пациентов имели ИМТ >30 кг/м2, избыточную/нормальную массу – 47,49% больных. При анализе липидного спектра медиана ХС ЛПН соответствовала 2,76 [1,99; 3,73] ммоль/л, ТГ – 1,9 [1,2; 2,48] ммоль/л, ХС ЛВП – 0,970 [0,798; 1,14] ммоль/л.
При оценке частоты сопутствующих заболеваний у пациентов данной группы было отмечено двукратное увеличение процента коморбидных кардиоренальных состояний по сравнению с пациентами, имевшими длительность СД 2 менее 5 лет. Как и в 1-й группе, здесь наблюдалась высокая частота ХСН. Кардиоренальная патология была выявлена у 67,98% пациентов, при этом у большинства пациентов, так же, как и у больных с небольшим стажем СД, регистрировалась ХСНсхФВ (53,3%), и только 14,69% участников имели ХСНсн/унФВ. На АССЗ пришлось 62,52% больных, из которых 33,33% имели в анамнезе перенесенный ИМ, 23,73% – ОНМК, 22,79% – ЗАНК и 7,91% – стенокардию. При анализе фильтрационной функции почек медиана рСКФ составила 54 [40; 69] мл/мин/см2. Нарушение функции почек наблюдалось у 53,3% пациентов, из них 24,67% имели стадию заболевания С3а, 25,05% – С3б, 3,58% –продвинутые стадии ХБП (С4–5; рис. 5, 6).
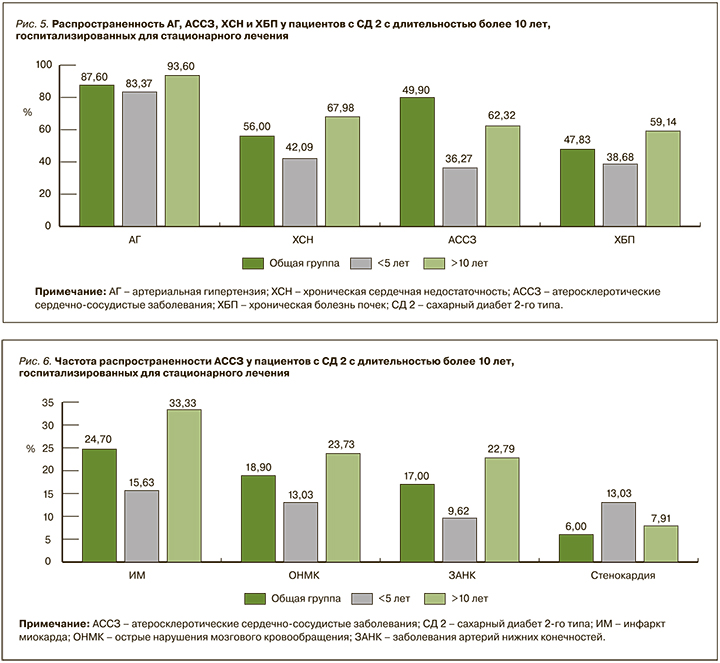
С точки зрения сопутствующих кардиоренальных осложнений подавляющее количество пациентов СД 2 с длительность заболевания более 10 лет характеризовались тяжелой коморбидностью с одновременным наличием АССЗ, ХСН и ХБП (35,39%). В 9,79% случаев пациенты имели только АССЗ, у 7,72% СД 2 ассоциировался с ХСН, у 6,97% регистрировалось только нарушение функции почек. Аналогично 1-й группе одновременное поражение почек и ХСН наблюдалось у 12,26% больных, сочетание АССЗ и ХСН – у 12,62%, сочетание АССЗ + ХБП – только у 4,52% (рис. 7).
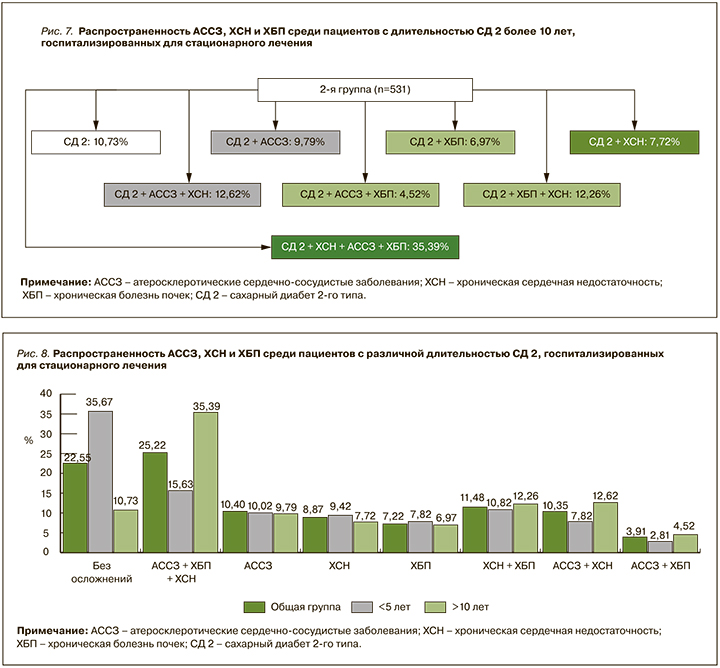
Таким образом, пациенты с СД 2 в нашем исследовании характеризовались высокой частотой сопутствующих заболеваний со стороны сердечно-сосудистой и почечной систем, у них отмечался высокий темп прогрессии коморбидной патологии по мере увеличения длительности заболевания. В группе СД 2 с длительностью заболевания больше 10 лет подавляющее большинство больных отличалось наличием всех трех оцениваемых заболеваний – АССЗ, ХСН и ХБП. В обеих группах чаще изолированно развивались АССЗ и в меньшей степени – ХБП или ХСН изолированно друг от друга. При анализе коморбидной патологии отмечалось преимущественное сочетание АССЗ с ХСН с преобладающим поражением сердечно-сосудистой системы либо ХБП с ХСН с развитием кардиоренального синдрома. Значительно реже встречалось одновременное наличие у пациентов АССЗ и ХБП (рис. 8).
Группы статистически значимо различались по возрасту и полу. В 1-й группе преобладали лица мужского пола, во 2-й – женского (p <0,001). Группы были сопоставимы по ИМТ (р=0,194), однако при более детальном анализе пациентов с ожирением ИМТ в 1-й группе оказался статистически достоверно выше по сравнению со 2-й группой (p <0,024).
Вне зависимости от стажа СД, сопутствующих заболеваний и возраста пациенты имели высокий уровень HbA1c. Среднее значение этого показателя было достоверно выше в 1-й группе (p <0,001). Не было выявлено значимой разницы между группами в уровнях ГН (p=0,078), однако ППГ оказалась статистически значимо выше во 2-й группе.
Исследованные пациенты имели типичные для СД 2 нарушения липидного обмена – увеличенные значения ХС ЛНП и ТГ на фоне низких концентраций ХС ЛВП. Больные обеих групп характеризовались высокими уровнями ХС ЛПН (p <0,021) и ТГ (p <0,260). Содержание ХС ЛПВП было ниже у пациентов во 2-й группе, но эта разница не достигла уровня статистической достоверности (р=0,062; табл. 2).

Итак, преобладающая доля пациентов с СД 2 характеризовалась высоким или очень высоким риском ССЗ вне зависимости от стажа заболевания. На сегодняшний день сформировалось устойчивое понимание того, что СД 2 с момента установления диагноза является кардиоренометаболическим состоянием. В связи с этим все ведущие эндокринологические сообщества постулируют, что наличие АССЗ, ХСН и ХБП в обязательном порядке должно быть принято во внимание при выборе сахароснижающей терапии.
Отрицательное влияние СД на сердечно-сосудистую систему не вызывает сомнений; за последние несколько десятилетий были опубликованы многочисленные работы о взаимосвязи параметров углеводного обмена и кардиоренальных заболеваний, что легло в основу «глюкоцентрического» подхода ведения пациентов с СД. Исследование STENO-2 с периодом наблюдения 7,8 лет показало, что многофакторный подход к лечению СД приводил к снижению на 53% комбинированной конечной точки ССЗ, включавшей смерть от сердечно-сосудистых заболеваний, ИМ, инсульт, реваскуляризацию и ампутации нижних конечностей [12]. Более поздний 13-летний отчет о дальнейшем наблюдении пациентов также констатировал снижение смертности на 40% в группе интенсивного лечения [13].
Последующие десятилетия ознаменовались целой серией CVOT-исследований (Cardiovascular Outcome Trial), которые продемонстрировали способность некоторых ССП снижать крупные сосудистые события, ХСН и ХБП. Результаты этих масштабных исследований позволили выделить преферентные препараты, обладающие органопротективными свойствами, и способствовали формированию «прогноз-ориентированного» подхода к ведению пациентов с СД 2. Согласно ему, лечение пациентов должно быть направлено не только на достижение целевого уровня HbA1c, но и на снижение заболеваемости ССЗ и смертности у этой категории больных.
Уровень HbA1c менее 7% признан целевым для большинства пациентов с СД. По данным от 2018 г., в России только 52% больных имели такие значения HbA1c. Схожие данные были опубликованы центром по контролю и предотвращению заболеваний США в 2020 г.: целевой уровень HbA1c был достигнут только у 50,6% больных [14]. По результатам Шведского регистра (n=271 174), в котором изучалась взаимосвязь между различными факторами риска и сердечно-сосудистыми исходами, повышенный уровень HbA1 выступал независимым предиктором ИМ, инсульта и смерти от любой причины, однако не была показана его связь с ХСН [15]. В нашем исследовании у 88,6% пациентов с СД 2 HbA1с был ≥7%, а средний его уровень в общей группе равнялся 9,6%. То есть полученные нами результаты подтверждают высокую значимость гликемии в формировании тяжелой коморбидности у пациентов с СД 2.
К немодифицируемым факторам риска ССЗ относятся возраст, пол и длительность СД. У пациентов старше 65 лет риск развития кардиоваскулярных событий в 3 раза выше по сравнению с лицами моложе 40 лет. В представленном анализе возраст старше 60 лет ассоциировался увеличением вероятности развития кардиоренальных осложнений (АССЗ, ХБП и ХСН) в 2–4 раза. Этот результат согласуется с результатами исследований, проведенных в Пакистане (ОШ 4,22; 95% ДИ: 3,09–5,75), Тайване (ОШ 2,95; 95% ДИ: 2,19–3,97) и Швеции (ОШ 3,10; ДИ: ДИ 2,53–3,8), поскольку они также продемонстрировали, что пожилой возраст является предиктором сердечно-сосудистых событий [15–17].
Что касается данных в отношении взаимосвязи половой принадлежности и ССЗ, то на сегодняшний день они довольно противоречивы. По данным нашего анализа, женский пол увеличивал риск развития ХСН и ХБП в 1,39 и 1,79 раза соответственно (р <0,001), в то время как у мужчин был в 1,5 раза выше шанс развития АССЗ (р <0,001). Эти результаты созвучны с данными исследования Kornelius E. et al. (n=8916), в котором риск кардиоваскулярных событий (ИБС и инсульта) у мужчин был выше по сравнению с женщинами (относительный риск (ОР) 1,40; 95% ДИ: 1,28–1,54) [17]. В свою очередь, в исследовании Framingham Heart Study риск СН был в 2 раза выше у мужчин и в 5 раз выше у женщин с СД 2 по сравнению с общей популяцией [18]. Напротив, в исследовании Ballotari P. et al. (n=24 348, период наблюдения 3 года) риск развития ИМ был выше у женщин (ОР 1,81; 95% ДИ: 1,27–2,59) по сравнению с лицами мужского пола (ОР 1,48; 95% ДИ 1,10–1,99), тогда как риск инсульта и СН был сопоставим [19].
Одним из модифицируемых факторов риска ССЗ является АГ: она встречается у 50–80% больных СД 2, у 30% пациентов с СД 1 типа и служит значимым и независимым фактором развития фатальных и нефатальных осложнений у пациентов с СД 2 [20]. Сосуществование этих двух заболеваний связано с шестикратным увеличением риска сердечно-сосудистых событий [21]. В исследовании UKPDS было установлено, что контроль артериального давления (АД) приводил к снижению микрососудистых заболеваний на 37%, частоты инсультов – на 44%, СН – на 56%, общей смертности – на 32% [22]. В нашем исследовании наличие АГ увеличивало шансы АССЗ в 4,39 раза, ХБП в 2 раза и ХСН почти в 3 раза, что согласуется с результатами зарубежных исследователей и указывает на необходимость строгого контроля АД и раннего назначения комбинированной гипотензивной терапии.
К определяющим факторам в развитии атеросклероза и ИБС относится и дислипидемия [23]. Показано, что гипертриглицеридемия связана с двукратным, а низкий уровень ХС ЛПВП с четырехкратным увеличением количества коронарных событий у пациентов с СД 2 [24]. Согласно анализу Kaze A.D. et al., «метаболическая триада» ассоциировалась с повышенной частотой развития комбинированной конечной точки (смерть от ИБС, инфаркт миокарда, инсульт и госпитализации по поводу стенокардии) независимо от других факторов риска ССЗ [25]. В нашем исследовании при оценке липидного профиля пациенты с СД 2 в независимости от стажа заболевания имели характерную «диабетическую триаду» – повышенный уровень ТГ и ЛПНП на фоне сниженных показателей ЛПВП.
Ожирение также является одним из ведущих модифицируемых факторов риска и частым коморбидным состоянием у пациентов с СД 2. Данные последних десятилетий привели к появлению концепции «парадокса ожирения». Так, крупные проспективные исследования показали, что связь между ожирением и ИБС в значительной степени опосредована сопутствующими заболеваниями, такими как АГ, дислипидемия и СД, тогда как другие исследования предполагают значительный остаточный риск ИБС при ожирении, после учета этих факторов риска [26–28]. В своей работе Morkedal B. et al. оценивали роль ожирения в развитии ОИМ и СН у пациентов без установленных ССЗ [29]. Результаты позволили заключить, что ожирение имеет прямую связь с ХСН (ОР 1,7; 95% ДИ: 1,4–2,0), но в отношении ИМ достоверных различий между пациентами с ожирением и нормальной массой тела получено не было (ОР 1,1; 95% ДИ: 0,9–1,4). Кроме того, данные крупного шведского исследования (n=271 174) продемонстрировали, что ожирение ассоциировано с ХСН и риском смерти от всех причин, но не с развитием ИМ или инсульта [15]. В ряде других исследований с участием от 780 до 25 626 пациентов с последующим наблюдением от 3 до 15 лет были получены аналогичные результаты: больные с ожирением имели сопоставимый риск фатальных или нефатальных ССЗ по сравнению с пациентами с нормальной массой тела. С другой стороны, крупный метаанализ, включивший несколько проспективных эпидемиологических исследований (более 300 000 пациентов), продемонстрировали, что ожирение увеличивает риск ИБС даже после коррекции на другие известные факторы риска [30, 31]. В нашем исследовании 56% пациентов имели ИМТ >30 кг/ м2, 44% – избыточную массу тела; при этом наличие ожирения не повышало шанс развития АССЗ и ХБП, однако ИМТ >30 кг/ м2 увеличивал вероятность ХСН в 2 раза (р <0,001).
Резюмируя все вышесказанное, можно выделить следующие аспекты рассмотренной проблемы.
1. У преобладающей части пациентов с СД 2 независимо от возраста, пола и стажа диабета отмечались неудовлетворительные показатели углеводного обмена и высокая распространенность АГ, ожирения и дислипидемии
2. Практически все пациенты с СД 2 имели высокий или очень высокий риск ССЗ независимо от стажа диабета. Наблюдалась высокая распространенность сопутствующей коморбидной патологии со стороны сердечно-сосудистой и почечной систем и двукратное увеличение процента осложнений по мере увеличения стажа СД 2.
3. При детальном анализе сопутствующих заболеваний установлено, что большое число пациентов с СД 2, даже с очень короткой продолжительностью заболевания, уже имели проявления АССЗ, ХСН и ХБП. При оценке сочетанных проявлений кардиоренальных осложнений обращало на себя внимание, что у значительной доли больных имело место сочетание либо АССЗ с ХСН, в большей степени отражающее кардиоваскулярное поражение, либо ХБП и ХСН, свидетельствующее о гемодинамических нарушениях с ускоренным формированием кардиоренального синдрома. Лишь небольшой процент пациентов одновременно имел АССЗ и ХБП.
4. Если у пациентов с АССЗ многофакторный подход к их ведению может предотвратить развитие фатальных и нефатальных осложнений, то в отношении ХБП и ХСН такой подход может быть недостаточен и в обязательном порядке требует назначения препаратов с органопротективными свойствами, которые доказали свою эффективность как в первичной, так и во вторичной профилактике.
Следовательно, ранее выявление и профилактика кардиоренометаболических осложнений имеет принципиальное значение для предотвращения развития и прогрессирования кардиоренальных заболеваний у пациентов с СД 2.
ЗАКЛЮЧЕНИЕ
Проведенный анализ позволил определить распространенность сопутствующих заболеваний, ассоциированных с СД 2. Отмечена высокая частота встречаемости АССЗ, ХСН и ХБП вне зависимости от длительности СД. У исследованных пациентов наблюдалась высокая частота основных факторов риска ССЗ: высокий уровень HbA1с, АГ, ожирения и дислипидемии. Также на основе проведенного анализа были определены факторы риска, ассоциированные с осложнениями со стороны сердечно-сосудистой и почечной систем в данной когорте больных.



