ВВЕДЕНИЕ
Инфекция COVID-19 ассоциирована с поражением дыхательной системы и развитием острого респираторного дистресс-синдрома (ОРДС) с внелегочной полиорганной дисфункцией в тяжелых случаях. Мультисистемный характер поражений при коронавирусной инфекции обусловлен как прямым воздействием вируса SARS-CoV-2 на клетки-мишени, так и опосредованным, вследствие агрессивного иммунно-воспалительного ответа, активации системы комплемента и развития «цитокинового шторма». Нередко в патологический процесс вовлекается и система гемостаза с развитием гиперкоагуляционного синдрома [1, 2].
Целью представленного клинического случая является привлечение внимания врачей к одному из вариантов течения гиперкоагуляционного синдрома, клинически проявившегося тромбоэмболией легочной артерии (ТЭЛА) у женщины молодого возраста.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка Д., 36 лет, поступила 06.07.2021 в кардиологическое отделение с жалобами на одышку смешанного характера при минимальной физической нагрузке.
Данные анамнеза: к моменту поступления пациентка около двух лет наблюдалась у терапевта по поводу вторичной головной боли на фоне дисфункции вегетативной нервной системы. В мае 2021 г. обратилась к врачу в связи с дорсопатией, мышечно-тоническим синдромом на пояснично-крестцовом уровне. В анамнезе – хронический тонзиллит, хронический гастрит, хронический пиелонефрит, аллергический ринит, вызванный пыльцой растений, цветущих с апреля по июнь. Две беременности, обе завершились родами в срок, дети здоровы. Мать страдает головной болью напряженного типа.
В июне 2021 г. пациентка перенесла новую коронавирусную инфекцию, подтвержденную с помощью ПЦР-теста (15 июня 2021 г.), в легкой форме. Лечилась амбулаторно, получала умифеновир и ацетилцистеин.
27.06.2021 у пациентки впервые возникло синкопальное состояние на фоне ухудшения самочувствия (нарастания одышки, слабости), после вызова бригады скорой медицинской помощи (СМП) она была госпитализирована в стационар, где ей диагностировали двустороннюю полисегментарную интерстициальную пневмонию. 30.06.2021 пациентка была выписана в связи со стабилизацией состояния и незначительным поражением легких (5%). 01.07.2021 получила направление на консультацию к неврологу, который установил следующий диагноз: «эпизодическая головная боль напряженного типа, вторичная головная боль на фоне дисфункции вегетативной системы, тревожное расстройство, артериальная гипертензия 1 степени, синусовая тахикардия». 02.07.2021 пациентка была консультирована кардиологом, прошла электрокардиографию (ЭКГ) и эхокардиографию (ЭхоКГ). На ЭКГ была обнаружена неполная блокада правой ножки пучка Гиса, ЭхоКГ – без особенностей. 04.07.2021 г. пациентка трижды перенесла эпизоды потери сознания, отмечала одышку при минимальной физической активности, повышение артериального давления (АД) до 170/100 мм рт.ст., колебания пульса от 70 до 170 уд./мин. Вызванная бригада СМП после осмотра пациентки оснований для госпитализации не нашла. Пациентка самостоятельно обратилась за помощью в приемное отделение городской больницы 06.07.2021.
Данные объективного осмотра: состояние удовлетворительное, температура тела 36,8 °С. Кожный покров розовой окраски, влажность умеренная, высыпаний и отеков нет. При аускультации в легких – дыхание везикулярное, ослаблено в нижних отделах, хрипы не выслушиваются, частота дыхательных движений 18/мин., SpO2 91%. Тоны сердца приглушены, ритм правильный, шумы не выслушиваются. АД 130/70 мм рт.ст., частота сердечных сокращений 80/мин. Язык умеренной влажности, налет отсутствует. Живот правильной формы, участвует в акте дыхания, не вздут, при пальпации мягкий, безболезненный, симптомов раздражения брюшины нет. Стул оформленный, однократно в сутки. Мочеиспускание свободное, безболезненное. Симптом поколачивания отрицательный с обеих сторон.
Результаты клинического, биохимического анализов крови и коагулограммы пациентки представлены в таблице.
По результатам ультразвукового сканирования вен нижних конечностей было установлено наличие несостоятельности большой подкожной вены правой нижней конечности до уровня верхней трети голени, несостоятельность большой подкожной вены левой голени.
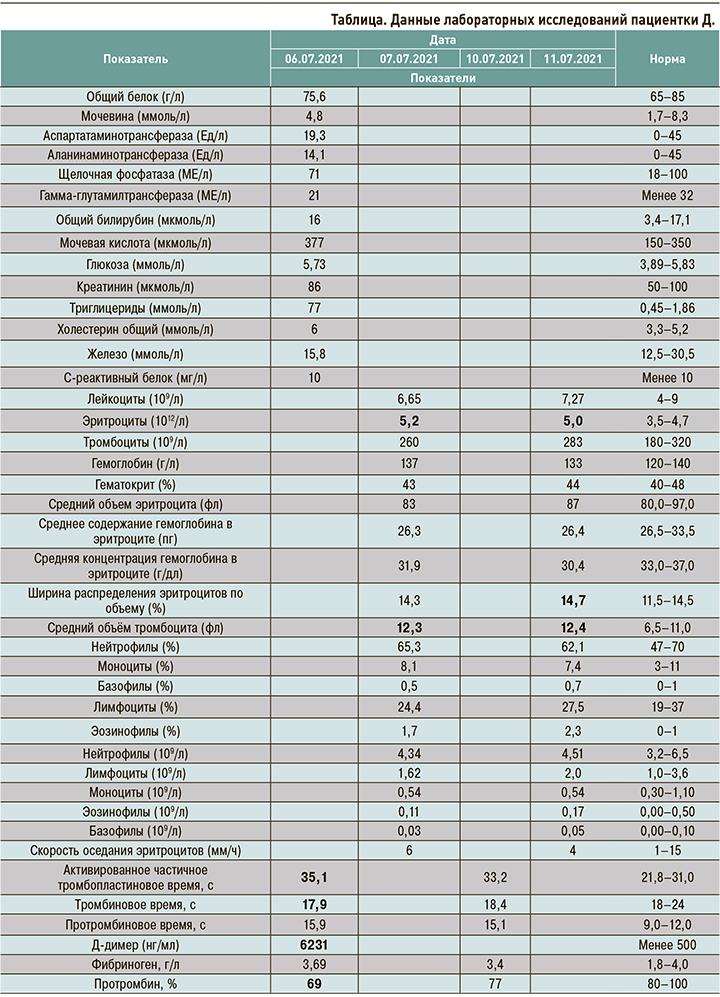
При проведении мультиспиральной компьютерной томографической ангиопульмонографии (МСКТ-ангипульмонографии) от 06.07.2021 (рис. 1) была выявлена массивная тромбоэмболия легочной артерии и ее ветвей.
После консультирования у сосудистого хирурга пациентке была рекомендована антикоагулянтная терапия в условиях стационара, она была госпитализирована для лечения. В стационаре городской больницы получала апиксабан 10 мг 2 раза/сут, диосмин 600 мг 1 раз/сут, омепразол 20 мг 2 раза/сут, использовала эластическую компрессию второго класса.
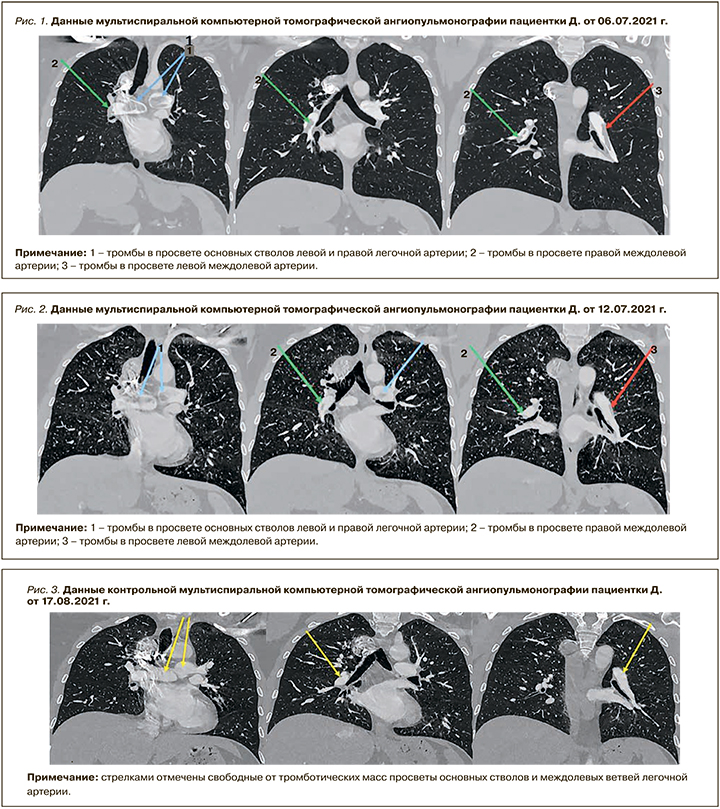
12.07.2021, накануне выписки, при выполнении МСКТ-ангипульмонографии была отмечена положительная динамика в виде уменьшения размеров тромбов и распространенности изменений (рис. 2). Пациентка была выписана с рекомендациями продолжить прием омепразола и апиксабана в дозе 2,5 мг 2 раза/сут.
На контрольной МСКТ-ангиопульмонографии от 17.08.2021 тромботические массы в легочной артерии отсутствовали (рис. 3).
На основании данных анамнеза, жалоб, объективного физикального осмотра, лабораторных и инструментальных исследований пациентке был выставлен диагноз:
- основной диагноз: новая коронавирусная инфекция, вирус идентифицирован;
- осложнения: внебольничная двусторонняя полисегментарная пневмония, вызванная SARS-CoV-2. ТЭЛА от 06.07.2021. Дыхательная недостаточность 2 степени (ДН 2);
- сопутствующие заболевания: хронический тонзиллит, простая форма, вне обострения. Хронический неатрофический гастрит, вне обострения. Хронический пиелонефрит, вне обострения.
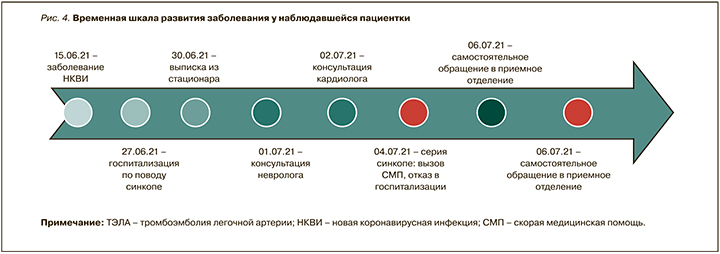
Таким образом, представленный клинический случай свидетельствует о необходимости внимательного отношения врачей ко всем пациентам независимо от возраста и сопутствующей патологии как в момент госпитализации, так и при обращении за помощью на догоспитальном этапе, а также динамического наблюдения за показателями гемостаза с целью выявления ранних изменений и своевременного назначения антикоагулянтной терапии (рис. 4).
ОБСУЖДЕНИЕ
К особенностям приведенного клинического наблюдения следует отнести молодой возраст пациентки, отсутствие в анамнезе сопутствующей патологии (онкологических заболеваний, анемии, хронической болезни почек, тромбофилии, фибрилляции предсердий, сердечной недостаточности) и внезапность развития ТЭЛА.
ТЭЛА занимает третье место среди сердечно-сосудистых заболеваний с частотой 100–200 случаев на 100 000 населения в год и требует исключения ряда патологий и состояний (онкологических заболеваний, дисфункции почек, анемии, беременности, нарушения коагуляции), которые могут лежать в основе ее развития [4, 5].
В ходе детального изучения анамнеза пациентки, включая акушерский (наличие двух здоровых детей, родившихся в результате двух беременностей, протекавших без патологии), результатов лабораторных и инструментальных исследований были исключены наследственные изменения коагуляции. Онкологический процесс маловероятен, что подтверждалось отсутствием типичных жалоб и характерной клинической картины, злокачественных образований у ближайших родственников, а также наличием нормальных показателей лабораторных и инструментальных методов обследования, проводимых регулярно при диспансеризации. Кроме вышеперечисленного, в анамнезе пациентки отсутствовали длительная иммобилизация нижних конечностей, оперативные вмешательства и прием оральных контрацептивов.
Важно отметить, что клиническая картина ТЭЛА в описанном случае возникла внезапно, при отсутствии типичных причин, располагающих к ее появлению, однако определенная хронологическая последовательность позволила заподозрить ее связь с COVID-19. В патогенезе новой коронавирусной инфекции поражение микроциркуляторного русла играет важнейшую роль [3], в связи с чем среди ее разнообразных клинических и морфологических «масок» выделяют в том числе и тромбоэмболическую.
Через 2 нед от момента появления первых симптомов заболевания и амбулаторного лечения у пациентки возникло синкопальное состояние. По результатам обследования в приемном отделении был установлен диагноз коронавирусной инфекции средней тяжести течения с развитием двухсторонней интерстициальной пневмонии с минимальным поражением паренхимы легких. Спустя 3 дня пациентка была выписана из стационара для продолжения лечения в амбулаторных условиях в связи со стабилизацией состояния. Через 4 дня после выписки из стационара были зафиксированы 3 эпизода синкопальных состояний в течение суток, что привело к самостоятельному обращению пациентки за медицинской помощью в приемное отделение, где и была диагностирована массивная ТЭЛА.
Согласно последним исследованиям, протромботические изменения при COVID-19 имеют несколько механизмов, включающих диссеминированное внутрисосудистое свертывание, легочную внутрисосудистую коагулопатию или микроциркуляторный обструктивный тромбовоспалительный синдром легких (MicroCLOTS), вторичный гемофагоцитарный лимфогистиоцитоз, тромботическую микроангиопатию и эндотелиит с повышенной гиперкоагуляцией. Они развиваются на фоне эндотелиальной дисфункции, вероятно, вызываемой экспрессией рецепторов ангиотензинпревращающего фермента 2-го типа (АПФ 2) и индукцией агрегации тромбоцитов [6–8].
В патогенезе COVID-19 важным элементом противовирусной защиты выступает врожденный клеточный иммунитет, включающий полиморфноядерные нейтрофилы, склонные к нетозной трансформации. Нетоз сопровождается выбрасыванием из погибающих нейтрофилов нитей, состоящих в основном из ДНК. При этом нейтрофилы как источники внеклеточных ловушек играют одну из значимых ролей в тромботических осложнениях при COVID-19 [9, 10].
Интерес к коагулопатии при COVID-19 обусловлен ее ассоциацией с риском смерти. Кроме того, у пациентов с этим заболеванием выявляется артериальный и венозный тромбоз [11, 12], который развился у пациентки в представленном наблюдении.
Сообщается о значительном количестве случаев возникновения на фоне новой коронавирусной инфекции тромбозов артерий, глубоких вен нижних конечностей, ТЭЛА и отмечается, что эти изменения могут быть схожи с венозным тромбозом без COVID-19. В связи с этим предлагается рассматривать это заболевание как системный васкулит и лечить осложнения со стороны системы гемостаза при COVID-19 так же, как при других заболеваниях [13].
Назначение низкомолекулярных гепаринов в профилактических дозах показано всем госпитализированным пациентам с COVID-19 и должно продолжаться как минимум до выписки [3], что не было применено по отношению к пациентке Д. во время стационарного лечения с 06.07.2021 по 14.07.2021.
Лечение антикоагулянтами ТГВ/ТЭЛА, ассоциированных с COVID-19, следует продолжать не менее 3 мес при отсутствии абсолютных противопоказаний [3]. Обязательный курс антикоагулянтной терапии может быть продлен до 6 мес в определенных ситуациях, что диктует необходимость длительного динамического амбулаторного наблюдения за пациентами. Продление антикоагулянтной терапии на неопределенно долгий срок возможно для пациентки Д., поскольку первый эпизод ТЭЛА возник на фоне преходящего фактора риска в виде коронавирусной инфекции [14].
Вероятно, в рассмотренном случае молодой возраст и отсутствие определенной сопутствующей патологии стали причиной недостаточной настороженности врачей в отношении развития осложнений НКВИ.
ЗАКЛЮЧЕНИЕ
Представленное клиническое наблюдение молодой пациентки свидетельствует об объективных трудностях в преемственности между стационарным и амбулаторным этапом, хотя следует отметить верную тактику врача амбулаторного звена, правильное и оперативное обследование пациентки в приемном отделении.
Учитывая высокую частоту возникновения тромбоэмболических осложнений при COVID-19, эта проблема диктует необходимость клинической настороженности даже в случае пациентов молодого возраста и рассмотрения возможности назначения антикоагулянтной терапии независимо от условий лечения. Антикоагулянты могут быть предложены пациентам с высоким риском развития гиперкоагуляции, что позволит облегчить течение заболевания и ускорить процесс выздоровления. Диспансерное наблюдение пациентов, перенесших новую коронавирусную инфекцию, требует контроля показателей свертываемости крови, в том числе и после выписки из стационара.
Информированное согласие
От пациентки было получено письменное добровольное информированное согласие на публикацию результатов ее обследования и лечения (дата подписания 01.09.2021).



