ВВЕДЕНИЕ
Опухоли сердца относятся к редкой патологии с высоким риском развития фатальных осложнений и представляют особый интерес с точки зрения ранней диагностики в амбулаторных условиях вследствие низкой доступности специализированных методов исследования и сложности проведения полного объема диагностического алгоритма.
Частота первичных опухолей сердца, по данным аутопсии, варьирует от 0,002 до 1,5%. В большинстве случаев (до 80%) встречаются доброкачественные образования (миксома, липома, папиллярная фиброэластома, фиброма, рабдомиома, гамартома, гемангиома), которые успешно поддаются хирургическому лечению и имеют благоприятный прогноз [1].
Среди злокачественных опухолей выделяют саркомы, лимфомы и мезотелиомы. На долю сарком приходится 95% случаев. Саркомы сердца чаще диагностируется в возрасте 30–50 лет, частота выявления у мужчин и женщин – 1:1. Опухоль может поражать любой отдел сердца, но наиболее часто обнаруживается в левых камерах сердца. Эхокардиографическая (ЭхоКГ) картина сарком недостаточно специфична, диагностика требует гистологического подтверждения. К ЭхоКГ- критериям злокачественных новообразований относятся малоподвижность/неподвижность опухоли, атипичная локализация, отсутствие у образования ножки, тесная взаимосвязь со структурами сердца или его клапанным аппаратом, интрамуральный рост, наличие экссудативного перикардита [2].
В клинической практике чаще всего диагностируют ангиосаркому (40%), недифференцированную саркому (25%), злокачественную фиброзную гистиоцитоксантому (10–24%), лейомиосаркому (менее 10%), рабдомиосаркому, фибросаркому, липосаркому и остеосаркому [3]. Прогноз при злокачественных новообразованиях сердца неблагоприятный, средняя 5-летняя выживаемость составляет 11% при своевременной диагностике и комбинированной терапии [4].
Сложности выявления опухолей сердца связаны с отсутствием ранней специфической симптоматики. Клинические проявления возникают, когда опухоль достигает критических размеров и вызывает нарушения гемодинамики вследствие обструкции (эмболии) коронарных артерий, приносящих или выносящих сосудов сердца или развития сердечной недостаточности из-за поражения значительной доли миокарда желудочков. В отдельных случаях опухоль сдавливает или прорастает в проводящую систему сердца, что проявляется нарушениями ритма или проводимости. Нередко небольшие изолированные новообразования желудочков длительное время протекают бессимптомно [5].
Злокачественные новообразования характеризуются возникновением неспецифических симптомов, ассоциированных с системной реакцией организма на секрецию биомаркеров или некрозом опухоли: озноб, лихорадка, слабость, снижение массы тела, миалгии, артралгии, лейкоцитоз, анемия, тромбоцитопения или гипертромбоцитоз, повышение скорости оседания эритроцитов (СОЭ). На поздних стадиях болезни присоединяются симптомы, связанные с метастатическим поражением головного мозга, костной системы, легких и других жизненно важных органов [1].
Учитывая актуальность проблемы и редкую встречаемость новообразований сердца в популяции в целом, представляем клиническое наблюдение, в котором продемонстрированы трудности диагностического поиска саркомы сердца.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент Ж., 42 года, в июне 2021 г. поступил в кардиологическое отделение стационара с жалобами на одышку при малейшей физической нагрузке, сухой кашель, увеличение живота, отеки нижних конечностей, геморрагическую сыпь на коже живота и спины, выраженную слабость.
Из анамнеза заболевания известно, что в январе 2020 г. у пациента диагностировали пароксизм фибрилляции предсердий, который был купирован на фоне медикаментозной терапии. На тот момент, по данным инструментальных методов обследования, органической патологии сердца выявлено не было. Принимая во внимание низкий риск тромбоэмболических осложнений (0 баллов по шкале CHA2DS2-VASc), пациенту был рекомендован прием бисопролола 5 мг/сут.
В феврале 2021 г. состояние пациента ухудшилось, появились лихорадка (до 37,8 °С), сыпь геморрагического характера в области спины и живота, наросли одышка, мышечная слабость, недомогание, что потребовало госпитализации в стационар для уточнения диагноза и верификации причин прогрессирования сердечной недостаточности.
В общем анализе крови отмечался незначительный лейкоцитоз (11,5×109/л), увеличение СОЭ до 38 мм/ч, повышение уровня фибриногена (6,8 г/л), С-реактивного белка (60 мг/л) и креатинкиназы МВ (35 Ед/л). Коагулограмма не изменена, тропонины в пределах референсных значений. Электрокардиографически (ЭКГ) зарегистрированы диффузные нарушения процессов реполяризации миокарда левого желудочка, наиболее выраженные в области задней стенки.
По результатам трансторакальной ЭхоКГ выявлено незначительное количество жидкости в полости перикарда.
При рентгенографии органов грудной клетки и ультразвуковое исследование (УЗИ) органов брюшной полости патологии не обнаружено.
Клиническая картина требовала проведения дифференциального диагноза между инфекционным эндокардитом и миокардитом. Состояние пациента было расценено как миокардит, назначено соответствующее лечение (преднизолон 90 мг/ сут, бисопролол 10 мг/сут, цефтриаксон 2,0 г/сут, фуросемид 40 мг/ сут и спиронолактон 50 мг/сут), на фоне которого купировались симптомы сердечной недостаточности, разрешилась сыпь, к моменту выписки из стационара исчезли признаки гидроперикарда. Достоверную причину миокардита на данном этапе установить не удалось.
При очередном поступлении в терапевтический стационар 26.07.2021 состояние пациента резко ухудшилось и расценивалось как тяжелое. Данные осмотра: рост 176 см, вес 90 кг. Определялись желтушность кожных покровов и склер глаз, набухание шейных вен, отеки до средней трети голеней. Сатурация крови кислородом (SpO2) в состоянии покоя 95%. Над всей поверхностью легкими выслушивалось усиленное везикулярное дыхание, в области базальных отделов с обеих сторон ослабленное везикулярное дыхание со множеством влажных мелкопузырчатых хрипов. Частота дыхательных движений (ЧДД) в покое 20/мин. Границы относительной сердечной тупости: правая (от правого края грудины) – на 1,5 см кнаружи, верхняя – по нижнему краю III ребра слева, левая – на 1 см кнаружи от среднеключичной линии, поперечник сердца расширен. Тоны сердца ритмичные, глухие. Частота сердечных сокращений (ЧСС) 92 уд/ мин. Артериальное давление (АД) 110 и 70 мм рт.ст. Живот мягкий, незначительно увеличен в объеме, безболезненный. Печень выступает на 2 см из-под края реберной дуги. Селезенка не пальпируется.
Данные общего анализа крови: гемоглобин – 122 г/л; лейкоциты – 4,68×109/л; эритроциты – 4,85×1012/л; тромбоциты 119×109/л; гематокрит – 44,3%; нейтрофилы – 47,4%; лимфоциты – 35,5%; моноциты – 15,2%; эозинофилы – 1,3%; базофилы – 0,6%; СОЭ – 28 мм/ч.
Данные биохимического анализа крови: С-реактивный белок – 104,69 мг/л; общий билирубин – 34,7 мкмоль/л; общий белок – 60,6 г/л; альбумины – 33 г/л; мочевина – 4,6 ммоль/л; креатинин – 86,2 мкмоль/л; аланинаминотрансфераза (АЛТ) – 269,7 Ед/л; аспартатаминотрансфераза (АСТ) – 129 ед/л; альфа-амилаза – 25 Ед/л; креатинфосфокиназа общая – 39,1 Ед/л.
Общий анализ мочи – без патологических отклонений.
Показатели коагулограммы: протромбиновый индекс по Квику – 72,2%; активированное частичное тромбопластиновое время (АЧТВ) – 36,4 с; Д-димер – 2470 мг/мл; протромбиновое время – 14,3 с; фибриноген – 2,29 г/л; международное нормализованное отношение (МНО) – 1,19.
Результаты рентгенографии органов грудной клетки: расширение размеров сердца в поперечнике. Легочные поля без очагово-инфильтративных изменений. Двусторонний гидроторакс.
Данные ЭКГ: нерегулярный синусовый ритм с ЧСС 76 уд/мин. Вертикальное положение электрической оси сердца. Диффузные нарушения процессов реполяризации миокарда левого желудочка, наиболее выраженные в области верхушки и заднебоковых отделов.
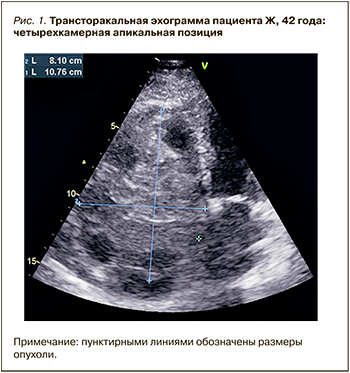
Данные трансторакальной ЭхоКГ (рис. 1): визуализируется объемное образование неправильной формы размером 8,1×10,7 см, обтурирующее правое атриовентрикулярное отверстие и простирающееся в полости правого предсердия и правого желудочка, неоднородной эхогенности. Глобальная сократительная способность левого желудочка сохранена. Фракция выброса левого желудочка 68%. Нарушение диастолической функции левого желудочка 1-го типа. Перикард без особенностей.
Результаты УЗИ органов брюшной полости и сосудов нижних конечностей: в брюшной полости определяется значительное количество гомогенной жидкости в верхних отделах и по боковым каналам, расцениваемое как асцит. Диффузные изменения паренхимы печени. Признаки портальной гипертензии. Определяется тромбоз инфраренального отдела нижней полой вены с реканализацией до 40%. Тромбоза глубоких и поверхностных вен не выявлено.
На основании результатов проведенных исследований был установлен основной диагноз: образование правого предсердия и правого желудочка с обструкцией правого атриовентрикулярного отверстия. Осложнение основного заболевания: Легочная гипертензия. Хроническая сердечная недостаточность 2Б стадия, IV функциональный класс (NYHA). Двусторонний гидроторакс. Портальная гипертензия. Асцит. Тромбоз нижней полой вены. Анемия легкой степени тяжести. Вторичная тромбоцитопения.
Пациент был экстренно переведен в специализированное кардиохирургическое отделение, где для планирования объема оперативного вмешательства ему была выполнена компьютерная томография (КТ) органов грудной клетки с контрастированием и магнитно-резонансная томография (МРТ) сердца с контрастированием препаратом Магневист.
На серии срезов КТ высокого разрешения (КТВР) органов грудной клетки с контрастным препаратом (Омнипак 300 мг/мл – 60 мл) выявлено объемное образование неоднородной структуры с наличием гиподенсных участков и зон мягкотканной плотности, участков гиперваскуляризации во всех камерах сердца, преимущественно в правых отделах (рис. 2). Отмечено прорастание межпредсердной и межжелудочковой перегородки мягкотканными структурами с истончением стенок обоих предсердий. В структуре мягкотканных масс определяются единичные кальцинаты. В плевральных полостях с обеих сторон выявляется жидкость справа до 500 мл, слева до 80 мл. Легкие воздушны, без очаговых и инфильтративных изменений. Трахея, бронхи с обеих сторон обычного калибра, просвет сохранен, стенки бронхов не утолщены. Внутригрудные лимфатические узлы не увеличены.
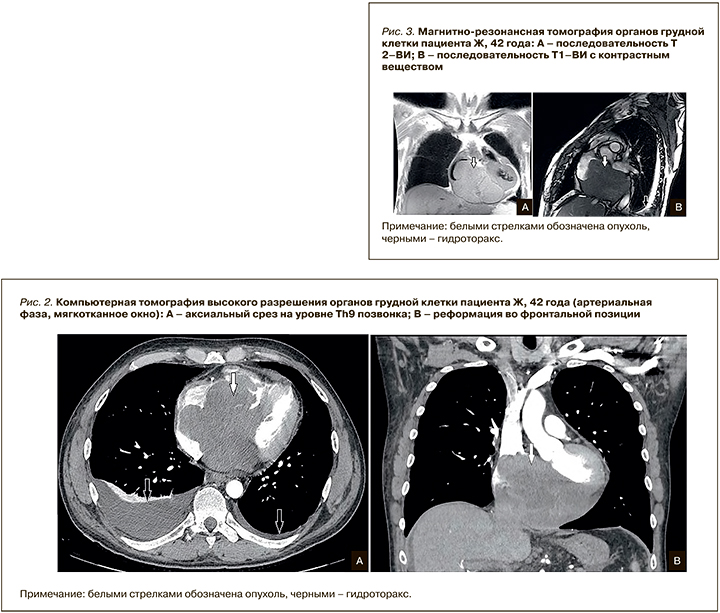
Результаты МРТ органов грудной клетки с контрастированием (рис. 3): в полости сердечной сумки, преимущественно по диафрагмальной поверхности сердца и вдоль правых отделов, определяется объемное образование неправильной формы, с бугристыми контурами, преимущественно изоинтенсивного магнитно-резонансного сигнала. Образование приводит к сдавлению правых отделов сердца, распространяется в правую атриовентрикулярную борозду, на фиброзное кольцо и створки трикуспидального клапана с его обструкцией. Меньшее по объему, но схожее по магнитно-резонансной картине образование визуализируется в полости перикарда вдоль передней стенки левого желудочка. При введении контрастного препарата образования накапливают контрастное вещество.
Учитывая крайне тяжелое состояния пациента, обусловленное тотальным сдавлением правых отделов сердца с выраженными нарушениями внутрисердечной гемодинамики и оттоком крови по системе нижней полой вены, высокую вероятность развития жизнеугрожающих осложнений, консилиум кардиохирургов принял решение о резекции новообразования сердца в условиях искусственного кровообращения в срочном порядке. Абсолютные противопоказания к оперативному вмешательству отсутствовали. Риск летального исхода по системе оценки EuroSCORE II – высокий [6].
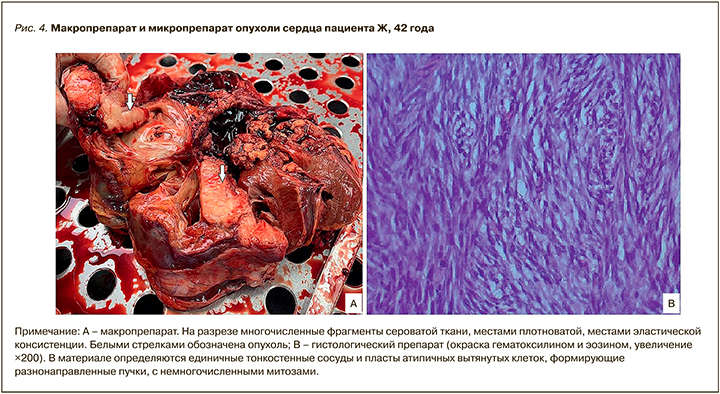
В условиях искусственного кровообращения 28.07.2021 пациенту было удалено образование правого предсердия и правого желудочка размером 10,7×9,5×8,2 см.
Заключение иммуногистологического исследования препаратов опухоли: недифференцированная плеоморфная саркома (рис. 4).
После проведенной операции больной переведен в реанимационное отделение в тяжелом состоянии с выряженными проявлениями сердечно-сосудистой и полиорганной недостаточности. Несмотря на проводимый комплекс реанимационных и лечебных мероприятий, пациент умер, не приходя в сознание, на четвертые сутки после операции.
ОБСУЖДЕНИЕ
Проблема ранней диагностики опухолей сердца остается актуальной в клинической практике, что во многом обусловлено редкостью данной патологии, разнообразием клинической картины заболевания, отсутствием специфических биохимических и иммунологических маркеров опухолевого процесса, относительно невысокой чувствительностью скрининговых методов диагностики. Все это приводит к тому, что с момента начала заболевания и до верификации диагноза проходит несколько месяцев или лет.
Многообразие системной и локальной симптоматики в случае новообразований сердца сопряжено с частыми диагностическими ошибками в клинической практике. В литературе описаны клинические случаи, в которых больным с опухолями сердца первоначально устанавливали различные диагнозы: железодефицитная анемия, внебольничная пневмония, интерстициальное поражение легких, тромбэндокардит, инфекционный эндокардит [7].
В нашем клиническом примере дебют заболевания, вероятно, проявился эпизодом фибрилляции предсердий, который соответствует локализации и ранним симптомам саркомы. Последующая диагностика осложнилась присоединением клинической симптоматики сердечной недостаточности в сочетании с системными проявлениями, что потребовало проведения дифференциального диагноза с инфекционным эндокардитом и миокардитом. Кроме того, длительное время новообразование не удавалось выявить с помощью трансторакальной ЭхоКГ, несмотря на то что чувствительность этого метода при диагностике опухолей сердца достигает 93,3% [8].
Стоит отметить, что диагностические возможности ЭхоКГ значительно снижаются при локализации опухоли в правом желудочке и правом предсердии из-за трудности полной визуализации и ограниченной разрешающей способности ультразвука, предел которого составляет 1–3 мм. Визуализация опухоли зависит от характера ее роста: опухоль, которая растет в полость предсердий или желудочков, обнаружить легче, чем ту, что прорастает в миокард.
Естественные анатомические структуры, расположенные в полости правого желудочка (трабекулы и модераторный пучок) и правого предсердия (сеть Хиари – непатологическая подвижная тонкая сетчатая структура, Евстахиев клапан – заслонка нижней полой вены), при выполнении ЭхоКГ нередко имитируют объемные образования сердца и могут маскировать опухолевый процесс. В связи с этим решающее значение в ранней диагностике приобретает опыт врача ультразвуковой диагностики: при отсутствии настороженности в отношении онкологических заболеваний изменения опухолевого происхождения могут быть расценены как артефакт [5].
Множественная прогрессирующая симптоматика, как в данном клиническом наблюдении, демонстрирует целесообразность раннего использования в диагностическом процессе КТВР органов грудной клетки и МРТ сердца, даже при отсутствии значимых изменений на ЭхоКГ. Особенно это актуально для своевременного обнаружения новообразований сердца при дифференциальной диагностике некоронарогенных причин сердечной недостаточности у лиц молодого возраста (20–40 лет) с низким риском сердечно-сосудистых заболеваний.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай демонстрирует низкую диагностическую возможность трансторакальной ЭхоКГ на ранней стадии недифференцированной плеоморфной саркомы при ее локализации в правых отделах сердца и инвазивном росте в миокард, а также позволяет обосновать расширение показаний для более раннего применения высокотехнологичных методов диагностики (КТВР органов грудной клетки и МРТ сердца с контрастированием) у молодых пациентов с прогрессирующей сердечной недостаточностью.



