ВВЕДЕНИЕ
Пациент с коморбидной патологией является сложной задачей для всех звеньев современного здравоохранения [1–3]. Результатами многочисленных исследований доказано, что наличие сердечно-сосудистой коморбидности в виде инфаркта миокарда (ИМ) у пациентов с хронической обструктивной болезнью легких (ХОБЛ) выступает фактором, способствующим прогрессированию клинических проявлений респираторной патологии [4–7]. К особенностям же сердечно-сосудистой патологии на фоне ХОБЛ относится частое развитие осложнений и высокая вероятность летального исхода [8–11].
При этом в последние десятилетия накопилось достаточно данных о том, что при заболеваниях как сердечно-сосудистой, так и бронхолегочной системы развивается синдром эндогенной интоксикации (СЭИ) [12–14]. Он характеризуется профицитом продуктов катаболизма, оказывающих системное токсическое воздействие. Эндотоксикоз через целый ряд патологических механизмов проявляет значительное влияние на клиническое течение и исход заболевания [15, 16]. Таким образом, коррекция СЭИ может способствовать улучшению течения заболевания и прогноза, что особенно важно у пациентов с коморбидной патологией с учетом наличия пересекающихся звеньев патогенеза и развития эндотоксикоза.
Достоверными маркерами эндогенной интоксикации признаны молекулы средней массы, включающие вещества средней и низкой молекулярной массы и олигопептиды [17, 18].
Цель исследования – оценить влияние глубины очага кардионекроза на выраженность СЭИ путем изучения вещества средней и низкой молекулярной массы (ВСиНММ) и олигопептидов (ОП) у больных с ИМ на фоне ХОБЛ.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 225 больных с диагнозом ИМ. Лечение и обследование пациентов проводилось на базе регионального сосудистого центра ГБУЗ АО «Александро-Мариинская областная клиническая больница» (г. Астрахань) в 2016–2019 гг.
Исходя из цели исследования, его участники были разделены на две группы:
- основная группа – 195 пациентов с ИМ на фоне ХОБЛ;
- группа сравнения – 130 пациентов с ИМ без ХОБЛ.
Каждая группа в свою очередь была разделена на две подгруппы в зависимости от наличия зубца Q на электрокардиограмме (ЭКГ). В основной группе у 49 человек имел место ИМ без зубца Q (не-Q-ИМ), у 146 – с зубцом Q (Q-ИМ). В группе сравнения распределение было следующим: 29 человек с не-Q-ИМ, 101 – с Q-ИМ.
Для диагностики ИМ применялись клинические рекомендации «Четвертое универсальное определение инфаркта миокарда» от 2018 г. [19]. Все пациенты с ИМ поступили в сосудистый центр первые 2 ч от момента начала заболевания и подверглись коронарографическому обследованию с выполнением стентирования. Лечение ИМ осуществлялось в соответствии с действовавшими на тот момент клиническими рекомендациями [20, 21]. У 112 человек заболевание возникло впервые, у 28 – повторно. Медиана возраста больных ИМ составила 54,6 [44; 65] лет. Среди пациентов с ИМ без ХОБЛ было 89 мужчин и 41 женщина.
У всех больных ИМ на фоне ХОБЛ диагноз легочной патологии был верифицирован ранее. Для установления диагноза и определения степени тяжести ХОБЛ использовали клинические рекомендации GOLD 2019 г. пересмотра [22]. В этой группе пациентов были отмечены средняя и тяжелая степени тяжести легочного процесса, длительность течения ХОБЛ составила 16,4 [2; 23] года. Анамнез курения имелся у 100% больных, на момент исследования доля курящих лиц составила 88,2%. Индекс курения равнялся 34,5 [19; 47] пачка/лет. Медиана возраста пациентов с ИМ на фоне ХОБЛ составила 48,6 [42; 65] лет. Впервые возникший ИМ был диагностирован у 123 человек, повторный – у 72. В этой группе было 189 мужчин и 6 женщин.
Критериями исключения из исследования служили возраст старше 65 лет, наличие хронических заболеваний – сахарного диабета, артериальной гипертензии, хронических заболеваний почек, психических заболеваний, онкопатологии.
Группу контроля составили 110 соматически здоровых лиц из числа пациентов без соматической патологии, проходящих диспансеризацию в поликлиниках г. Астрахани. Все они были сопоставимы по возрастным и половым характеристикам с обследуемыми больными.
Данная работа представляет собой поперечное исследование, проведение которого было одобрено Региональным независимым этическим комитетом (от 18.01.2016, протокол №12). Все пациенты дали документированное согласие на участие в исследовании.
Уровень ВСиНММ и ОП определялся по методу М.Я. Малаховой (1995) путем прямой спектрометрии на спектрофотометре Cary 50 Scan UV VS (Varian, Австралия) при длинах волн 254 и 280 нм (238–310). Шаг длины волны составил 4 нм. Расчет ВСиНММ производился путем интегрального измерения площади фигуры между осью абсцисс и спектральной кривой экстинкций в области 238–300 нм для каждой пробы. Формула определения уровня ВСиНММ мочи (усл. ед.): (Е238 + Е242 + Е246 + Е250 + … + Е310) × 4.
Статистический анализ полученных данных проводился при помощи программы SPSS, версия 26.0. Проверка на нормальность распределения количественных признаков в группах и отдельных подгруппах осуществлялась с использованием частотных гистограмм, критериев Колмогорова–Смирнова и Шапиро–Уилка (при количестве наблюдений менее 60). Поскольку распределение было отличным от нормального, значения оценивались в виде медианы, 25-го и 75-го процентилей. Для выявления статистической значимости в трех и более исследуемых группах использовался критерий Краскела–Уоллиса с поправкой Бонферрони с последующими попарными апостериорными сравнениями групп между собой. При сравнении пяти групп уровень статистической значимости был равен 0,005. При сопоставлении групп по категориальному признаку использовался χ2 Пирсона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При сопоставлении ВСиНММ и ОП плазмы, эритроцитов и мочи методом Краскела–Уоллиса во всех случаях были получены статистически значимые различия. Уровень ВСиНММ плазмы у больных с не Q-ИМ без ХОБЛ составил 9,32 [7,34; 15,34] усл. ед., что было сопоставимо со значениями в группе контроля (p=0,75; рис. 1). У пациентов с Q-ИМ без ХОБЛ этот показатель равнялся 10,89 [8,03; 19,88] усл. ед., что статистически значимо (p <0,001) превышало уровень ВСиНММ плазмы как в группе контроля, так и у больных не Q-ИМ. У участников исследования с не Q-ИМ на фоне ХОБЛ уровень ВСиНММ плазмы достиг 25,68 [10,33; 28,9] усл. ед., что оказалось статистически значимо (p <0,001) выше как относительно контроля, так и пациентов с не-Q-ИМ без ХОБЛ.
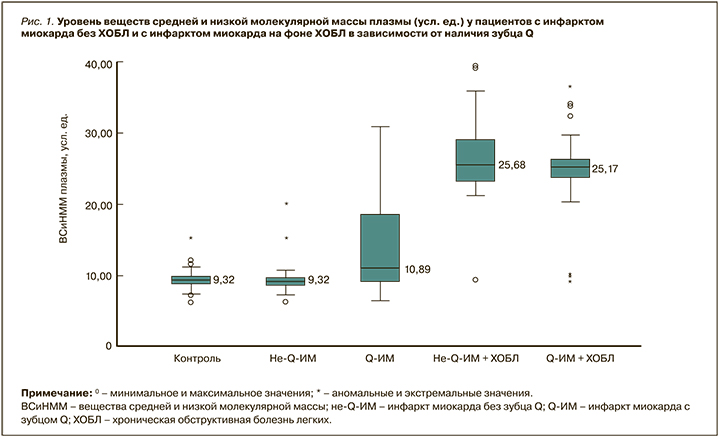
У больных Q-ИМ на фоне ХОБЛ данный показатель составил 25,17 [22,11; 33,98] усл. ед., что оказалось статистически значимо выше, чем у лиц группы контроля (p <0,001) и пациентов с Q-ИМ без ХОБЛ (p <0,001), однако сопоставимо с подгруппой не-Q-ИМ + ХОБЛ (p=0,007).
Медиана уровня ОП плазмы в подгруппе с не- Q-ИМ без ХОБЛ была идентична (p=0,93) таковой в группе контроля – 0,41 [0,31; 0,63] г/л (рис. 2). У больных Q-ИМ без ХОБЛ уровень ОП составил 0,53 [0,39; 0,59] г/л, что было статистически значимо выше, чем у лиц группы контроля (p <0,001), но сопоставимо с подгруппой не-Q-ИМ без ХОБЛ (p=0,007). У пациентов с не-Q-ИМ и Q-ИМ на фоне ХОБЛ ОП плазмы были 0,95 [0,83; 0,98] и 0,96 [0,72; 1,51] г/л соответственно, что оказалось статистически значимо выше (p <0,001) в сопоставлении как с группой контроля, так и с соответствующими подгруппами больных ИМ в качестве мононозологии. Между собой в подгруппах с не-Q и Q-ИМ на фоне ХОБЛ значения ОП плазмы достоверных различий не имели (p=0,56).
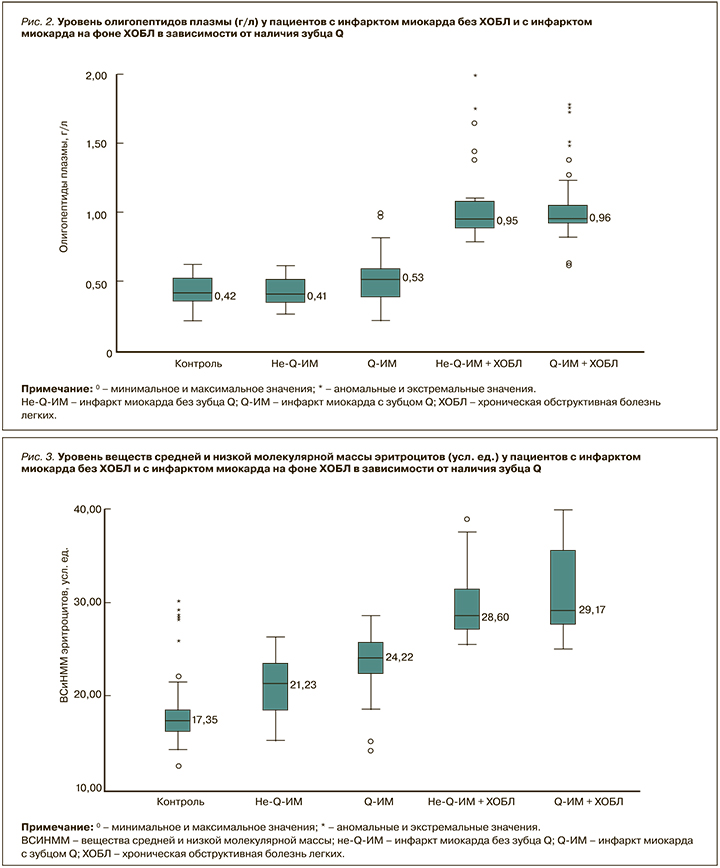
В подгруппах с не-Q-ИМ и Q-ИМ без ХОБЛ уровень ВСиНММ эритроцитов был 21,23 [16,49; 25,91] и 24,22 [19,52; 27,19] усл. ед. соответственно; эти значения статистически значимо (p <0,001) различались и при сравнении с контролем, и между собой (рис. 3).
У пациентов с Q-ИМ на фоне ХОБЛ уровень ВСиНММ эритроцитов равнялся 29,17 [26,32; 37,88] усл. ед., и это было статистически значимо (p <0,001) выше как по сравнению с контролем, так и больными не-Q-ИМ без ХОБЛ. Уровень ВСиНММ эритроцитов у лиц с Q-ИМ на фоне ХОБЛ практически не отличался (p=0,49) от значений в подгруппе не-Q-ИМ + ХОБЛ, где он составил 28,6 [26,23; 37,69] усл. ед. При этом он был статистически значимо (p <0,001) выше, чем в группе контроля и в группе больных Q-ИМ без ХОБЛ.
Как видно из рисунка 4, уровень ОП эритроцитов у больных не-Q-ИМ без ХОБЛ составил 0,69 [0,52; 0,79] г/л, не отличаясь достоверно от значений в группе контроля (p=0,62). У пациентов с Q-ИМ без ХОБЛ регистрировались более высокие значения этого параметра – 0,75 [0,59; 0,83] г/л, что достоверно превосходило значения в группе контроля (p <0,001) и в подгруппе не-Q-ИМ без ХОБЛ (p=0,002). Медиана уровня ОП эритроцитов в подгруппах пациентов с ИМ на фоне ХОБЛ составила 0,97 [0,84; 1,64] г/л в случае не-Q-ИМ и 0,99 [0,85; 1,66] г/л при Q-ИМ, что было сопоставимо (p=0,93). В обоих случаях это было статистически значимо (p <0,001) выше значений в группе контроля и в соответствующих подгруппах больных ИМ без ХОБЛ.
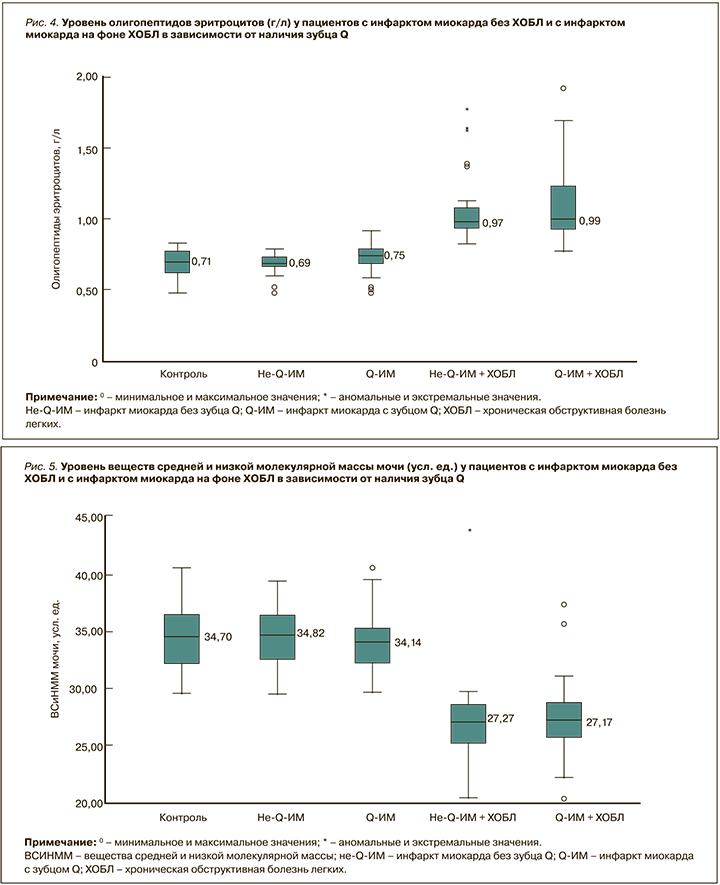
Несколько иные закономерности наблюдались при анализе молекул средней массы в моче (рис. 5). Уровень ВСиНММ мочи у больных не-Q-ИМ без ХОБЛ составил 34,82 [29,88; 37,51] усл. ед., что было сопоставимо со значениями в группе контроля (p=0,89), а у пациентов с Q-ИМ без ХОБЛ – 34,14 [30,15; 37,93] усл.ед., что не имело статистически значимых отличий от контроля (p=0,13) и подгруппы не-Q-ИМ + ХОБЛ (p=0,24). У участников исследования с ИМ на фоне ХОБЛ, независимо от наличия зубца Q, уровень ВСиНММ мочи был статистически значимо (p <0,001) ниже, чем в группе контроля – 27,27 [24,18; 30,94] усл. ед. у пациентов с не-Q-ИМ и 27,17 [22,72; 29,69] усл. ед. – с Q-ИМ. При этом у больных не-Q-ИМ в сочетании с ХОБЛ уровень ВСиНММ мочи достоверно превышал соответствующее значение у пациентов с не-Q-ИМ без ХОБЛ (p <0,001), а в подгруппе Q-ИМ + ХОБЛ этот показатель был статистически значимо (p <0,001) выше, чем у участников с Q-ИМ без ХОБЛ.
У пациентов с ИМ без ХОБЛ уровень ОП мочи не зависел от наличия зубца Q и составил 5,62 [4,89; 6,84] г/л в случае не-Q-ИМ и 5,41 [4,88; 6,1] г/л при Q-ИМ (рис. 6). Данные в этих подгруппах не имели статистических различий как между собой (p=0,21), так и по сравнению с контролем (p=0,85 для больных с не-Q-ИМ без ХОБЛ и p=0,08 – для больных с Q-ИМ без ХОБЛ).

В группе ИМ на фоне ХОБЛ уровень ОП мочи достиг 4,27 [3,5; 4,88] г/л при отсутствии зубца Q и 4,16 [3,34; 4,84] г/л при его наличии; эти значения оказались сопоставимы между собой (p=0,36) и статистически значимо ниже относительно контроля (p <0,001) и соответствующих подгрупп участников с ИМ без ХОБЛ (p <0,001).
Поскольку при изучении ВСиНММ и ОП оценивается множество показателей, комплексная интерпретация которых зачастую затруднительна, на основе числовых параметров определяется ряд расчетных индексов, таких как катаболический пул (КП), индекс эндогенной интоксикации (ИЭИ) и коэффициент интоксикации (КИ).
Как следует из таблицы, во всех изучаемых нами подгруппах КП статистически значимо (p <0,001) превосходил значения в группе контроля. У пациентов с не-Q-ИМ без ХОБЛ он равнялся 2,33 [1,17; 2,96], с Q-ИМ без ХОБЛ – 2,53 [2,13; 2,99]. В подгруппах коморбидных больных этот показатель составил 4,83 [4,11; 5,77] при не-Q-ИМ + ХОБЛ и 4,85 [4,22; 5,74] при Q-ИМ + ХОБЛ, что было статистически значимо (p <0,001) выше как по сравнению с контролем, так и соответствующими подгруппами участников с ИМ без ХОБЛ. Вместе с тем между собой показатели КП в подгруппах в зависимости от наличия зубца Q не имели достоверных различий (p=0,01 – в группе пациентов с ИМ без ХОБЛ, p=0,8 – в группе больных ИМ на фоне ХОБЛ).
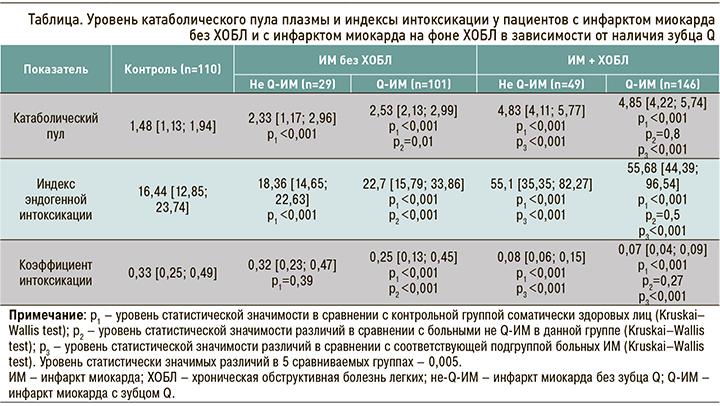
ИЭИ у пациентов с не-Q-ИМ без ХОБЛ достиг 18,36 [14,65; 22,63], что было статистически значимо (p <0,001) выше значений в группе контроля. У участников исследования с Q-ИМ без ХОБЛ этот индекс равнялся 22,7 [15,79; 33,86], что было значимо (p <0,001) выше, чем у лиц группы контроля и в подгруппе больных не-Q-ИМ без ХОБЛ. У больных не Q-ИМ на фоне ХОБЛ ИЭИ статистически значимо (p <0,001) превосходил таковой в группе контроля, составив 55,1 [35,35; 82,27]. У пациентов с Q-ИМ на фоне ХОБЛ он равнялся 55,68 [44,39; 96,54], что было статистически значимо (p <0,001) выше по сравнению с группой контроля, больными Q-ИМ без ХОБЛ, но не имело статистически значимых отличий по сравнению с подгруппой не-Q-ИМ + ХОБЛ (p=0,5).
КИ у пациентов не-Q-ИМ без ХОБЛ достиг величины 0,32 [0,23; 0,47], что было сопоставимо со значениями в контроле (p=0,39). В подгруппе больных с Q-ИМ без ХОБЛ этот коэффициент составил 0,25 [0,13; 0,45], что было статистически значимо (p <0,001) ниже относительно его значений в группе контроля и у участников с не-Q-ИМ без ХОБЛ. У коморбидных пациентов с не-Q-ИМ на фоне ХОБЛ КИ был статистически значимо (p <0,001) ниже как по сравнению с контролем, так и с больными не Q-ИМ без ХОБЛ, – 0,08 [0,06; 0,15]. В подгруппе коморбидных больных с Q-ИМ на фоне ХОБЛ КИ равнялся 0,07 [0,04; 0,09], что было статистически значимо (p <0,001) ниже, чем в контроле и у пациентов с Q-ИМ в виде мононозологии, но не имело статистически значимых отличий по сравнению с больными с не-Q-ИМ на фоне ХОБЛ (p=0,27).
Нам представлялось интересным также сопоставить фазы эндогенной интоксикации в обследуемых группах в зависимости от наличия зубца Q на ЭКГ. Большинство участников исследования с ИМ без ХОБЛ имели I фазу эндогенной интоксикации: она выявлялась у 19 (65,5%) больных не-Q-ИМ и 59 (58,4%) пациентов с Q-ИМ. Однако если у остальных пациентов с не-Q-ИМ неизмененные спектрограммы определялись в 10 (34,5%) случаях, то среди лиц с Q-ИМ – лишь в 2 (2%). У 38 (37,6%) больных Q-ИМ была выявлена II, у 2 (2%) – III фазы эндогенной интоксикации.
Среди лиц с ИМ на фоне ХОБЛ 30 (63,0%) имели III фазу эндогенной интоксикации. В подгруппе не-Q-ИМ + ХОБЛ неизмененные спектрограммы не регистрировались, у 3 (6,1%) определялась I фаза эндогенной интоксикации, у 30 (61,2%) – III фаза. У больных Q-ИМ на фоне ХОБЛ неизмененные спектрограммы также не встречались. У 2 (1,4%) представителей этой подгруппы была установлена I фаза эндогенной интоксикации, у 41 (28,1%) – II фаза. IV фаза эндогенной интоксикации выявлялась только в подгруппе пациентов с Q-ИМ на фоне ХОБЛ – она имела место у 11 (7,5%) человек.
ЗАКЛЮЧЕНИЕ
На сегодняшний день развитие эндотоксикоза при ХОБЛ является неоспоримым фактом, а ВСиНММ признаются убедительными маркерами эндогенной интоксикации [23, 24]. Несмотря на это, количество работ на тему СЭИ, посвященных изучению ВСиНММ и ОП при заболеваниях системы дыхания и кровообращения, невелико [5, 15]. Более того, исследований ВСиНММ у пациентов с кардиореспираторной патологий в доступной нам литературе не встретилось вовсе, что обусловливает актуальность нашего исследования.
Полученные нами результаты продемонстрировали, что объем зоны некроза влияет на уровень эндотоксемии при развитии ИМ в качестве мононозологии. У больных с сочетанной кардиореспираторной коморбидностью доминирующей причиной хронической эндотоксемии выступает ХОБЛ, а развитие острой коронарной патологии на этом фоне лишь усугубляет имеющуюся эндогенную интоксикацию. Нарушение функции органов выделения, имеющее место в общей группе больных ИМ на фоне ХОБЛ, не связано с глубиной поражения миокарда.



