АКТУАЛЬНОСТЬ
Коронавирусная инфекция (COVID-19) – острое инфекционное заболевание, вызываемое новым штаммом вируса из рода коронавирусов SARS-CoV-2, с аэрозольно-капельным и контактно-бытовым механизмом передачи. Патогенетически оно характеризуется локальным и системным иммуновоспалительным процессом, гиперактивностью коагуляционного каскада, эндотелиопатией, гипоксией, приводящим к развитию микро- и макротромбозов, и протекает от бессимптомных до клинически выраженных форм с интоксикацией, поражением сосудов, легких, сердца, почек, желудочно-кишечного тракта с риском развития осложнений (острой дыхательной недостаточности, острого респираторного дистресс-синдрома, сепсиса, шока, синдрома полиорганной недостаточности, тромбоэмболии легочной артерии) [1].
По данным ВОЗ, каждый 9-й человек в мире имеет хроническую болезнь почек (ХБП), и это проблема приобретает масштабы неинфекционной эпидемии. Поражение почек является наиболее частым вариантом нелегочного поражения при COVID-19 в связи с наличием антиотензинпревращающего фермента 2-го типа (АПФ 2) в почках. Частое вовлечение в патологический процесс почек сопровождается широким диапазоном проявлений – от легкой протеинурии и гематурии до прогрессирующего острого повреждения почек (ОПП), требующего применения заместительной почечной терапии (ЗПТ) [2].
ХБП входит в число основных сопутствующих патологий у умерших от COVID-19 пациентов, составляя 23,1% и находясь по частоте на 4-м месте после артериальной гипертонии (66%), сахарного диабета 2-го типа (29%) и ишемической болезни сердца (27,9%) [3].
В настоящем обзоре изучено влияние новой коронавирусной инфекции COVID-19 на почки, а именно факторы риска и механизм развития ОПП, на прогрессирование хронической почечной недостаточности, а также проведено сравнение тяжести заболевания, уровня смертности, потребности лечения в условиях отделения реанимации и интенсивной терапии (ОРИТ) и необходимости искусственной вентиляции легких (ИВЛ) у пациентов с ХБП.
МАТЕРИАЛ И МЕТОДЫ
Проанализированы оригинальные работы, опубликованные в 2020–2021 гг. в базах данных PubMed, Web of Science, Scopus, Sciece direct, eLIBRARY. Оригинальные исследования, включенные в настоящий анализ, были сгруппированы по нозологическому принципу: исследования, посвященные изучению острого почечного повреждения при COVID-19 (табл. 1), и исследования освещающие проблемы влияния новой коронавирусной инфекции на пациентов с ХБП (табл. 2).
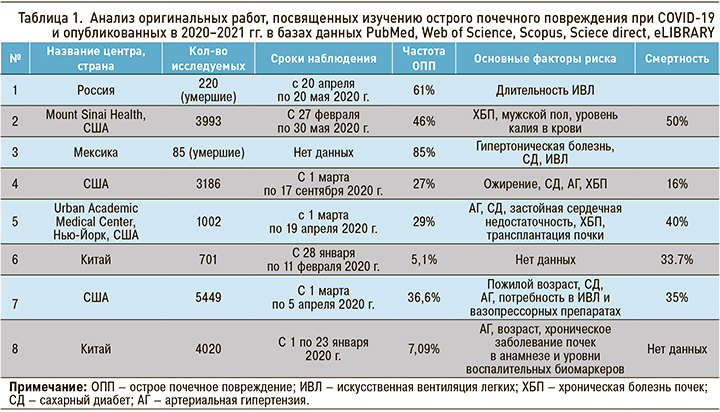

МЕХАНИЗМЫ, ЧАСТОТА РАЗВИТИЯ И ИСХОДЫ ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ ПРИ COVID-19
Частота ОПП при COVID-19 в наблюдениях разных авторов колеблется в широком диапазоне – от 5,1 до 46 %, а его развитие сопряжено с высокой смертностью – до 85 % [2].
Механизмы ОПП являются многофакторными и обычно включают острый респираторный дистресс-синдром взрослых (ОРДСВ), сепсис, гемодинамические изменения, цитотоксические эффекты, синдром высвобождения цитокинов, рабдомиолиз, микроангиопатию и коллапсирующую гломерулопатию [4–6], развитие ишемии почек в следствие гиперкоагуляции [7]. Появляется все больше доказательств того, что дисфункция многих органов связана с активацией комплемента и высвобождением цитокинов [8].
Одно из самых первых исследований, которое показало связь между поражением почек и неблагоприятным исходом пациентов с COVID- 19, было проведено в Китае с участием 701 пациента. При поступлении повышенный уровень креатинина наблюдался у 14,4% исследуемых, расчетная скорость клубочковой фильтрации (рСКФ) <60 мл/мин на 1,73 м2 отмечалась у 13,1% пациентов. У 43,9% больных имелась протеинурия, у относительно меньшего числа пациентов (26,7%) – гематурия. ОПП возникло у 5,1% пациентов и было значительно выше у лиц с повышенным исходным уровнем креатинина сыворотки (11,9%), чем у больных с нормальными исходными значениями (4,0%). Было выяснено, что с внутрибольничной смертью в большей степени ассоциированы протеинурия любой степени, гематурия любой степени, повышенный исходный уровень мочевины, креатинин сыворотки, пик креатинина сыворотки >133 ммоль/л и ОПП выше 2-й стадии [9].
Следующее большое исследование было выполнено в США, с участием 5449 пациентов. Данные его резко отличались от тех, что были получены ранее в Китае. Из 5449 пациентов, госпитализированных с COVID-19, ОПП развилась у 36,6%. Из них 14,3% потребовалась заместительная почечная терапия (ЗПТ). ОПП в основном наблюдалась у больных с дыхательной недостаточностью, при этом на ИВЛ ОПП развилось у 89,7% пациентов против 21,7% больных без ИВЛ. 96,8% пациентов, нуждающихся в ЗПТ, находились на ИВЛ. Факторы риска ОПП включали пожилой возраст, сахарный диабет (СД), сердечно-сосудистые заболевания, артериальную гипертензию (АГ), потребность в ИВЛ и вазопрессорных препаратах. Среди пациентов с ОПП умерло 694 (35%), 519 (26%) было выписано, 780 (39%) остались госпитализированными [10].
В одноцентровом ретроспективном исследовании в Испании изучались частота развития острой почечной недостаточности, факторы риска развития ОПП и смертность. В результате частота ОПП составила 17,22% среди 3182 госпитализированных пациентов с COVID-19. Наиболее частыми причинами ОПП были преренальные патологии (68,8%) и сепсис (21,9%). ОПП чаще развивалось у пациентов с АГ и ХБП в анамнезе и у пациентов с ОРДС. Исходная функция почек не восстановилась в 45,73% случаев ОПП в целом и у 52,75% пациентов с ОПП с ХБП в анамнезе. Смертность составила 38,5% по сравнению с 13,4% от общей выборки [11].
В ретроспективное исследование Mount Sinai Health (США) было включено 3993 госпитализированных пациентов с 27 февраля по 30 мая 2020 г. В нем изучались следующие параметры: частота развития ОПП, потребность в гемодиализе, восстановление почек после ОПП и смертность. Согласно полученным данным, ОПП развилась у 46% пациентов, из которых 19% нуждались в диализе. В реанимацию поступило 24% пациентов, из них 76% перенесли ОПП. Из 435 пациентов с ОПП в общем анализе мочи у 84% отмечалась протеинурия, у 81% – гематурия и у 60% – лейкоцитурия. Независимыми предикторами тяжелого ОПП служили ХБП в анамнезе, мужской пол и более высокий уровень калия в сыворотке крови. Госпитальная смертность равнялась 50% среди пациентов с ОПП по сравнению с 8% среди пациентов без этого нарушения. Из выписанных пациентов с ОПП у 35% функция почек к моменту выписки восстановилась до исходного уровня, а у 36% – в период постгоспитального наблюдения [12].
Lee J.R. et al. в медицинском центре Нью-Йорка выполнили ретроспективное исследование, которое включило 1002 пациентов, поступивших с 1 марта по 19 апреля 2020 г. в отделение неотложной помощи. ОПП в этом исследовании развилось у 29% больных, при этом они были старше и чаще имели в анамнезе АГ, СД, застойную сердечную недостаточность, ХБП и трансплантацию почки, чем пациенты без ОПП. Протеинурия и гематурия чаще встречалась у пациентов с ОПП, чем без ОПП. Исходный уровень креатинина, креатинин при поступлении, пиковый креатинин, лейкоциты, прокальцитонин, тропонин I, С-реактивный белок, D-димер, ферритин, лактатдегидрогеназа, лактат и креатинкиназа были также значительно выше у пациентов с ОПП, тогда как уровни гемоглобина и альбумина – значительно ниже. Пациенты с ОПП чаще находились в отделении интенсивной терапии и на ИВЛ, также имели более длительный срок пребывания в стационаре, в сравнении с больными без ОПП. У пациентов с ОПП смертность была выше, чем у больных без ОПП (40 против 8%). Среди пациентов с ОПП у 48% восстановилась исходную функцию почек, у оставшихся 52% – нет [13].
Также было проведено несколько исследований, где оценивалось повреждение почек у умерших пациентов, сравнивались клинические и морфологические проявления почечной патологии.
Так, в исследовании Е.С. Столяревича с соавт. изучались клинические и морфологические проявления почечной патологии у пациентов, умерших от COVID-19. Оно включило 220 пациентов, умерших в период с 20 апреля по 20 мая 2020 г. от COVID-19. ОПП развилось у 61% пациентов. Частота ОПП значимо не различалась в зависимости от исходной функции почек, составив 66 и 61% при ХБП и исходно нормальной функции. Единственным значимым предиктором развития ОПП оказалась длительность ИВЛ (6,1 против 1,7 дней). Число пациентов, получавших ИВЛ либо ЭКМО в течение 5 и более дней, составило 43% при ОПП против 10% при нормальной функции почек [14].
В многоцентровом обсервационном исследовании умерших пациентов с COVID-19 в трех центрах третьего уровня в Мехико оценивалась посмертная биопсия почки. Всего в это исследование вошло 85 участников (69% мужчин). Средний возраст их равнялся 57 лет, индекс массы тела – 29 кг/ м2, 51% имели в анамнезе СД, 46% – АГ. ОПП присутствовала у 85% больных. В общей сложности ЗПТ потребовалась 18% пациентов. Среди больных с тяжелым ОПП у 83% функция почек не восстановилась, тогда как у 9% было отмечено частичное ее восстановление, а у 9% – полное. Результаты биопсии показали наличие фокально-сегментарного гломерулосклероза у 29%, диабетическую нефропатию – у 27%, атеросклероз – у 81% пациентов [15].
ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК КАК ЗАБОЛЕВАНИЕ, ПОВЫШАЮЩЕЕ РИСК ТЯЖЕЛОГО ТЕЧЕНИЯ COVID-19 И НЕБЛАГОПРИЯТНОГО ИСХОДА
ХБП выступает важным сопутствующим заболеванием, которое коррелировало с повышенной смертностью во время предыдущих эпидемий, таких как грипп, по сравнению с населением в целом. Пациенты с ХБП, как правило, старше, чаще страдают дополнительными заболеваниями и имеют определенную степень иммунной дисфункции [16–18]. Кроме того, инфекция служит одной из основных причин смертности при терминальной стадии почечной недостаточности. Для больных с ХБП характерны значительно повышенная частота госпитализаций по поводу пневмонии и сепсиса, а также более длительное пребывание в стационаре [19]. Не исключением является и инфекция, вызванная вирусом SARS-CoV-2. ХБП – важное коморбидное состоянием, связанное с неблагоприятными исходами [16, 17, 20]. При этом у пациентов с ХБП в анамнезе чаще развивается ОПП – в среднем в 2,5 раза чаще, чем у пациентов без этого заболевания [21].
Williamson E.J. et al. опубликовали крупнейший анализ факторов риска тяжелого течения COVID- 19, приводящих к смерти, изучив данные более чем 17 млн взрослых с почти 11 000 смертей, связанных с новой коронавирусной инфекцией. ХБП была среди состояний, сопровождающихся самым высоким риском смерти. Вероятность смерти в группе с ХБП была выше, чем риск смерти от COVID-19 у пациентов с СД и с хроническими заболеваниями сердца [22].
В многоцентровом когортном ретроспективном исследовании TriNetX изучалось влияние ХБП при COVID-19 с учетом сопутствующих заболеваний. В него вошли пациенты в возрасте от 18 лет с диагнозом COVID-19 в период с 20 января по 10 сентября 2020 г. Всего исследование охватило 152 463 пациента с COVID-19 (8810 с ХБП и 143 653 без ХБП). Получены результаты свидетельствуют, что пациенты с ХБП по сравнению с больными без этого заболевания имели более высокую смертность (9,4 против 5,8%), частоту госпитализаций (41,5 против 28,5%) и потребность в ИВЛ (7,1 против 4,1%) [23].
В ретроспективное кагортное исследование в Нью-Йорке вошли 280 пациентов с ХБП и 4098 без нее. Госпитальная смертность в первой когорте составила 30 против 20% во второй. Риск внутрибольничной смерти у пациентов с ХБП оставался выше, чем у пациентов без ХБП, после поправки на сопутствующие заболевания – АГ, СД, астму и хроническую обструктивную болезнь легких. При стратификации по возрасту пожилые пациенты с ХБП (>70 лет) имели более высокую смертность в сравнении с пациентами того же возраста, но без ХБП. У больных ХБП факторами, связанными с внутрибольничной смертностью, были возраст, исходный уровень фосфора в сыворотке при поступлении, креатинин сыворотки при поступлении на 0,3 мг/дл выше исходного уровня и развитие ОПП во время госпитализации [21].
В многоцентровом обсервационном когортном исследовании в Испании было доказано, что пациенты с ХБП подвергаются высокому риску смерти и развитию ОПП. Исследование включало 136 пациентов с ХБП, не нуждающихся в ЗПТ, и 136 пациентов из группы сравнения. У пациентов с ХБП наблюдались более высокое количество лейкоцитов и D-димера и более низкое содержание лимфоцитов. Различий в симптомах при поступлении выявлено не было. ХБП ассоциировалась с более высокой частотой ОПП (61 против 24,3%) и смертности (40,4 против 24,3%). Вместе с тем было выяснено, что статус ХБП не обусловливал госпитализацию в ОРИТ или продолжительность пребывания в стационаре [19].
Ретроспективный анализ в трех больницах в США показал, что общая госпитальная смертность от COVID-19 была самой высокой среди пациентов с ХБП, не находящихся на диализе. Из 3905 больных у 588 (15%) была недиализная ХБП, у 128 (3%) – терминальная хроническая почечная недостаточность (ТХПН). В группах недиализной ХБП и ТХПН отмечалась более высокая распространенность сопутствующих заболеваний и более высокий уровень D-димера при поступлении, тогда как у пациентов с ТХПН концентрация С-реактивного белка при поступлении была ниже. Частота госпитализаций в ОРИТ была одинаковой во всех трех группах (23–25%). Общая нескорректированная госпитальная смертность составила 25%, у пациентов без ХБП – 24%, у больных с недиализной ХБП – 34%, при ТХПН – 27%. Среди пациентов в отделении интенсивной терапии смертность достигла 56, 64 и 56% соответственно [24].
В проспективном кагортном исследовании в Испании, о котором мы говорили ранее, в разделе ОПП также были получены данные, касающиеся ХБП, а именно: общий показатель внутрибольничной летальности был выше у пациентов с повышенным уровнем креатинина (32,4%), предшествующей ХБП (41,1%) относительно пациентов с нормальным уровнем креатинина (5,8%) [4].
В исследование Abrishami A. et al. было включено 43 пациента с ХБП в анамнезе и подтвержденным диагнозом COVID-19. По результатам исследования, более чем у половины пациентов с ХБП развилась тяжелая форма COVID-19. Риск развития тяжелого заболевания при этом оказался в два раза выше по сравнению с общей популяцией пациентов. Однако более низкая СКФ и впоследствии более высокая стадия ХБП не были связаны с худшим прогнозом и исходом. Кроме того, уровень смертности был значительно выше (11,6%), чем показатель, зарегистрированный для населения в целом. Сопутствующие заболевания, которые определяют повышенную вероятность смерти, ассоциированной с COVID-19, преобладают у пациентов с ХБП [25].
В многоцентровом ретроспективном исследовании в Турции сравнивались группы пациентов с подтвержденной коронавирусной инфекцией, имеющих в анамнезе ХБП 3–5 стадии, находящихся на гемодиализе, и группа участников без известного заболевания почек в анамнезе (всего 1210 человек). Частота госпитализаций в ОРИТ составила 266/1210 (22,0%), в общей сложности умерло 172/1210 (14,2%) больных. Госпитализация в ОРИТ и госпитальная смертность в группе ХБП (39,4%) оказались достоверно выше, чем в других когортах. Самый высокий показатель смертности был в группе с ХБП, но не у пациентов на гемодализе – 11,1% [26].
В Корее также было выполнено крупное мгоцентровое ретроспективное исследование, целью которого стало выявление связи между ХБП или ОПП и прогнозом пациентов с коронавирусной болезнью COVID-19. В исследование вошел 7341 пациент с подтвержденной коронавирусной инфекцией, которые были разделены на 3 группы: без ХБП в анамнезе (n=7088), имеющие ХБП в анамнезе (n=239), с ХБП и получающие ЗПТ (n=14). Количество пациентов с тяжелым течением COVID-19 составило 1266 (17,9%) в группах без ХБП, 90 (37,7%) в группе недиализной и 11 (78,6%) в группе диализной ХБП соответственно (<0,001). ОПП развилась у 24 (0,3%) и 3 (1,3%) пациентов в группах без ХБП и с недиализной ХБП соответственно. Многофакторный логистический регрессионный анализ продемонстрировал, что пожилой возраст, мужской пол были ассоциированы с развитием ОПП. За время наблюдения умерло 227 (3,1%) больных. Количество смертей во время наблюдения в группах без ХБП, недиализной и диализной ХБП составило 200 (2,8%), 23 (9,6%) и 4 (28,6%) соответственно (<0,001). Статистически было доказано, что ХБП в значительной степени связана со смертностью у пациентов с COVID- 19. Многомерный регрессионный анализ Кокса позволил установить, что в группе диализной ХБП риск смертности был выше, чем в других когортах. В то же время различия в риске смертности между группами без ХБП и с недиализной ХБП не были значительными [27].
Одно из самых свежих исследований в России, проводимое в рамках регистра АКТИВ (Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2), также изучало влияние различных комбинаций сопутствующих заболеваний, существовавших у пациентов исходно, до инфицирования вирусом SARS-CoV-2, на тяжесть течения и исходы новой коронавирусной инфекции. В регистр были включены 5808 пациентов, ХБП наблюдалась у 7,5% из них, но в результате исследования она не вошла в комбинации сопутствующих заболеваний, которые повышали риск развития летального исхода [28].
Также, по данным этого регистра, в рамках исследования постковидного синдрома у 1,5% пациентов с ХБП через 3 мес и у 1,9% через 6 мес была выявлена дестабилизация заболевания. У 0,8% пациентов ХБП была впервые выявлена через 3 мес после перенесенного COVID-19. 21,95% умерших пациентов через 3 мес после выписки из стационара имели в анамнезе ХБП [29].
Исследование с похожими результатами было выполнено и во Франции. Целью его стало трехмесячное наблюдение за пациентами, которые перенесли колоронавирусную инфекцию COVID- 19 тяжелой степени с развитием ОПП. У 20 из 27 пациентов с ОПП (74%) функция почек восстановилась в течение 7 дней, а у 7 (26%) ОПП сохранялось на момент выписки. Восстановление функции почек на 90-й день наблюдалось у 23 из 27 (85%) пациентов. У 4 из 27 пациентов через 3 мес была диагностирована ХБП [30].
Также в крупном обсервационном когортном исследовании в Сеченовском университете, куда было включено 3480 пациентов с подтвержденной коронавирусной инфекцией [31], и в крупном ретроспективном исследовании в США с участием 31461 пациентов [32] были получены данные о том, что ХБП выступает фактором, связанным с госпитальной летальностью [31, 32].
ЗАКЛЮЧЕНИЕ
Проанализировав крупные исследования, мы выявили, что у пациентов с COVID-19 частота развития ОПП варьирует от 5,1 до 36,6%, а показатель смертности от 15,9 до 50%, в разных исследованиях. Это связано в большей степени с возрастом пациентов и количеством сопутствующих заболеваний. Основные факторы риска развития ОПП включают пожилой возраст, АГ, СД, ХБП, ИВЛ, высокие показатели воспалительных маркеров. Морфологическим субстратом почечного повреждения в большинстве случаев выступает острое повреждение канальцевого эпителия. Тромботическая микроангиопатия может быть одной из редких причин поражения почек при COVID-19 [14].
Таким образом, ОПП представляет собой осложнение у госпитализированных пациентов с COVID-19, связанное с повышенной смертностью [11].
ХБП служит независимым фактором риска более тяжелого течения COVID-19 и более высокой смертности при этой инфекции по сравнению с другими сопутствующими заболеваниями [4, 16, 21, 26, 33]. Риск потребности в ИВЛ выше у пациентов с ХБП по сравнению с популяцией без ХБП [23]. Известно, что ХБП является фоном вялотекущего воспаления и проявляется как исходная лимфопения [16, 20].
Повреждение почечных канальцев (приводящее к протеинурии и гематурии) в дополнение к системному воспалению (приводящему к повышению воспалительных маркеров) будет связано с повышенным риском ОПП-Д и смертности [34]. ОПП, возникшая при ХБП, может в значительной степени задержать восстановление функции почек и также увеличить риск смертности [30].
Все вышеперечисленное подтверждает важность наблюдения за ХБП у пациентов с COVID-19 [13].



