В 2002 г. Национальным почечным фондом США была предложена концепция и первая классификация хронической болезни почек (ХБП). Лабораторными маркерами ХБП служат скорость клубочковой фильтрации (СКФ) и альбуминурия/протеинурия, которые также используются для разделения стадий заболевания и в качестве прогностических факторов [1, 2]. В настоящее время нарушения функции почек часто встречаются у больных терапевтического профиля. Следует подчеркнуть, что ХБП является независимым фактором риска развития сердечно-сосудистой патологии и смерти [1, 2]. В свою очередь, вероятность развития нарушений функции почек у пациентов с сердечно-сосудистой патологией значительно выше, чем в общей популяции.
В известном регистре NHANES III (Third National Health and Nutrition Examination Survey) показано, что сочетание любых двух факторов кардиоваскулярного риска приводит к вероятности снижения СКФ в 3,7 раза чаще, чем при сохранной функции почек [3]. Высокая распространенность ХБП продемонстрирована в многочисленных эпидемиологических исследованиях последних лет, проводившихся в различных странах. Так, в работе M. Hasan et al. (2018) сообщается о высокой частоте ХБП в странах Южной Азии. В частности, общая объединенная распространенность ХБП среди взрослого населения Индии составила 10,2%, в Бангладеш – 17,3–26,0%, Пакистане – 21,2–29,9%, в Непале – 10,6% [4]. Стоит отметить, что в этих исследованиях для диагностики ХБП использовались различные методы расчетной СКФ. В проспективном исследовании N.C. Hodel et al. (2018) с участием 952 пациентов амбулаторной клиники Танзании установлено, что предполагаемая распространенность ХБП составляет 13,6% [5]. В этом исследовании СКФ рассчитывалась по уравнению CKD-EPI. Распространенность ХБП в Нигерии, по данным I.I. Chukwuonye и соавт. (2018), варьировалась от 2,5 до 26% [6]. Высокая распространенность сниженной СКФ в общей популяции была установлена и в исследовании A.P. Piccolli и соавт. (2018) [7].
В недавно выполненном эпидемиологическом исследовании показано, что у 1363 пациентов с артериальной гипертензией (АГ) и/или сахарным диабетом (СД) 2 типа маркеры ХБП встречаются с высокой частотой [8]. Ранняя диагностика ХБП приобретает большое значение для своевременного начала нефропротективных стратегий [8]. В этом направлении острый интерес у клиницистов и исследователей вызывает исследование содержания цистатина С сыворотки крови как раннего преклинического маркера ХБП. Наиболее убедительные данные по цистатину С в качестве маркера ХБП и сердечно-сосудистой патологии были получены в ряде исследований, в том числе и в ранее проведенных нами работах [9–11].
Цель настоящего исследования – изучить распространенность сниженной СКФ по данным исследования цистатина С сыворотки крови у больных терапевтического профиля.
МАТЕРИАЛ И МЕТОДЫ
Поперечное эпидемиологическое исследование было основано на анализе результатов оценки содержания цистатина С сыворотки крови у 1121 пациента в возрасте от 16 до 98 лет из группы высокого и очень высокого риска развития ХБП в период с 2017 по 2018 г. Средний возраст обследованных составил 51,5±15,2 года, количество мужчин – 515 (46,0%), женщин – 606 (54,0%). Средние значения возраста как у мужчин, так и женщин были равнозначными (51,1±15,7 и 51,8±14,9 года соответственно).
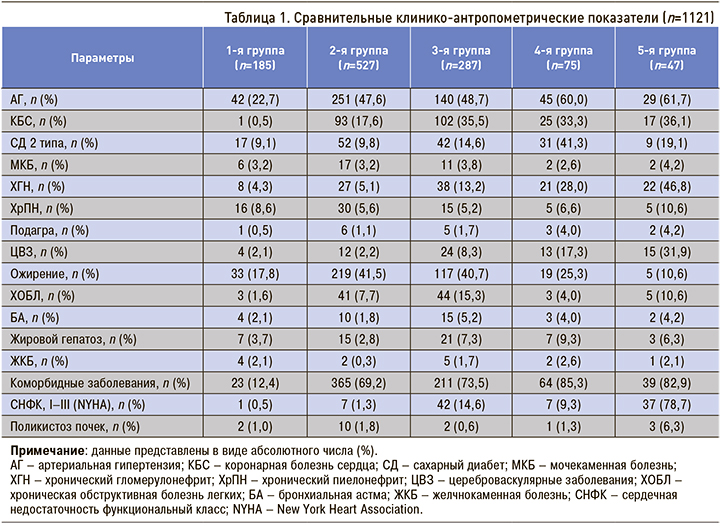
Эта работа является продолжением серии предыдущих исследований [11, 12]. Нозологическая характеристика обследованных больных показана в таблице 1.
Всем больным было выполнено общеклиническое обследование: измерение роста (см), массы тела (кг), определение индекса массы тела (ИМТ, кг/м2), артериального давления (АД, мм рт.ст.) и частоты сердечных сокращений (ЧСС, уд./мин).
У всех больных исследовали содержание цистатина С (мг/л) сыворотки крови иммунотурбидиметрическим методом, усиленным латексными частицами. СКФ (мл/мин) рассчитывали по методике F.J. Hoek et al., предложенной в 2003 г. (80,35/цистатин С-4,32=СКФ) [13].
В исследование не включались лица, страдающие ХБП 5Д-стадии, пациенты с почечным трансплантатом, а также больные, получающие кортикостероидные и иммуносупрессивные препараты. Кроме того, критериями исключения из исследования были тяжелый тиреотоксикоз, лихорадка, паранеопластический процесс и беременность.
Нозологические диагнозы (артериальная гипертензия (АГ), СД 2 типа, коронарная болезнь сердца (КБС), хроническая обструктивная болезнь легких (ХОБЛ), хроническая сердечная недостаточность (ХСН), ожирение, мочекаменная болезнь (МКБ), бронхиальная астма (БА), подагра, цереброваскулярные заболевания (ЦВЗ), жировой гепатоз, желчнокаменная болезнь (ЖКБ), поликистоз почек, хронический гломерулонефрит (ХГН) и хронический пиелонефрит (ХПиН)) подтверждались представленной медицинской документацией.
Статистическая обработка полученных данных производилась с использованием пакета статистических программ Statistica 10.0. Нормальность распределения оценивали визуально и с помощью теста Шапиро–Уилка. Среднегрупповые значения представлены в виде M±SD, где M – среднее арифметическое значение показателя по группе, SD – стандартное отклонение. Различия между группами оценены с помощью t-критерия Стьюдента. Корреляционный анализ проводился по критерию Пирсона. Различия считались статистически значимыми при значениях р <0,05.
РЕЗУЛЬТАТЫ
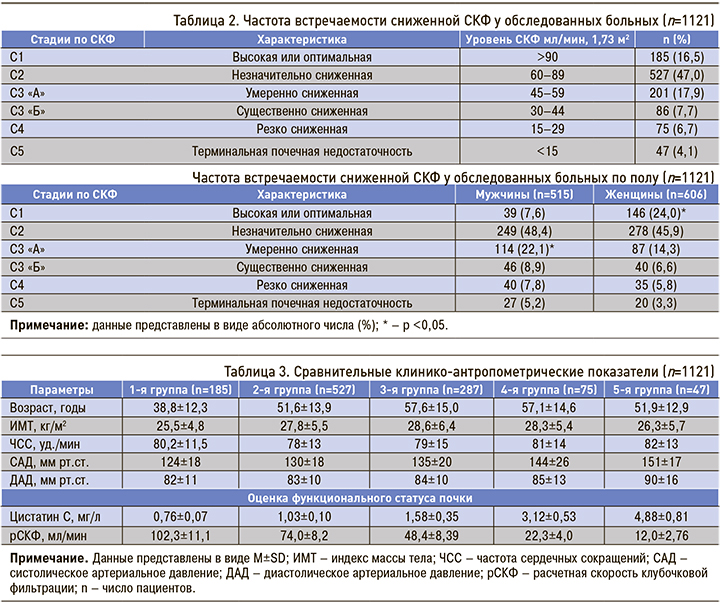
При анализе распространенности сниженной СКФ в нашем исследовании мы руководствовались рекомендациями KDIGO (Kidney Disease: Improving Global Outcomes). Так, в обследуемой выборке доля пациентов с высокой (оптимальной) СКФ составила 16,5% (см. табл. 1), а с незначительным сниженной СКФ – 47,0%. Умеренное снижение СКФ (С3 «А») регистрировалось у 17,9%, существенное (С3«Б») и резко сниженное (С4) – 7,7 и 6,7% соответственно. Более существенное снижение СКФ (С5), т.е. терминальная почечная недостаточность, наблюдалась у 4,1% пациентов.
В изученной выборке больных отмечались некоторые межполовые различия по частоте встречаемости сниженной СКФ (см. табл. 1). Так, лица с высокими значениями СКФ достоверно преобладали среди женщин по сравнению с мужчинами (24,0 против 7,6%; р <0,05). Напротив, высокая распространенность умеренно сниженной функции почек (С3 «А») наблюдалась у мужчин (р <0,05). Межполовых различий по частоте встречаемости С2, С3 «Б», С4 и С5 стадий СКФ получено не было (p >0,05).
На следующем этапе были проанализированы клинико-лабораторные параметры обследованных больных в зависимости от тяжести почечной дисфункции (табл. 3). В 1-й группе больных (С1) среднее значение возраста было достоверно ниже (p >0,05), а показатели ИМТ и ЧСС существенно не различались по сравнению с группами со сниженной СКФ. Как и следовало ожидать, отмечалось нарастание средних показателей систолического и диастолического АД в направлении от 1-й к 5-й группе, что сопровождалось повышением содержания цистатина С сыворотки крови и достоверным снижением расчетной СКФ (табл. 3).
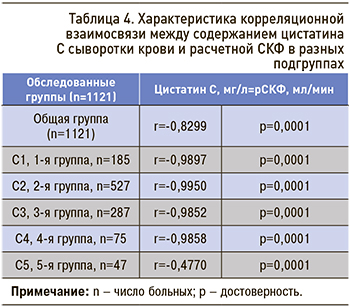 В соответствии с целями нашего исследования был проведен корреляционный анализ между содержанием цистатина С сыворотки крови и СКФ в каждой подгруппе отдельно (табл. 4). Так, статистически высокозначимая тесная (отрицательная) корреляционная взаимосвязь отмечалась в 1–4-й группах. Однако сила корреляционной взаимосвязи стала средней в 5-й группе больных.
В соответствии с целями нашего исследования был проведен корреляционный анализ между содержанием цистатина С сыворотки крови и СКФ в каждой подгруппе отдельно (табл. 4). Так, статистически высокозначимая тесная (отрицательная) корреляционная взаимосвязь отмечалась в 1–4-й группах. Однако сила корреляционной взаимосвязи стала средней в 5-й группе больных.
В таблице 4 приведены основные нозологические формы заболевания; во всех подгруппах исследования преобладали больные АГ, ожирением и коморбидными заболеваниями. Кроме того, число больных АГ, КБС и коморбидными заболеваниями было больше в 3–5-й группах. В 5-й группе в основном встречались лица с ХСН, ХГН и коморбидными заболеваниями.
ОБСУЖДЕНИЕ
Заболеваемость и распространенность ХБП возрастают во всем мире. Подсчитано, что ежегодно от нее умирают около 5–10 млн человек [14]. К тому же повсеместно отмечается увеличение числа больных, страдающих АГ, СД 2 типа и ожирением. Это диктует необходимость раннего выявления ХБП и уменьшения кардиоваскулярного риска.
Исследованиями установлено, что цистатин C является белком из семейства ингибиторов цистеиновых протеаз, который в организме человека постоянно продуцируется всеми клетками, содержащими ядра [15]. Он свободно фильтруется почками через клубочковую мембрану благодаря малой молекулярной массе, и его уровень относительно стабилен в системной циркуляции. Эти свойства позволяют рассматривать цистатин С как показатель, отражающий выделительную функцию почек [16]. В проведенном нами исследовании частота незначительно сниженной СКФ была отмечена у 47,0% обследованных больных (см. табл. 2). Цистатин С в сыворотке тесно коррелирует с величиной СКФ, являясь чувствительным маркером нарушения СКФ, особенно при отсутствии увеличения уровня креатинина сыворотки крови [17]. В проведенном нами исследовании было установлено, что у больных 1–4-й групп (см. табл. 4) связь между цистатином С и величиной СКФ оказалась более сильной.
Этот факт полностью согласуется с результатами других исследований, в которых повышение уровня цистатина С регистрировалось уже на ранних стадиях ХБП (С1 по С3) [18]. Так, функция почек может оказаться сниженной более чем на 50% к тому моменту, когда уровень креатинина только превысит верхнюю границу нормы. Поэтому повышение уровня цистатина С, в отличие от креатинина, является информативным уже на ранних стадиях нарушения выделительной функции почек, и чем тяжелее процесс, тем выше его концентрация в крови. Уровень креатинина не является надежным индикатором функции почек и, в отличие от цистатина С, подвержен влиянию таких факторов, как возраст, пол, мышечная масса, особенности питания, физическая активность и др. [17, 18]. Эти данные вновь приковывают внимание исследователей к проблеме диагностики ХБП с использованием различных уравнений [19, 2023]. По данным отдельных работ, тяжесть ХБП также связана с высоким числом сопутствующих заболеваний [24], что подтверждается и в нашем исследовании (см. табл. 1).
ЗАКЛЮЧЕНИЕ
Проведенный нами анализ показал, что распространенность незначительного и умеренного снижения СКФ у больных терапевтического профиля составляет 47,0 и 17,9% соответственно. Увеличение содержание цистатина С сыворотки крови высоко коррелирует со СКФ, особенно на ранних стадиях почечной дисфункции, и служит маркером не только ХБП, но и коморбидных заболеваний. Учитывая полученные нами данные у больных терапевтического профиля с высоким и очень высоким риском развития нарушения почечной функции, оправданно исследование содержания цистатина С сыворотки крови на ранней стадии заболевания в целях предупреждения прогрессирования ХБП и развития сердечно-сосудистой патологии в будущем.



