ВВЕДЕНИЕ
Идентификация нового значимого уровня регуляции активности генов с помощью малых некодирующих молекул РНК – микроРНК (miRNA) – можно определенно считать одним из наиболее выдающихся открытий современной науки. Это обусловлено тем, что подавление экспрессии генов под влиянием miRNA служит исключительно важным универсальным механизмом, широко вовлеченным в большинство внутриклеточных сигнальных путей [1].
Фундаментальные и клинические исследования четко продемонстрировали значение miRNA в регуляции дифференцировки, роста, пролиферации и апоптоза клеток [1–4]. Это влияние miRNA распространяется и на кардиоваскулярную систему. Экспериментальные исследования показали участие miRNA не только в нормальном развитии сердца и сосудов, но и в формировании таких патологических состояний, как гипертрофия миокарда и его ремоделирование, недостаточность кровообращения [4–6]. MiRNA вовлечены в мобилизацию клеток-предшественников и других вспомогательных клеток из костного мозга в периферическое кровообращение, что является важным звеном в восстановлении функции сердца после ишемического повреждения [4].
Значимые изменения уровня экспрессии miRNA при многих болезнях позволили рассматривать их в качестве перспективных биомаркеров. Для них характерны три ключевых критерия так называемого идеального маркера: 1) достаточно высокая стабильность в биологических жидкостях; 2) устойчивость к влияниям извне, что позволяет эффективно выделять циркулирующие miRNAs из биологических жидкостей; 3) сопоставимость профилей miRNAs в норме у мужчин и женщин, а также у людей разных возрастных категорий. В то же время основной недостаток miRNAs как биологического маркера – высокая вариабельность уровня их экспрессии, зависящая от многих факторов [7].
К наиболее часто используемым методам выделения miRNA относятся полимеразная цепная реакция в реальном времени и флуоресцентная гибридизация in situ.
В настоящее время miRNAs используются в качестве диагностических биомаркеров при многих сердечно-сосудистых заболеваниях (ССЗ) [2, 4, 5, 8, 9]. В представленном обзоре проанализированы основные исследования, которые указывают на потенциальную роль miRNA-1 и miRNA-133 в развитии ССЗ.
МЕТОДОЛОГИЯ ПОИСКА ИСТОЧНИКОВ
Анализ источников литературы проводился в базах данных PubMed, РИНЦ, MedLine, Google Scholar, Science Direct, рассматривались зарубежные и отечественные статьи. Поиск проводился по следующим ключевым словам: «микроРНК-1», «микроРНК-133», «сердце», «сердечно-сосудистые заболевания», miRNA-1, miRNA-133, heart, cardiovascular diseases.
СТРОЕНИЕ И ФУНКЦИИ микроРНК-1 И микроРНК-133
MiRNA представляет собой разновидность эндогенной, короткой (18–24 нуклеотидов), высококонсервативной некодирующей РНК [4]. MiRNAs впервые были открыты у Caenorhabditis elegans и подробно описаны Lee R. et al. [10]. Это стабильная молекула с периодом полужизни почти 24 ч [11]. MiRNA первичного предшественника транскрибируются из гена Pol II (полимераза II) и впоследствии расщепляются на miRNA-предшественники через комплекс Drosha (фермент класса 2 рибонуклеаза III)/DGCR8 (РНК-связывающий белок). Затем miRNA-предшественники переносятся в цитоплазму через exportin-5/Ran-GTP (белки внутриядерного транспорта), в котором они дополнительно расщепляются при участии Dicer (фермента с каталитическим центром РНКазы III)/TRBP (белка, связывающего трансактивирующую РНК) и далее раскручиваются в их зрелую форму [12]. В настоящее время в человеческом организме обнаружено более 2000 miRNAs, которые, по-видимому, контролируют около 60% генов [13]. Для каждой отдельной miRNAs существует множество мишеней, при этом многие гены обладают сайтами распознавания различных miRNAs [13].
MiRNAs через различные пути регулируют развитие сердца в эмбриональном периоде, его ремоделирование и регенерацию, эндотелиальную функцию, васкулогенез и неоангиогенез [4]. Zhao Y. et al. выявили, что удаление фермента Dicer из кардиомиоцитов и эпикарда мышей приводило к летальным дефектам сердечно-сосудистой системы [14]. Экспрессия miRNA-133 и miRNA-1 влияет на способность миобластов образовывать миотубы [15]. MiRNA-1 участвует в миогенезе путем нацеливания на гистондеацетилазу 4 (HDAC4); в свою очередь, miRNA-133 усиливает пролиферацию миобластов за счет подавления сывороточного фактора ответа (SRF) [16]. В эмбриональных стволовых клетках miRNA-1 и miRNA-133 синергетически индуцируют образование мезодермы и их дефицит приводит к различным порокам сердца [17]. Valkov N. et al., Zhang X. et al. наблюдали высокую экспрессию miRNA-1 и miRNA-133 в сердце при повреждении [18, 19]. Согласно результатам исследования Werner J. et al., miRNA-133 и активатор транскрипции GATA4 ингибируют путь Snai1, поэтому предполагается, что они играют синергетическую роль в «перепрограммировании» сердца [20]. Cheng M. et al. обнаружили, что комбинированная инъекция miRNA-133, miRNA-1, miRNA-499 и miRNA-208 в ишеминизированную ткань миокарда индуцирует фибробласты к трансформации в подобные кардиомиоцитам клетки, которые затем улучшают сердечную функцию [21]. Наряду с этим, MiRNA-1 индуцирует дифференцировку эмбриональных стволовых клеток в сердечные клетки, однако необходимо дополнительно исследовать, участвует ли она в «перепрограммировании» сердца посредством ингибирования сигнального пути Snai1 [17].
Как известно, комбинация некоторых факторов транскрипции (таких как MEF2C, TBX5 и GATA4, MEF2C, TBX5, Hand2 и GATA4) способствует трансдифференциации фибробластов в функциональные кардиомиоцитоподобные клетки [22]. Nam Y. et al. установили, что добавление miRNA- 133 и miRNA- 1 к Hand2, MYOCD, TBX5 и GATA4 еще больше увеличивает скорость трансформации фибробластов [23]. Christoforou N. et al. продемонстрировали, что уровни РНК гиперэкспрессированных факторов транскрипции TBX5, MEF2C и GATA4 значительно снижались под действием miRNA-133 и miRNA-1 [24]. Предполагается, что это противоречие может быть связано с конечной концентрацией miRNA- 133 и miRNA-1. Согласно данным Muraoka N. et al., miRNA-133 индуцирует превращение фибробластов в функциональные кардиомиоциты путем ингибирования Snai1 [22]. Путь miRNA-133/Snai1 является основным путем участия miRNA-133 в «перепрограммировании» сердца [22].
РОЛЬ MIR-1 И MIR-133 ПРИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Как было показано Islas J.F. et al., уровни miRNA-1, miRNA-133, miRNA-499 и miRNA-208 в ишемизированном миокарде повышены [12], но механизмы этого явления до конца не изучены. При ишемии миокарда активируется один из наиболее важных транскрипционных факторов – белок CREB (связывающий элемент ответа циклического аденозинмонофосфата), что приводит к транскрипции miRNA-1 и других miRNAs [4, 13].
При повреждении сердца miRNA-1, miRNA-133, miRNA-499 и miRNA-208 быстро высвобождаются в периферическую кровь. MiRNA-499, miRNA-208 и miRNA-1 в основном, а miRNA-133 частично переносятся циркулирующими экзосомами [4, 21]. Экзосомные miRNAs избирательно и предпочтительно переносятся в моноциты костного мозга. MiRNA-1, miRNA-499 и miRNA-208 ингибируют экспрессию рецептора хемокинов CXCR4 и опосредуют мобилизацию клеток-предшественников. Как уже было отмечено ранее, мобилизация клеток-предшественников и других вспомогательных клеток в костном мозге в периферическое кровообращение выступает ключевым элементом в восстановлении сердечной функции после ишемического повреждения сердца [4, 21]. MiRNA- 133 также оказывает сильнейшее ингибирующее действие на экспрессию CXCR4 [4, 21].
Pinchi E. et al. изучали экспрессию miRNAs в образцах тканей сердца лиц, умерших от острого инфаркта миокарда (ОИМ) или внезапной сердечной смерти (группой контроля служили лица, скончавшиеся не от ССЗ). Результаты исследования продемонстрировали подавление всех miRNAs в группе ОИМ по сравнению с группой внезапной сердечной смерти и контролем. Выбранные miRNAs показали высокую точность в различении внезапной сердечной смерти от ОИМ (miRNA-1 и miRNA-499) и ОИМ от контроля (miRNA-208) [25].
Ewelina K. et al. выполнили исследование по оценке уровней miRNA-1 и miRNA-126 при ОИМ. Концентрация обеих miRNAs оказалась достоверно и значительно выше у пациентов с ОИМ по сравнению со здоровыми людьми. Кроме того, miRNA-1 положительно коррелировала с максимальной концентрацией тропонина I (p=0,02) [26].
Исследование Ma Q. et al. было направлено на оценку уровней miRNA-1 и miRNA-6 у больных инфарктом миокарда с подъемом сегмента ST (ИМпST), подвергшихся чрескожному коронарному вмешательству (ЧКВ). Согласно полученным данным, уровень miRNA-1 при поступлении пациента в стационар является независимым предиктором ремоделирования левого желудочка через 6 мес после ИМпST [27].
Цель исследования Coelho-Lima J. et al. состояла в том, чтобы изучить кинетику различных miRNAs после ЧКВ и их связь с обструкцией микрососудов у пациентов с ИМпST. В соответствии с полученными результатами уровни miRNA-1 и miRNA-133b через 90 мин после проведения ЧКВ были соответственно примерно в 3 (p=0,001) и 4,4 раза (p=0,008) выше у пациентов с обструкцией микрососудов по сравнению с пациентами без их обструкции [28].
Исследование Е.А. Поляковой с соавт. было посвящено изучению роли miRNA-27а, miRNA- 133а и miRNA-203 в патогенезе атеросклероза сосудов сердца. Согласно полученным результатам, экспрессия всех анализируемых miRNAs у больных с атеросклерозом коронарных артерий была значительно больше, чем у здоровых людей (группы контроля), как в кардиомиоцитах, так и сыворотке крови. Кроме того, экспрессия данных miRNAs в крови и кардиомиоцитах левого предсердия больных с поражением трех и более коронарных артерий была достоверно и значимо выше, чем у больных с поражением одного–двух сосудов [29].
Kaur A. et al. продемонстрировали, что miRNA- 21, miRNA-133 и miRNA-499, по-видимому, обладают наибольшим потенциалом в качестве биомаркеров для дифференциации острого коронарного синдрома (ОКС) от стабильной ишемической болезни сердца (ИБС) [30].
Исследование Danaii S. et al. было нацелено на изучение miRNAs у пациентов с феноменом замедления коронарного кровотока (Coronary Slow Flow Phenomenon – CSFP). Уровни экспрессии miRNA- 1, miRNA-133, miRNA-208a, miRNA- 206, miRNA-17, miRNA-29, miRNA-223, miRNA- 326 и miRNA-155 значительно увеличивались у пациентов с CSFP, при этом уровни экспрессии miRNA- 15а, miRNA-21, miRNA-25, miRNA-126, miRNA-17, miRNA-16 и miRNA-18а значительно снизились у пациентов с CSFP по сравнению с контрольной группой здоровых людей. Это исследование продемонстрировало потенциальную роль miRNAs в качестве биологических маркеров для диагностики CSFP [31].
Trotta M. et al. исследовали влияние антагониста рецепторов ангиотензина II телмисартана на ишемию/реперфузию в аспекте локальной модуляции miRNA-1. Указанный препарат уменьшал повреждение миокарда за счет модуляции miRNA- 1 и последующих модификаций коннексина-43 (Cx43), калиевых каналов KCNB1 и регулятора апоптоза Bcl-2 [32].
MIR-1 И MIR-133 ПРИ ГИПЕРТРОФИИ СЕРДЦА
Согласно данным Care A. et al., сверхэкспрессия miRNA-133 или miRNA-1 in vitro уменьшала гипертрофию сердца. Напротив, подавление miR-133 значимо индуцировало гипертрофию. В свою очередь, ингибирование miRNA-133 in vivo вызывало выраженную и устойчивую гипертрофию сердца. Исследователи идентифицировали специфические мишени miRNA-133: трансформирующий белок RhoA, гуанозиндифосфат, гуанозинтрифосфат, гомолог контроля клеточного деления 42 (Cdc42) и фактор элонгации Nelf-A [33].
MiRNA-133 ингибирует гипертрофию миокарда, непосредственно подавляя экспрессию сывороточного реактивного фактора (SRF — Serum Response Factor) [16].
По данным Ikeda et al., кальций-связывающий белок кальмодулин регулирует гипертрофию кардиомиоцитов через фактор энхансера миоцитов (MEF2a) и фосфатазный кальциневрин-ядерный фактор активированных Т-клеток (NFAT). MiRNA-1, угнетая эти факторы, уменьшает гипертрофию кардиомиоцитов [34].
Fathi M. et al. наблюдали достоверное увеличение экспрессии miRNA-1 (p=0,001), miRNA-133 (p=0,004) и экспрессии генов Srf, Hdac4 и Hand2 (все p <0,001) при физиологической гипертрофии миокарда, вызванной интенсивными физическими нагрузками [35].
В работе Koval S. et al. предметом изучения был уровень miRNA-133а в крови больных эссенциальной артериальной гипертензией (АГ). Было установлено, что у таких пациентов содержание этого биомаркера в крови было достоверно ниже, чем у практически здоровых лиц (р <0,05). Также выявлено достоверное снижение уровня miR-133a в крови у больных с гипертрофией левого желудочка (ЛЖ) по сравнению с больными без этого состояния (р <0,05), а также достоверное снижение по сравнению со здоровыми лицами контрольной группы (р <0,05) [36].
В соответствии с данными Connolly M. et al. miRNA-1 нацеливается на рецептор трансформирующего ростового фактора бета (TGF-βR1) и снижает передачу сигналов TGF-β; снижение экспрессии miRNA-1 может усиливать передачу сигналов TGF-β и способствовать гипертрофии сердца [37].
Работа А.Г. Ибрагимовой с соавт. была посвящена анализу спектра разных miRNAs при гипертрофии миокарда у больных с обструктивной формой гипертрофической кардиомиопатии (ГКМП). У пациентов этой группы в сердечной мышце наблюдалась повышенная экспрессия антигипертрофических miRNAs (miRNA-1, miRNA-133a, miRNA- 133b) по сравнению с уровнем экспрессии данных miRNAs в нормальном миокарде [38].
ЗНАЧЕНИЕ MIR-1 И MIR-133 ПРИ АРИТМИЯХ
Аномальная экспрессия miRNA-133 ингибирует калиевые каналы KCNH2 и KCNQ1 в кардиомиоцитах, что приводит к замедлению реполяризации сердца, удлинению интервала QT и возникновению аритмий [39]. MiRNA-1 подавляет калиевый канал KCNJ2 и белок альфа-1 щелевого соединения (GJA1). Это приводит к аритмиям вследствие влияния на ток калия во время реполяризации [40].
Как известно, эпоксиэйкозатриеновые кислоты (EETs) являются эндогенными биоактивными липидными медиаторами, образующимися из арахидоновой кислоты с помощью подмножества ферментов цитохрома P450 (CYP450) [4]. EETs могут метаболизироваться в дигидроксиэйкозатриеновые кислоты при помощи растворимой эпоксидгидролазы (sEH). Растворимый ингибитор эпоксидгидролазы (sEHi) повышает концентрацию EETs за счет подавления их деградации [4]. Согласно данным Gui Y. et al., Liu Q. et al., EETs играют антиаритмическую роль, снижая регуляцию аномально повышенных miRNA-1 и miRNA- 133 в миокарде после ОИМ [39, 41], но конкретный механизм этого все еще остается неясным [4]. Возможные механизмы влияния miRNA-1 и miRNA-133 на возникновение нарушений ритма сердца представлены на рисунке.
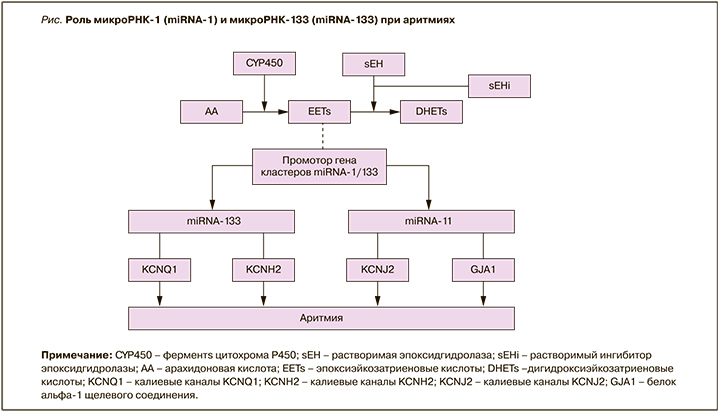
В работе Sun L. et al. был проведен анализ miRNAs в крови детей с желудочковой тахикардией. У исследованных больных с этой формой аритмии уровни miRNA-133 оказались значительно повышены по сравнению с контрольной группой здоровых детей (p=0,024). При этом не было отмечено достоверных различий в уровнях miRNA-1 между больными и здоровыми детьми [42].
ЗАКЛЮЧЕНИЕ
В современном мире имеются высокие технологии для идентификации новых биологических маркеров, вследствие чего целесообразно создание мультибиомаркерной модели диагностики и прогнозирования течения кардиоваскулярной патологии. Конечно же, для этого потребуется совершенствование биоинформационных технологий, необходимых для анализа большой базы данных. Представленный литературный обзор указывает на потенциально важную диагностическую и прогностическую значимость оценки miRNA-1 и miRNA-133. Ожидается, что дальнейшие научно-клинические исследования продемонстрируют возможности их использования в качестве дополнительных лабораторных инструментов диагностики и оценки прогноза у пациентов кардиологического профиля. Регуляция концентрации данных miRNA в крови и их экспрессии в клетках сердца с помощью медикаментозных препаратов, возможно, окажется многообещающей мишенью для лечения патологии сердца и сосудов.



