ВВЕДЕНИЕ
На данный момент с учетом всех выявленных случаев COVID-19 в мире и данных множественных исследований среди заболевших не наблюдается значимых гендерных различий, при этом наиболее тяжелые формы инфекции регистрируются у пациентов старше 60 лет, а наименьшая восприимчивость к ней у детей. Ведение пациентов с COVID-19 подразумевает не только терапию пневмонии и дыхательной недостаточности, но и своевременное распознавание и лечение поражения других органов-мишеней.
Во время подготовки к неизбежному воздействию пандемии COVID-19 в первую очередь необходимо минимизировать риск смертельного заболевания среди наиболее уязвимых групп населения, к которым, в частности, относятся пациенты с хроническими заболеваниями. Наиболее часто тяжелые формы COVID-19 наблюдаются у пациентов с гипертонической болезнью, ожирением, сахарным диабетом, ишемической болезнью сердца, хроническими заболеваниями почек, злокачественными новообразованиями [1–4].
Цель исследования – изучить частоту и структуру коморбидной патологии у пациентов с крайне тяжелым течением COVID-19, а также выявить наиболее значимые факторы, определяющие неблагоприятный исход лечения у коморбидных больных с инфекцией, вызванной вирусом SARS-CoV-2.
МАТЕРИАЛ И МЕТОДЫ
Выборку исследования (n=96) составили пациенты, проходившие лечение в Клиническом медицинском центре COVID-19 МГМСУ им. А.И. Евдокимова с 1 по 30 июня 2021 г. с диагнозом «коронавирусная инфекция COVID-19, вызванная вирусом SARS-CoV-2, вирус идентифицирован, крайне тяжелое течение. Двусторонняя полисегментарная вирусная пневмония» (код U07.1 по МКБ-10). Диагноз ставился на основании обнаружения SARS-CoV-2 в мазках из носо- и ротоглотки методом полимеразной цепной реакции (ПЦР) и/или данных компьютерной томографии легких (КТ), где описывались характерные интерстициальные изменения по типу «матового стекла» разной степени интенсивности.
В ходе исследования анализировались данные анамнеза (сроки заболевания до госпитализации, наличие факта вакцинации), демографические показатели (возраст, пол), данные объективного обследования, результаты клинического анализа крови, уровня С-реактивного белка (СРБ), интерлейкина 6 (ИЛ-6), коагулограммы (протромбиновое время, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), фибриноген, D-димер), результаты КТ легких при поступлении и в динамике, режимы проводимой противовоспалительной и антикоагулянтной терапии, режимы кислородной поддержки, выявленные в ходе госпитализации осложнения, а также сроки перевода в отделение реанимации и интенсивной терапии (ОРИТ) и исход лечения. Все пациенты получали стандартное лечение согласно документу Минздрава России «Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)», версия 11 (07.05.2021) [5].
Критерием включения в исследование служил факт поступления пациента в ОРИТ в ходе госпитализации, что подтверждало тяжелое / крайне тяжелое течение коронавирусной инфекции. Пациенты, вошедшие в выборку, были в возрасте от 21 до 92 лет (Mвозраст=65,26; SD=15,25), на 40,6% она состояла из мужчин.
Общая выборка была разделена на две подвыборки:
- первая – пациенты без коморбидности (n=22) в возрасте от 21 до 69 лет (Mвозраст=49,23; SD=14,713), 59,1% мужчин;
- вторая – коморбидные пациенты (n=74) в возрасте 29–92 лет (Mвозраст=70,03; SD=11,827), 35,1% мужчин.
Наличие в медицинской документации указаний хотя бы на одно сопутствующее состояние трактовалось как коморбидность. Для количественной оценки выраженности коморбидности использовали широко применяющийся индекс Charlson (Чарлсон), разработанный доктором Mary Charlson. На основе оценки в баллах основных коморбидных состояний, а также возраста индекс позволяет рассчитать прогноз риска смерти в ближайшие 10 лет.
Результаты были обработаны с применением пакетов программ IBM SPSS Statistics 26 (rus) и Microsoft Excel 2016.
Описательные статистики
Пациенты, которым в дальнейшем был установлен диагноз «COVID-19, вирус идентифицирован», первично поступали в различные отделения ковидного госпиталя. Сразу в ОРИТ были доставлены 16 человек, тогда как остальные больные (n=80) госпитализировались из приемного отделения в терапевтические отделения, а далее в связи с ухудшением состояния по различным причинам были переведены в ОРИТ. В группе (подвыборке) пациентов с коморбидностью (n=74) 63 пациента скончались, 11 были выписаны с улучшением, тогда как в группе пациентов без коморбидных заболеваний (n=22) было зафиксировано 13 летальных исходов. Ни у одного из включенных в исследование пациентов не было факта вакцинации против коронавирусной инфекции в анамнезе.
Частотное распределение пациентов с разным статусом по коморбидности показало, что у больных с сопутствующими заболеваниями наблюдалась более высокая смертность, их чаще переводили на неинвазивную (НИВЛ) и инвазивную вентиляцию легких (ИВЛ) по сравнению с пациентами без коморбидности. Также пациентов без коморбидности в среднем позже, чем коморбидных больных, переводили на НИВЛ и ИВЛ. В обеих группах наиболее частым смертельным осложнением COVID-19 было развитие острого респираторного дистресс-синдрома (ОРДС): 68,2% случаев в группе пациентов без коморбидности, 86,5% – в группе с коморбидностью (табл. 1).

РЕЗУЛЬТАТЫ
Распределение на общей выборке носит смешанный характер (критерий Колмогорова–Смирнова), вследствие чего использовались непараметрические методы статистического вывода как не зависящие от распределения.
В обеих группах количество дней до госпитализации, факт введения иммунобиологической терапии, прогрессия по КТ и развитие бактериальных осложнений не были связаны с исходом госпитализации.
Пациенты без коморбидности (n=22)
В группе пациентов без коморбидности связи между количеством осложнений и исходом госпитализации обнаружено не было.
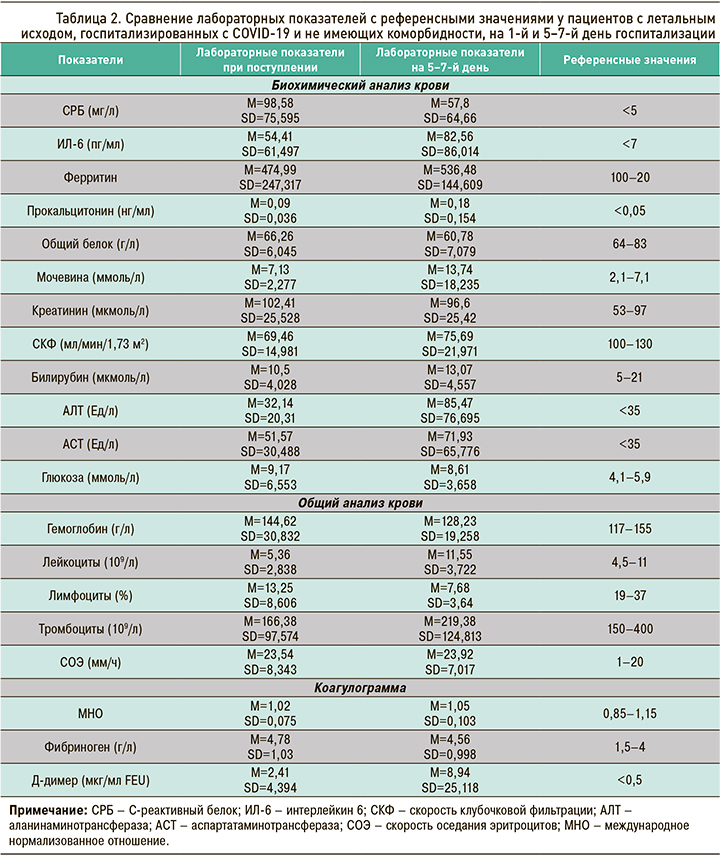
Лабораторные показатели, приведенные ниже, были выбраны как наиболее точно отражающие динамику воспаления и характер осложнений, которые возникают в ходе госпитализации у пациентов с COVID-19. При сравнении средних величин лабораторных показателей с референсными значениями на первый и 5–7-й день госпитализации у пациентов без коморбидности и с летальным исходом было выявлено следующее (табл. 2):
- показатели СРБ, ИЛ-6, ферритин, аспартатаминотрансферазы (АСТ), глюкоза, Д-димер значительно превышали верхнюю норму референсных значений на обоих срезах;
- показатель аланинаминотрансферазы (АЛТ) значительно превышал верхнюю норму референсных значений на 5–7-й день госпитализации;
- уровень лимфоцитов был значительно ниже нормы референсных значений на обоих срезах;
- скорость клубочковой фильтрации (СКФ), билирубин, гемоглобин, тромбоциты и МНО находились в пределах нормы на обоих срезах;
- общий белок, АЛТ и лейкоциты находились в пределах нормы на первом дне госпитализации, как и показатель креатинина на 5–7-й день госпитализации.
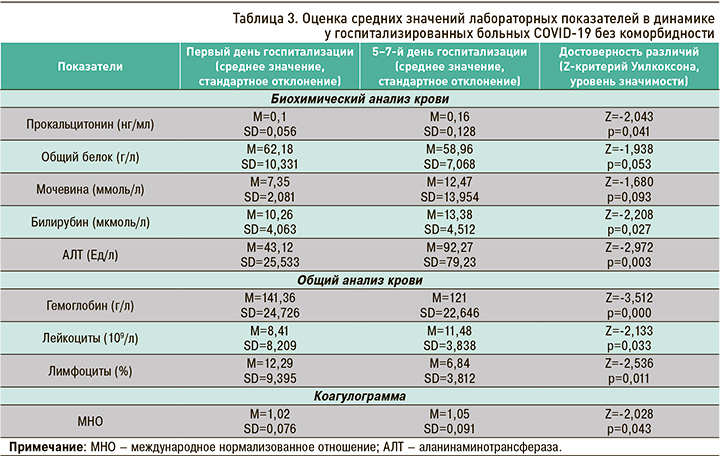
При применении Z-критерия Уилкоксона у пациентов без коморбидности на разных днях госпитализации были выявлены значимые различия в уровне таких лабораторных показателей, как прокальцитонин, билирубин, АЛТ, гемоглобин, лейкоциты, лимфоциты и МНО (р <0,05), а также различия на уровне тенденций в уровне показателей общего белка (Z=-1,938; p=0,053) и мочевины (Z=-1,680; p=0,093). Анализ средних значений позволяет сказать, что уровни прокальцитонина, мочевины, билирубина, АЛТ, лейкоцитов и МНО повысились, а показатели общего белка, гемоглобина и лимфоцитов понизились к 5–7-му дню госпитализации по сравнению с первым днем (табл. 3). В отношении СРБ, ИЛ-6, ферритина, креатинина, СКФ, АСТ, глюкозы, тромбоцитов, СОЭ, фибриногена и Д-димера значимых различий в динамике обнаружено не было.
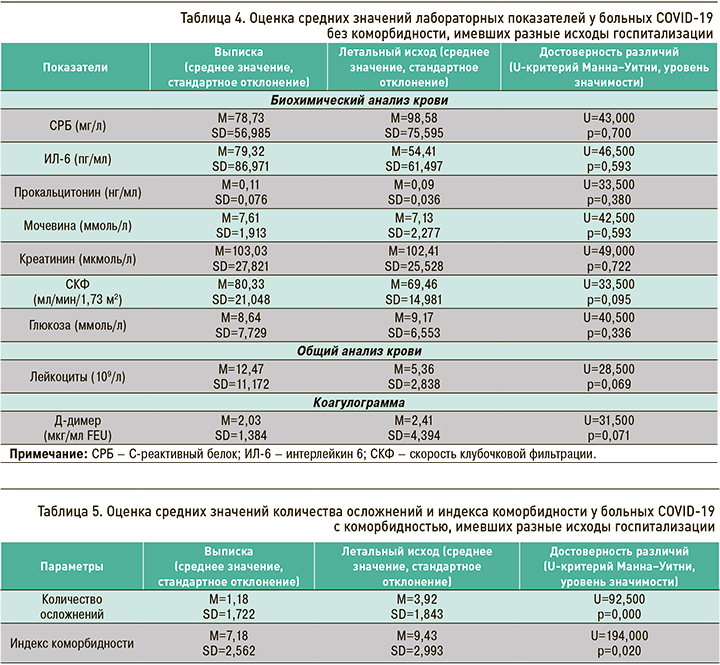
При использовании U-критерия Манна–Уитни у пациентов без коморбидности, имевших разные исходы госпитализации, были выявлены различия на уровне тенденций в уровне показателей СКФ (U=33,500; p=0,095), лейкоцитов (U=28,500; p=0,069) и Д-димера (U=31,500; p=0,071). Анализ средних значений позволяет сказать, что у выписанных пациентов показатели СКФ и лейкоцитов были выше, а Д-димера ниже относительно пациентов с летальным исходом (табл. 4). Для уровней СРБ, ИЛ-6, прокальцитонина, мочевины, креатинина и глюкозы значимых различий выявлено не было.
Пациенты с коморбидностью (n=74)
В результате корреляционного анализа связей (Ro-Спирмена) на выборке пациентов с коморбидностью (n=74) нами была установлена ожидаемая корреляция между возрастом и величиной индекса коморбидности (что подтверждалось ранее проведенными исследованиями): с увеличением возраста индекс коморбидности также увеличивался (Ro=0,564; p <0,01).
При применении U-критерия Манна–Уитни были выявлены значимые различия в количестве осложнений и индексе коморбидности у коморбидных пациентов с разными исходами госпитализации (р <0,05). Анализ средних значений позволяет заключить, что количество осложнений было больше, а индекс коморбидности выше у пациентов с летальным исходом, по сравнению с теми пациентами, чья госпитализация закончилась выпиской (табл. 5).
При детальной оценке структуры коморбидной патологии наиболее часто у пациентов фиксировались гипертоническая болезнь (n=62; 98,4%), ожирение (n=32; 50,8%), сахарный диабет 2-го типа (n=26; 41,3%), хроническая болезнь почек (n=25; 39,7%). Реже всего среди коморбидной патологии встречались цирроз печени (n=1; 1,6%), хроническая обструктивная болезнь легких (n=2; 3,2%) и злокачественные новообразования различных локализаций (n=4; 6,3%). При детальном сборе анамнеза выяснилось, что только 33 (44,6%) пациента из 74 были информированы на амбулаторном этапе о наличии сопутствующих заболеваний и соответственно не проходили лечение у профильных специалистов.
При анализе совместного распределения частот (с применением статистики Хи-квадрат Пирсона) видов коморбидности у пациентов с разным исходом госпитализации были установлены значимые различия при наличии гипертонической болезни и хронической болезни почек (р <0,05; табл. 6). Анализ показал, что у пациентов с гипертонической болезнью чаще имел место летальный исход госпитализации (87,3%) по сравнению с пациентами без этого заболевания (27,3%), а у пациентов с хронической болезнью почек (ХБП) исход госпитализации всегда был летальным. Критерием установки диагноза ХБП являлось наличие анамнестических данных или данных медицинской документации о наличии у пациента любых маркеров, связанных с повреждением почек и персистирующих в течение 3 мес вне зависимости от нозологического диагноза. Таким образом, можно сказать, что пациенты с гипертонической болезнью и ХБП реже выживают при госпитализации с COVID-19 (рис. 1). Для других видов коморбидности взаимосвязи с исходом госпитализации обнаружено не было либо количество пациентов было недостаточным для проведения статистического анализа.

Взаимосвязи данных видов коморбидности с прогрессий по КТ обнаружено не было.
При анализе совместного распределения частот (с применением статистики Хи-квадрат Пирсона) наличия ХБП у пациентов с коморбидностью и их перевода на ИВЛ были выявлены значимые различия (Хи-квадрат=5,899; р=0,015; табл. 7). Так, установлено, что коморбидных пациентов вне зависимости от наличия ХБП в большинстве случаев переводили на ИВЛ, но при наличии ХБП этот показатель составил 100% (рис. 2). Изучение взаимосвязи гипертонической болезни с переводом на ИВЛ проведено не было, так как количество пациентов без этого заболевания оказалось слишком малым для статистического анализа.
Для гипертонической болезни достоверно значимые изменения лабораторных показателей соответствовали изменениям этих показателей в группе коморбидности в целом, так как количество пациентов с этим заболеванием (n=71) почти полностью совпадало с размерами выборки коморбидных больных (n=74).
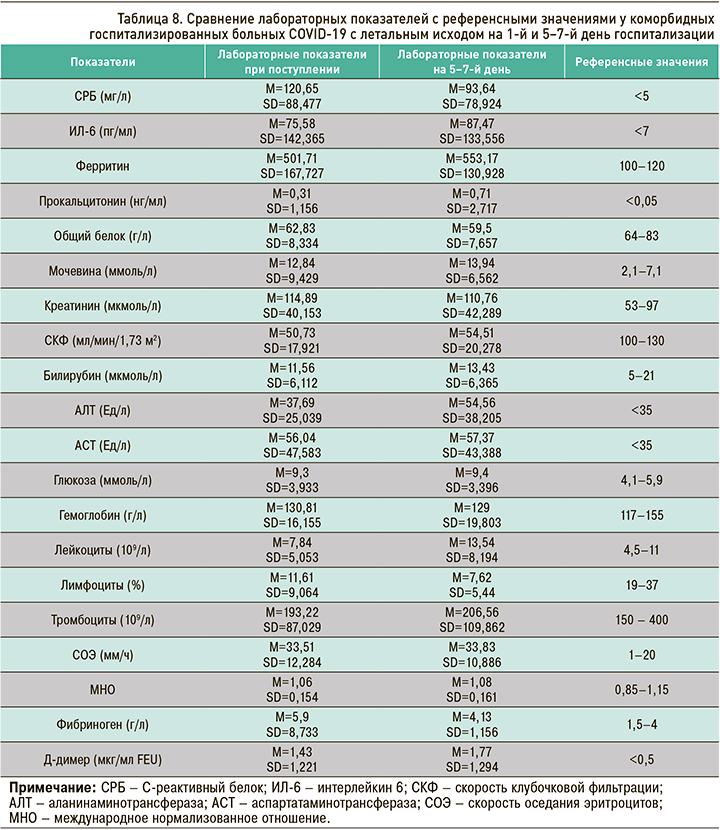
При сравнении средних значений лабораторных показателей с их референсными значениями на 1-й и 5–7-й день госпитализации у пациентов с коморбидностью и летальным исходом было выявлено следующее (табл. 8):
- СРБ, ИЛ-6, ферритин, мочевина, креатинин, АСТ, глюкоза, СОЭ значительно превышали верхнюю норму референсных значений на обоих срезах;
- АЛТ значительно превышал верхнюю норму референсных значений на 5–7-й день госпитализации;
- СКФ и лимфоциты были значительно ниже нормы референсных значений на обоих срезах;
- билирубин, гемоглобин, тромбоциты и МНО находились в пределах нормы на обоих срезах;
- лейкоциты были в пределах нормы в первый день госпитализации.
При применении Z-критерия Уилкоксона были обнаружены значимые различия в уровне таких лабораторных показателей, как СРБ, ферритин, прокальцитонин, общий белок, мочевина, билирубин, АЛТ, лейкоциты, лимфоциты и Д-димер (р <0,05) на разных днях госпитализации у пациентов с коморбидностью. Анализ средних значений позволяет констатировать, что уровни ферритина, прокальцитонина, мочевины, билирубина, АЛТ и Д-димера повысились, а показатели общего белка и лимфоцитов понизились к 5–7-му дню госпитализации по сравнению с первым днем (табл. 9). В отношении ИЛ-6, креатинина, СКФ, АСТ, глюкозы, гемоглобина, тромбоцитов, СОЭ, МНО и фибриногена значимых различий в динамике обнаружено не было.
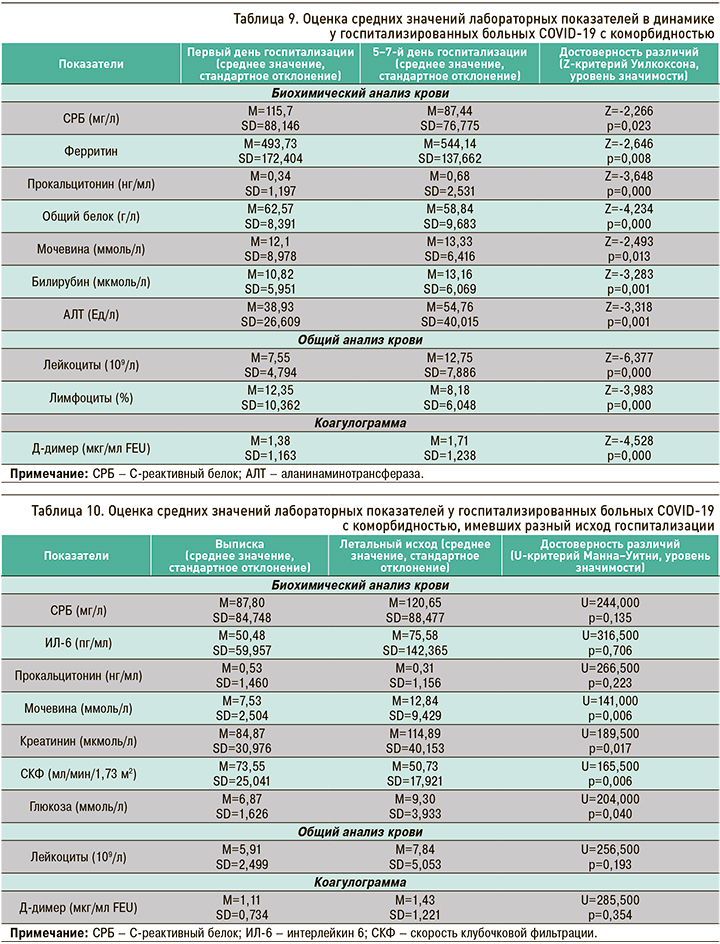
При использовании U-критерия Манна–Уитни были выявлены значимые различия в показателях мочевины, креатинина, СКФ и глюкозы (p <0,05) у пациентов с коморбидностью, имевших разный исход госпитализации. Анализ средних значений показал, что у выписанных пациентов показатель СКФ был выше, а мочевины, креатинина и глюкозы ниже, по сравнению с пациентами с летальным исходом (табл. 10). Для уровней СРБ, ИЛ-6, прокальцитонина, лейкоцитов и Д-димера значимых различий установлено не было.
В результате корреляционного анализа связей (Ro-Спирмена) на выборке коморбидных пациентов (n=74) были обнаружены слабые отрицательные корреляции на высоких уровнях значимости СКФ с индексом коморбидности на первый день госпитализации и слабые положительные корреляции на высоких уровнях значимости показателей креатинина и глюкозы с индексом коморбидности (табл. 11). Для СРБ, ИЛ-6, прокальцитонина, мочевины, лейкоцитов и Д-димера значимых корреляций с индексом коморбидности обнаружено не было.
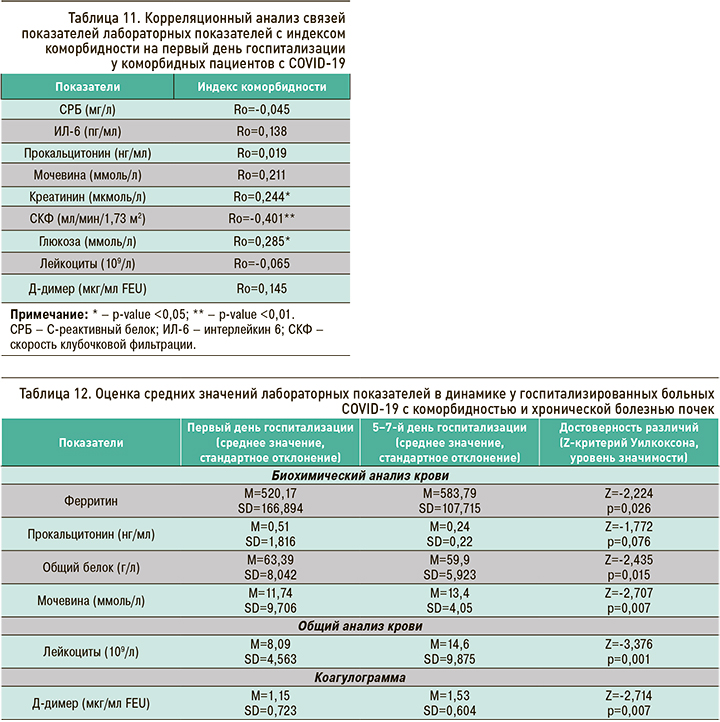
Таким образом, в первый день госпитализации у коморбидных пациентов при большем значении индекса коморбидности наблюдались более высокие уровни креатинина и глюкозы и менее высокие показатели СКФ.
При применении Z-критерия Уилкоксона были обнаружены значимые различия в уровне таких лабораторных показателей, как ферритин, общий белок, мочевина, лейкоциты и Д-димер (р <0,05) и различия на уровне тенденций в уровнях прокальцитонина (Z=-1,772; p=0,076) на разных днях госпитализации у пациентов с коморбидностью и ХБП. Анализ средних значений продемонстрировал, что у пациентов с ХБП уровни ферритина, мочевины, лейкоцитов и Д-димера повысились, а показатели прокальцитонина и общего белка понизились к 5–7-му дню госпитализации по сравнению с первым днем (табл. 12). Для СРБ, ИЛ-6, креатинин, СКФ, билирубина, АЛТ, АСТ, глюкозы, гемоглобина, лимфоцитов, тромбоцитов, СОЭ, МНО и фибриногена значимых различий в динамике выявлено не было.
Сравнение пациентов с коморбидностью и без коморбидности (n=44)
Вследствие значительного неравенства групп респондентов по наличию коморбидности при помощи программных средств IBM SPSS Statistics 26 (rus) был проведен случайный отбор 22 наблюдений из группы коморбидных пациентов для уравновешивания категорий сравнения. Полученную подвыборку (n=22) для выполнения статистического анализа составили пациенты с коморбидностью в возрасте от 29 до 88 лет (Mвозраст=65,23; SD=12,645), 36,4% мужчин. Различий по полу между подвыборками не было (Хи-квадрат=2,277, p=0,131), тогда как различия по возрасту оказались значимыми (U-критерий Манна-Уитни=88,500; р=0,000).
Группы пациентов значимо не различались по степени поражения КТ (на обоих срезах), баллам по шкале NEWS2 и количеству осложнений.
При анализе совместного распределения частот (с применением статистики Хи-квадрат Пирсона) наличия бактериальных осложнений у пациентов, имеющих разный статус по коморбидности (табл. 13), были выявлены значимые различия (Хи-квадрат=5,867; р=0,015). Анализ показал, что у больных с коморбидностью бактериальные осложнения встречались чаще (63,6%), чем у пациентов без коморбидности (27,3%). Таким образом, можно сказать, что пациенты, госпитализированные с COVID-19 и имеющие коморбидность, в большей степени предрасположены к бактериальным осложнениям (рис. 3).
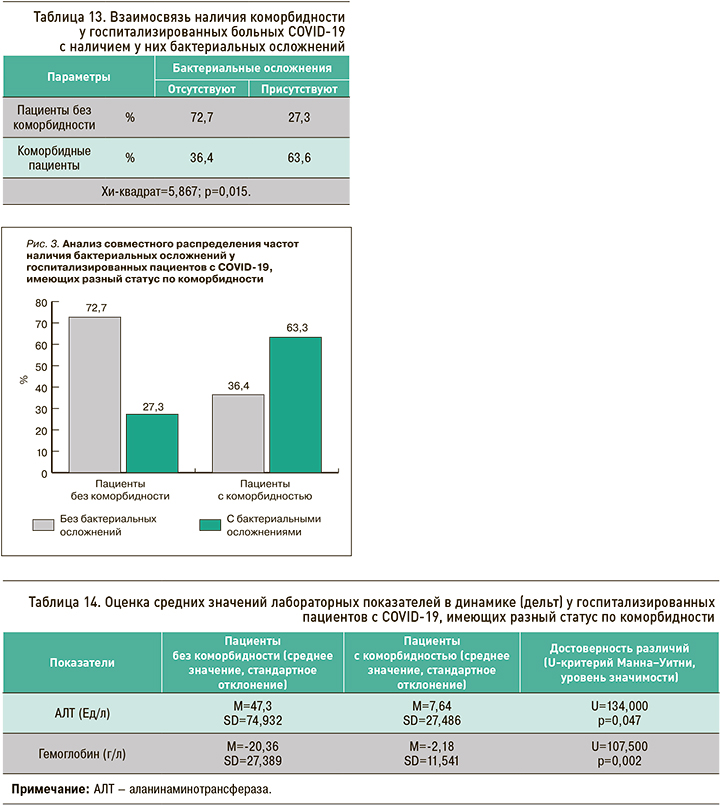
Для дальнейшего анализа были подсчитаны дельты лабораторных показателей. При применении U-критерия Манна–Уитни были выявлены значимые различия в динамике лабораторных показателей (дельтах), у пациентов с разным статусом по коморбидности (р<0,05). Анализ средних значений свидетельствует, что АЛТ в обеих группах повысился к 5–7-му дню госпитализации, но больший прирост наблюдался в группе пациентов без коморбидности. Гемоглобин в обеих группах понизился, но большее снижение отмечалось также среди пациентов без коморбидности (табл. 14). Для остальных лабораторных показателей значимых различий обнаружено не было.
Ограничения
Ограничением данного исследования является относительно небольшой размер выборки, широкий возрастной диапазон, а также значимые различия групп сравнения по возрасту (U-критерий Манна–Уитни=88,500; р=0,000). Это может служить основанием для последующих работ, посвященных рассматриваемой теме.
ОБСУЖДЕНИЕ
В нашем исследовании представлены данные коморбидных пациентов, госпитализированных в ковидный госпиталь по причине тяжелого и крайне тяжелого течения коронавирусной инфекции. Эта когорта больных достигла среднего возраста 70 лет, что, согласно предыдущим исследованиям, указывает на повышенный риск развития CОVID- 19 и связанного с ним летального исхода в данной категории пациентов [6, 7].
У подавляющего большинства пациентов, включенных в представленное исследование, диагностировались коморбидные заболевания. Среди них чаще всего регистрировались гипертоническая болезнь, ожирение и ХБП, что согласуется с данными вскрытия умерших больных в виде обнаружения характерных макро- и микроскопических признаков. Вышеуказанные заболевания, наряду с возрастом старше 65 лет, выступали факторами риска неблагоприятного исхода COVID-19 [1, 4, 8]. Полученные результаты коррелируют с данными проведенных ранее исследований [9] и подтверждают тот факт, что пациенты с уже существующими в анамнезе коморбидными состояниями или факторами риска развития тяжелого течения заболевания имеют наиболее высокую вероятность летального исхода при COVID-19 [10].
SARS-CoV-2 представляет собой оболочечный несегментированный одноцепочечный вирус с положительной РНК [11, 12]. Ангиотензинпревращающий фермент 2 (АПФ2) – белок, обнаруженный на поверхности эпителиальных клеток легких и энтероцитов тонкого кишечника, который был предложен в качестве входных ворот для SARS-CoV-2 [13]. АПФ2 расщепляет ангиотензин II, являющийся провоспалительным фактором в легких. Нарушение регуляции иммунной системы, повышенная метаболическая потребность и прокоагулянтная активность, вероятно, становятся причиной некоторого повышенного риска неблагоприятных исходов у людей с сердечно-сосудистыми заболеваниями (ССЗ), связанными с COVID-19 [14, 15]. В частности, системная воспалительная реакция может дестабилизировать атеросклеротические бляшки, кроме того, вирусная инфекция увеличивает активность цитокинов, подобно гриппу [16, 17]. Пациенты с ССЗ имеют более высокий риск развития острого коронарного синдрома при острых инфекциях, что подтверждается нашими данными. COVID- 19 усугубляет системную гипоксию, увеличивая потребность миокарда в кислороде, кроме того, повышенная активность воспалительных цитокинов провоцирует активность прокоагулянтов и гемодинамическую нестабильность, приводящую к ишемии и тромбозу [18]. Недавние исследования показали, что вирус может также вызывать прямое повреждение сердца, используя рецепторы АПФ2, расположенные в сердечной ткани [19].
Гипертоническая болезнь и сахарный диабет – наиболее распространенные хронические заболевания среди людей с тяжелым и крайне тяжелым течением COVID-19, требующим стационарного лечения. В исследовании 5700 пациентов (средний возраст 63 года; 39,7% женщин) наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (56,6%), ожирение (41,7%) и сахарный диабет (33,8%). В целом недавние исследования свидетельствуют, что пациенты с COVID- 19 и гипертонией имеют более высокий риск смерти по сравнению с пациентами без гипертонии [20, 21]. Стоит отметить, что у таких пациентов уже имеется хронический воспалительный процесс, а присоединение вируса приводит к дисбалансу между вызванным инфекцией повышением метаболической потребности миокарда и снижением сердечного резерва [22, 23]. Гипертония как хроническое заболевание подразумевает провоспалительное состояние, которое наблюдается при некоторых инфекционных заболеваниях, а также ослабление врожденного иммунного ответа, что является важным компонентом патогенеза COVID-19, особенно у больных с крайне тяжелым течением COVID- 19. Показательны результаты ретроспективного когортного исследования, включившего данные 126 пациентов с COVID-19 и ранее существовавшей гипертонией и 125 пациентов соответствующего пола и возраста с COVID- 19 без гипертонии. Среди гипертоников у 21,3% пациентов инфекция SARS-CoV-2 протекала в тяжелой форме, также в этой группе наблюдался более высокий уровень смертности по сравнению с группой без гипертонии (10,3 против 6,4%). Это указывает на то, что артериальная гипертензия служит важнейшим фактором риска, связанным с неблагоприятным клиническим исходом новой коронавирусной инфекцией. Кроме того, у гипертоников с COVID-19 отмечались более высокие показатели маркеров воспаления, таких как СРБ, прокальцитонин и ИЛ-6 по сравнению с контрольной группой, что подтверждает усиление воспаления при артериальной гипертензии у пациентов, инфицированных SARS-CoV-2. Интересно, что пациенты с гипертонической болезнью, получающие антигипертензивную терапию блокаторами РААС, имели менее выраженный воспалительный профиль по сравнению с пациентами, получающими терапию другими группами антигипертензивных препаратов [24, 25].
ХБП определяется как снижение функции почек, оцениваемое по СКФ и другим маркерам повреждения почек (даже при нормальной СКФ), например, по повышенной альбуминурии, изменениям осадка мочи или наличию структурных аномалий ткани почек, сохраняющихся более 3 мес. Считается, что пороговые значения СКФ и альбуминурии для здорового человека составляют <60 мл/мин/1,73 м2 и >30 мг/г в моче соответственно. Несмотря на согласованное определение ХБП, появившееся еще в 2012 г., соответствующий диагноз часто не регистрируется в медицинских картах пациентов. 850 млн человек во всем мире страдают ХБП, что составляет примерно 10–15% населения планеты. Согласно прогнозам, к 2040 г. ХБП станет пятой ведущей причиной смерти в мире и одной из двух основных причин смерти до конца столетия в некоторых европейских странах, особенно в странах, где ожидаемая продолжительность жизни самая высокая. Действительно, пациенты с ХБП, особенно с почечной недостаточностью, подвергаются повышенному риску преждевременной смерти от многих причин, включая сердечно-сосудистые заболевания (ССЗ) и инфекции [26].
В условиях пандемии COVID-19 ХБП также является актуальной проблемой. По материалам 17 тыс. вскрытий, выполненных за год в Москве у умерших больных от COVID-19, гипертоническая болезнь как самая частая причина ХБП встречалась у 57–59% больных. Сегодня мы наблюдаем так называемый второй удар: острые повреждения почек у больных с длительным течением гипертонической болезни и сахарного диабета, как правило, не контролируемым. Нефроангиосклероз, который является результатом течения данных заболеваний, – это мишень для нового ковидного повреждения с развитием фульминантной почечной недостаточности [27].
Согласно данным литературы, как и в нашем исследовании, у умерших больных максимальные изменения различной давности и степени выраженности выявляются в легких [6, 8, 30]. Вторым по степени тяжести изменений органом-мишенью было сердце, повреждение которого в ряде случаев преобладало и служило непосредственной причиной смерти. На вскрытии обнаруживались признаки хронического венозного полнокровия внутренних органов, мускатная печень с выраженной жировой дистрофией, липоматоз поджелудочной железы, гипертрофия миокарда левого желудочка, тромбозы коронарных артерий сердца, артерий головного мозга и других органов. Более того, среди причин летального исхода были зафиксированы случаи острого нарушения мозгового кровообращения и один случай острого инфаркта миокарда 1-го типа, что следует расценивать как проявление или осложнение COVID-19. Эти результаты соответствуют данным мировой статистики. Таким образом, наличие коморбидных заболеваний не только отягощало течение заболевания, но и нередко выходило на первое место в танатогенезе, а крайне тяжелое течение коронавирусной инфекции, скорее, являлось фактором, способствующим прогрессии имеющегося соматического заболевания.
С учетом данных многих источников неизменным остается тот факт, что основной причиной смерти у инфицированных COVID-19 выступает ОРДС [28–30]. Вместе с тем и в других органах, в первую очередь органах сердечно-сосудистой системы, возникают значительные структурные изменения, приводящие к полиорганной недостаточности и способствующие наступлению летального исхода.
Согласно результатам нашего исследования, непосредственными причинами смерти больных с COVID-19 были острая дыхательная недостаточность, легочно-сердечная недостаточность, тромбоэмболия легочной артерии, отек головного мозга и полиорганная недостаточность. Значительным по распространенности смертельным осложнением как в нашем, так и в других исследованиях [31–33] у пациентов с крайне тяжелым течением COVID-19 было присоединение к вирусному компоненту бактериальной инфекции, что проявлялось при аутопсии преимущественно гнойно-некротическими изменениями в легких. Присоединение бактериальной инфекции в виде вирусно-бактериальной пневмонии, а также сепсиса и септического шока было характерно преимущественно для больных, длительно (более недели) находившихся на ИВЛ, что коррелирует с данными предыдущих исследований [34].
В настоящее время не существует единых для всех терапевтических подходов к лечению COVID- 19, одобренных Минздравом России, Всемирной организацией здравоохранения, международными профессиональными сообществами и советами экспертов. То есть основным подходом к терапии COVID-19 должно быть своевременное назначение лечения до развития полного симпмтомокомплекса жизнеугрожающих состояний, а именно пневмонии, ОРДС, сепсиса. Это указывает на необходимость мониторинга состояния пациента в рамках оказания медицинской помощи для выявления признаков ухудшения его клинического состояния и внесения корректив в лечение при неблагоприятном течении болезни.
При этом следует подробнее остановиться на группах населения с сопутствующими заболеваниями и повышенной опасностью развития тяжелых заболеваний, которые могут подвергаться более высокому риску развития тяжелой формы COVID- 19; таким пациентам вне зависимости от тяжести течения заболевания и даже при общем благополучном состоянии по решению врача может оказываться помощь в условиях стационара. В каждом конкретном клиническом случае решение об объеме и характере проводимой терапии должно приниматься на персонифицированной основе, только с учетом национальных рекомендаций и консультативных заключений специалистов различных направлений после подтверждения диагноза.
Этиотропное лечение COVID-19 у больных с сопутствующей патологией требует повышенного внимания к возможным лекарственным взаимодействиям. Рекомендации по лечению коморбидных состояний и осложнений следует осуществлять на индивидуальной основе в зависимости от наличия основного жизнеугрожающего симптомокомплекса в соответствии с клиническими рекомендациями, стандартами медицинской помощи по данным заболеваниям, состояниям и осложнениям [35].
ЗАКЛЮЧЕНИЕ
Влияние коморбидной патологии на клинические проявления, диагностику, прогноз и лечение многих заболеваний многогранно и индивидуально. Взаимодействие заболеваний, возраста и лекарственного патоморфоза значительно изменяет клиническую картину и течение основной нозологии, характер и тяжесть осложнений, ухудшает качество жизни больного, ограничивает или затрудняет лечебно-диагностический процесс.
Коморбидность оказывает влияние на прогноз для жизни, увеличивает вероятность летального исхода. Тяжелое течение пневмонии, вызванной вирусом SARS-CoV-2, с летальным исходом наиболее часто регистрируется у людей старшей возрастной группы с заболеваниями сердечно-сосудистой системы, цереброваскулярной патологией и злокачественными опухолями. Особое внимание следует обращать на пациентов, имеющих в анамнезе кардиоваскулярную патологию, осложненную поражением органов-мишеней, а именно больных с неконтролируемой артериальной гипертензией и ХБП. Пациенты, у которых имеют место такие факторы риска, как возраст старше 65 лет, коморбидные заболевания в сочетании с лихорадкой выше 38 °С, одышкой и слабостью, требуют немедленной госпитализации в стационар вне зависимости от уровня гипоксемии и изменений по данным КТ для дальнейшего наблюдения и лечения в связи с высокой вероятностью летального исхода.
Наше исследование подчеркивает важность патоморфологического исследования для полного понимания клиницистами верности своих суждений и формирования верного алгоритма диагностики и лечения сложной категории больных, к которым относятся коморбидные пациенты с тяжелым и крайне тяжелым течением коронавирусной инфекции.



