АКТУАЛЬНОСТЬ
Хроническая болезнь почек (ХБП) через сердечно-сосудистые риски и развитие терминальной почечной недостаточности напрямую влияет на глобальное бремя заболеваемости и смертности во всем мире. Прогрессирующие структурно-функциональные изменения в сердечно-сосудистой системе в случае ХБП обусловливают плохой прогноз заболевания [1, 2]. Среди многочисленных «почечных» факторов сердечно-сосудистого риска при ХБП существенное значение имеют цитокиновый статус и показатели системного воспаления. К цитокинам относятся интерфероны, колониестимулирующие факторы, хемокины, трансформирующие ростовые факторы, фактор некроза опухоли альфа (ФНО-α), интерлейкины (ИЛ) и др. Повреждающие эффекты цитокинов проявляются при их избыточной, долговременной и генерализованной продукции, при нарушении равновесия между про- и противовоспалительными типами цитокинов [3]. При ХБП начало воспалительного ответа и основные этапы его развития происходят с участием иммунокомпетентных клеток в присутствии цитокинов, которые продуцируются клетками иммунной системы в ответ на стимуляцию инфекционными антигенами, в том числе вирусами, и играют весьма важную патогенетическую роль в возникновении сердечно-сосудистых осложнений [4].
Субклиническое воспаление эндотелия сосудистой стенки рассматривается как важное звено патогенеза артериальной гипертензии (АГ), атеросклероза и, возможно, прогрессирования ренальной дисфункции [3–5]. Поэтому изучение показателей системного воспаления и его взаимосвязи со структурно-функциональными изменениями сердечно-сосудистой системы при ХБП остается актуальной задачей для оценки прогноза заболевания и эффективности рено- и кардиопротективной терапии.
Цель исследования – дать характеристику показателям системного воспаления во взаимосвязи с изменениями сердечно-сосудистой системы у больных с ХБП.
МАТЕРИАЛ И МЕТОДЫ
Проведено клиническое наблюдение и обследование 150 пациентов с ХБП. Наблюдение и обследование больных осуществлялось на базе Тюменского кардиологического научного центра и Тюменского ГМУ (кафедра пропедевтической терапии). Пациенты с ХБП были разделены на 2 группы: 1-я – лица без сердечно-сосудистых заболеваний (n=75); 2-я – лица, имеющие сердечно-сосудистые заболевания (n=75).
Возраст участников исследования составил 57 [51,00; 63,00] лет в группе без сердечно-сосудистых заболеваний (ССЗ) и 58 [52,00; 63,00] лет – в группе c CCЗ. Среди кардиоваскулярных заболеваний 54,4% пациентов во второй группе имели АГ, 16,5% – ишемическую болезнь сердца (ИБС), 32,1% – нарушения ритма сердца; сердечная недостаточность 1–2 ст. по NYHA имелась у 68,3% человек. Группы значимо различались по уровню систолического (САД), диастолического артериального давления (ДАД), частоте сердечных сокращений (ЧСС), индексу массы тела (р <0,001 для всех параметров), с более высокими показателями во 2-й группе. По стадиям ХБП пациенты распределились следующим образом: С1 – 56,4%, С2 – 43,6% в группе без ССЗ; С1 – 52,5% и С2 – 47,5% в группе с ССЗ.
Всем больным было выполнено клиническое, лабораторное и инструментальное обследование (суточное мониторирование АД, эхокардиография). Участники исследования были осмотрены терапевтом, кардиологом, нефрологом.
Специальные методы исследования включали определение уровня ИЛ-1, ИЛ-6, ИЛ-8, ФНО- α, фактора пролиферации фибробластов (TgFb1) и высокочувствительного С-реактивного белка (вчСРБ) иммунотурбидиметрическим методом на полуавтоматическом анализаторе открытого типа Clima MC-15 (Испания), а также Д-димера, фибриногена, ферритина, натрийуретического пептида (NT-proBNP), цистатина С, микроальбуминурии (МАУ) на анализаторе Destiny Plus (Ирландия). Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле CKD-EPI.
Статистический анализ проводился с помощью пакета прикладных программ IBM SPSS Statistics 21. В зависимости от распределения при сравнении показателей в двух независимых группах использовался t-критерий Стьюдента или U-критерий Манна–Уитни. При нормальном распределении данные представлены как среднее М и стандартное отклонение (SD), при распределении, отличном от нормального, – в виде медианы (Me) и интерквартильного размаха [25%; 75%]. С помощью парного критерия Стьюдента или критерия Вилкоксона рассчитывалась динамика между связанными группами. Результаты оценивались как статистически значимые при двухстороннем уровне р <0,05.
РЕЗУЛЬТАТЫ
Как показали проведенные исследования (табл. 1), у наблюдаемых больных с ХБП и ССЗ отмечается повышение уровня ИЛ-1 (p <0,003), ИЛ-6 (p <0,001), ФНО-α (p <0,004), а также тенденция к повышению уровня TgFb1 (p <0,702) и снижению уровня ИЛ-8 (p <0,301) по сравнению с больными ХБП без ССЗ. Кроме того, у пациентов с ССЗ выявлено значительное (более чем в 2 раза) повышение уровня вчСРБ, а также в меньшей степени Д-димера, фибриногена и ферритина, по сравнению с больными ХБП без ССЗ.
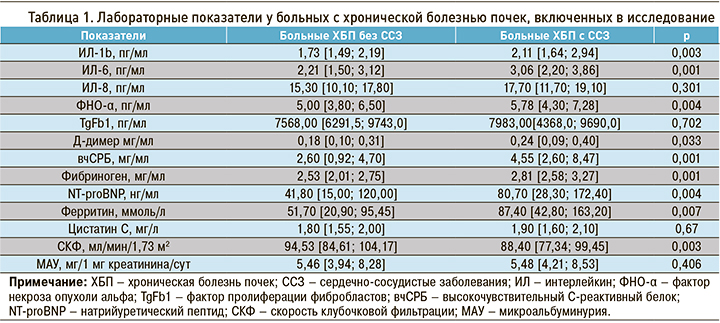
Уровень NT-proBNP у наблюдаемых больных с ССЗ оказался почти в 2 раза выше, чем у пациентов без ССЗ (р <0,004), а СКФ – ниже на 6,5% (p <0,003). Это свидетельствует о наличии сердечной и почечной недостаточности в группе больных ХБП с ССЗ. Кроме того, нами отмечена тенденция к увеличению уровня цистатина С (p <0,67) и МАУ (p <0,406) в группе больных с ССЗ по сравнению с группой без ССЗ.
Суточное мониторирование АД показало более высокие значения у наблюдаемых больных с кардиоваскулярными заболеваниями среднего САД (161±3,8 против 131±2,6 мм рт.ст. у пациентов без ССЗ, р <0,001) и ДАД (96,2±2,8 против 83,2±1,8 мм рт.ст., р <0,001), а также скорости утреннего подъема САД (19,4±1,4 против 13,1±1,2 мм рт.ст., р <0,001) и ДАД (14,1±0,7 против 9,2±0,5 мм рт ст., р <0,001).
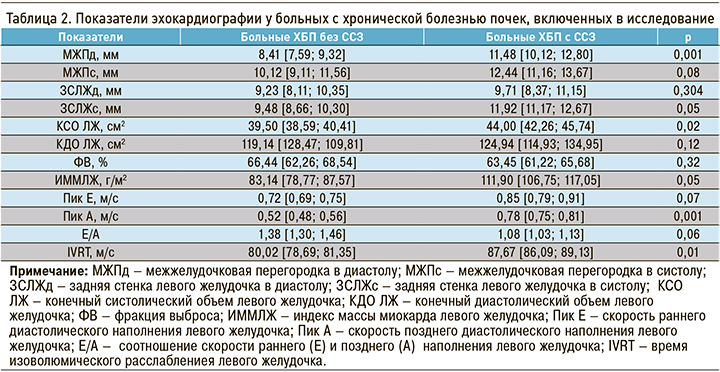
По данным эхокардиографического исследования (табл. 2) у пациентов с ХБП и ССЗ, по сравнению с больными ХБП без сердечно-сосудистой патологии, наблюдалось увеличение толщины межжелудочковой перегородки в диастолу, задней стенки левого желудочка в систолу, индекса массы миокарда левого желудочка, а также конечно-систолического объема левого желудочка. При сравнении показателей трансмитрального кровотока в наблюдаемых группах были получены достоверные различия: у пациентов с ССЗ скорость позднего наполнения левого желудочка и время изоволюмического расслабления были существенно выше, чем в группе без кардиоваскулярных заболеваний (см. табл. 2). Это свидетельствует о нарушении диастолической функции ЛЖ у больных ХБП с ССЗ.
ОБСУЖДЕНИЕ
При ХБП начало воспалительного ответа и основные этапы его развития проходят с участием иммунокомпетентных клеток. Известно, что ренин-ангиотензин-альдостероновая система (РААС) может стимулировать продукцию ряда цитокинов, способствующих прогрессированию нефросклероза и присоединению сердечно-сосудистых осложнений. Кроме того, установлено, что уровень провоспалительных цитокинов коррелирует с активностью ХБП и степенью морфологических изменений в почечной ткани [5, 6].
К настоящему времени установлено, что такие провоспалительные цитокины, как ИЛ-1, ИЛ-6, ФНО-α, ассоциируются с высокой частотой развития осложнений при ХБП и рассматриваются в качестве иммунологических маркеров сердечно-сосудистого риска [7]. Кроме того, ФНО-α является сильным активатором перекисного окисления липидов и системы свертывания крови, усиливает тромбогенную и вазоконстриктивную активность эндотелия, снижает синтез оксида азота, что в конечном итоге приводит к прогрессированию эндотелиальной дисфункции, повышению жесткости артериального русла и формированию сердечно-сосудистых осложнений [8]. Было обнаружено, что у пациентов с АГ и гипертрофией левого желудочка повышалось содержание ФНО-α и ИЛ-6 без существенного повышения концентрации СРБ и ИЛ-1 [10]. В наших ранее проведенных исследованиях [11, 12] также было выявлено существенное нарушение состояния сердечно-сосудистой системы у наблюдаемых больных с изменением морфометрических показателей сердца, нарушением диастолической функции левого желудочка, а также показателей суточного мониторирования АД, что может рассматриваться как предиктор неблагоприятного течения и прогноза заболевания.
ЗАКЛЮЧЕНИЕ
Таким образом, патологические процессы, лежащие в основе ХБП, сопровождаются возрастанием уровня провоспалительных цитокинов и показателей системного воспаления, что способствует ускорению кардиоваскулярных осложнений посредством эндотелиальной дисфункции. Полученные нами результаты могут служить предпосылкой для совершенствования патогенетической терапии ХБП с кардиоваскулярными проявлениями, в основе которой может быть применение препаратов с противовоспалительным эффектом – дапаглифлозина, биофлавоноидов (эскузан), аденозилметионина, омега-3 жирных кислот (эйкозапентаеновой и декозагексаеновой, обладающих противовоспалительными свойствами за счет снижения выработки эйкозаноидов и цитокинов), а также модуляция микробиоты кишечника [13].
Следовательно, существует настоятельная необходимость разработки новых методов ведения пациентов с ХБП и ССЗ, в том числе рекомендаций по применению новых противовоспалительных препаратов и методов нефро-и кардиопротекции.



