Ревматоидный артрит (РА) – системное хроническое аутоиммунное заболевание, сопровождающееся эрозивно-деструктивным поражением суставов, а также внесуставными проявлениями [1]. Ревматоидным артритом (РА) страдает около 0,6–1,0% населения России.
Согласно данным Федеральной службы государственной статистики, РА стал причиной смерти 1012 человек в 2016 г., что составило почти треть всех смертей (3188) от ревматологической патологии за указанный год [3]. Как правило, непосредственной причиной смертельного исхода при этой патологии становятся осложнения РА, причем летальность при поражении легких наиболее высокая среди других системных проявлений [4], в связи с чем чрезвычайно актуальной проблемой является своевременная диагностика вовлечения респираторной системы.
В настоящее время известно, что у больных РА в патологический процесс могут вовлекаться все анатомические структуры дыхательной системы: легкие, дыхательные пути и плевра [5]. Считается, что к прогностически неблагоприятным видам поражений легких при РА относятся интерстициальные варианты поражения [6]: обычная интерстициальная пневмония (ОИП), неспецифическая интерстициальная пневмония (НСИП) и др. Они имеют характерные проявления при сканировании на мультиспиральных компьютерных томографах (МСКТ); благодаря высокой чувствительности этот инструментальный метод рассматривается как основной в диагностике поражений легких при РА. Однако успешность ведения больного РА с интерстициальной болезнью легких во многом зависит от своевременности ее обнаружения, что остается серьезной практической проблемой, поскольку поражения легких склонны к длительному малосимптомному течению [7], а показания к активному МСКТ-мониторингу у больных РА не разработаны.
Многими исследователями были предприняты попытки определить предрасполагающие к развитию поражения легких факторы, которые позволили бы отнести того или иного пациента с РА к группе повышенного риска развития респираторных осложнений и оптимизировать диагностическую тактику. На сегодняшний день установлено, что поражениям легких более подвержены больные РА среднего и пожилого возраста вне зависимости от давности заболевания [8], мужского пола [6], курящие [9]. По поводу влияния на респираторные осложнения РА серологического профиля, особенно позитивности по ревматоидному фактору, мнения исследователей разнятся [10–12].
Целью нашего исследования стала оценка наличия и тяжести поражения дыхательной системы у больных РА с различным серологическим профилем.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 104 больных РА, подписавших информированное согласие на участие. Достоверность диагноза определялась в соответствии с общепринятыми критериями Американской коллегии ревматологов (ACR, 1987) и ACR/EULAR 2010 г. в случаях раннего РА.
Не включались в исследование пациенты с сопутствующей пульмонологической патологией (бронхиальная астма, хроническая обструктивная болезнь легких, туберкулез легких и др.), больные, имеющие профессиональный контакт с пульмонотоксичными веществами, пациенты с тяжелой коморбидной патологией (гипертоническая болезнь III стадии, ишемическая болезнь сердца, хроническая сердечная недостаточность, сахарный диабет, терминальная почечная недостаточность) и другими заболеваниями, способными повлиять на состояние дыхательной системы.
 Всем пациентам было проведено анкетирование, в ходе которого фиксировались жалобы со стороны опорно-двигательной и дыхательной систем, анамнез заболевания, статус курения, наличие профессиональных вредностей, перенесенные заболевания респираторной системы (пневмонии, туберкулез, бронхиты и др.), использование базисной терапии РА и ее состав. После опроса осуществлялись перкуссия и аускультация легких, осмотр и пальпация суставов. Активность суставного синдрома оценивалась по клиническим (счет болезненных и припухших суставов) и лабораторным показателям (уровень С-реактивного белка в сыворотке крови и скорости оседания эритроцитов), а также по субъективной оценке активности заболевания самим пациентом с использованием визуально-аналоговой шкалы (ВАШ). По вышеуказанным показателям рассчитывался индекс активности РА DAS28 (Disease Activity Score).
Всем пациентам было проведено анкетирование, в ходе которого фиксировались жалобы со стороны опорно-двигательной и дыхательной систем, анамнез заболевания, статус курения, наличие профессиональных вредностей, перенесенные заболевания респираторной системы (пневмонии, туберкулез, бронхиты и др.), использование базисной терапии РА и ее состав. После опроса осуществлялись перкуссия и аускультация легких, осмотр и пальпация суставов. Активность суставного синдрома оценивалась по клиническим (счет болезненных и припухших суставов) и лабораторным показателям (уровень С-реактивного белка в сыворотке крови и скорости оседания эритроцитов), а также по субъективной оценке активности заболевания самим пациентом с использованием визуально-аналоговой шкалы (ВАШ). По вышеуказанным показателям рассчитывался индекс активности РА DAS28 (Disease Activity Score).
Серологический профиль пациента определялся на основании его позитивности по ревматоидному фактору (РФ) и антителам к циклическому цитруллинированному пептиду (АЦЦП). Также при обследовании учитывалась рентгенологическая стадия РА по Штейнброкеру, функциональный класс заболевания и рассчитываемый показатель качества жизни Disability Index (DI) по опроснику HAQ (Health Assessment Questionnaire). Основные характеристики обследуемой группы представлены в таблице 1.
В качестве основного метода оценки поражения легких у больных РА использовалась мультиспиральная компьютерная томография (МСКТ), осуществлявшаяся на томографах Asteion (Toshiba) и Вright Speed (GE). Для уменьшения двигательных артефактов сканирование проводилось в каудокраниальном направлении при соблюдении условия: положение пациента – лежа с руками за головой, с задержкой дыхания на глубоком вдохе. Напряжение составляло 120 кВТ, экспозиция одного среза – 90 мАс, шаг спирали (pitch) – 3,5, толщина среза – 0,5 см, инкремент реконструкции – 5 мм. После проводилось функциональное исследование – повторное сканирование на выдохе, которое позволяет оценить наличие мозаичности вентиляции легочной ткани – «воздушных ловушек» – признака бронхообструктивных нарушений. Эффективная эквивалентная доза облучения была равна 3,4 мЗв.
С помощью радионуклидного исследования – однофотонной эмиссионной компьютерной томографии (ОФЭКТ) – исследовалось кровообращение в легких у больных РА. После внутривенного введения радиофармпрепарата Тс99m-МАКРОТЕХ (РФП) в дозе 1,0–1,5 МБк на 1 кг веса тела исследуемого проводилось сканирование на двухдетекторной гамма-камере Philips Forte (USA). С целью синхронизации изображения ОФЭКТ и МСКТ на область акромиального отростка лопатки помещали радиоактивную метку (2 мБк). Пациента обследовали в течение 10–12 мин в положении лежа в режиме Тotal Body по программе Lung Spect, в положении детекторов 180°, орбита эллиптическая, 32 азимута, 40 с на угол. Обработка производилась с помощью высокочастотного фильтра Furye трансформации по методу Нenning.
Для сопоставления данных лучевых исследований между собой, а также определения корреляционных связей между выраженностью поражений легких у больных РА по результатам рентгенорадиологических исследований и другим клинико-лабораторным показателям были разработаны специализированные интегральные шкалы оценки тяжести поражений легких по МСКТ и ОФЭКТ. Каждому изменению в легких, обнаруженному на МСКТ, начислялся балл (от 0 до 3) в зависимости от его степени выраженности и распространенности. Все баллы за выявленные интерстициальные изменения и поражения бронхиального дерева рассматривались отдельно, а затем суммировались, составляя общую шкалу МСКТ. В шкалу ОФЭКТ вошла интегральная оценка выраженности диффузных изменений микроциркуляции в легких и локальных изменений кровотока в баллах от 0 до 4.
Результаты исследования были обработаны посредством программы SPSS Statistics версии 22.0 с помощью непараметрических методов. При корреляционном анализе использовался коэффициент ранговой корреляции Спирмена. Сравнение двух выборок осуществлялось с помощью критерия Манна–Уитни. Различия считались достоверными при значении p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
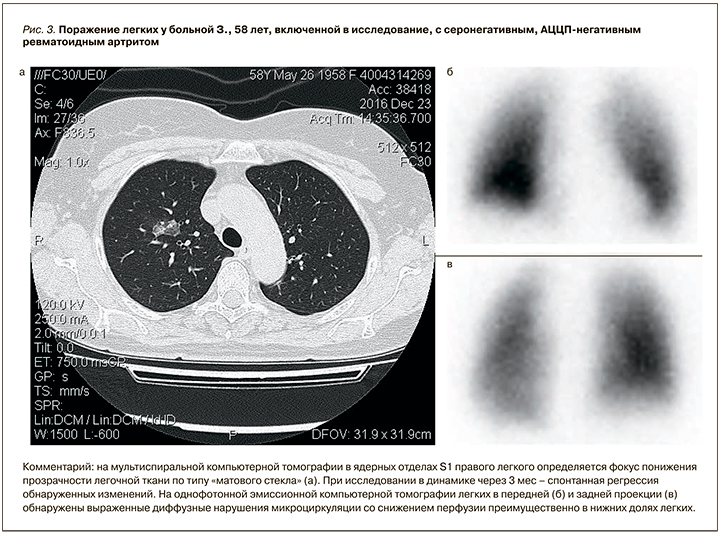
Обследование дыхательной системы у больных РА МСКТ выявило многоуровневые изменения респираторного аппарата (от крупных бронхов до респираторных отделов легких) различной степени тяжести. Частота встречаемости разных нарушений варьировалась от 4,8% (деформирующий бронхит) до 41% (бронхообструкция) (табл. 2). Помимо признаков поражения органов дыхания, у части пациентов наблюдались изменения других локализаций, также укладывавшиеся в рамки системных проявлений РА: плевроапикальные фибринозные наслоения (19,3%), выпотной плеврит (1,2%), выпотной перикардит (9,6%), увеличение внутригрудных/подмышечных лимфоузлов (10,8%), признаки системного остеопороза и патологических переломов грудных позвонков (8,4%).
При исследовании легочного кровотока с помощью ОФЭКТ на фоне диффузных нарушений микроциркуляции средней (89%) и тяжелой степени (11%) были обнаружены зоны локального снижения кровотока в различных сегментах левого и правого легких. Выраженность этих нарушений варьировала от умеренной до значительной гипоперфузии с образованием дефекта накопления РФП.
При сопоставлении выраженности легочного поражения по шкале МСКТ у пациентов с серопозитивным и серонегативным по РФ и АЦЦП профилем статистически значимых различий обнаружено не было. Однако оказалась достоверной разница в частоте встречаемости отдельных признаков патологии легких по данным компьютерной томографии. Так, у АЦЦП-позитивных больных РА значимо чаще выявлялись ревматоидные узелки в легких (p=0,041), а у АЦЦП-негативных – легочная гипертензия (p=0,023).
Сосудистые нарушения, установленные с помощью ОФЭКТ, у серопозитивных по РФ пациентов не отличались от таковых у серонегативных больных РА. В то же время была обнаружена достоверная разница между нарушением перфузии у позитивных и негативных по АЦЦП пациентов (р=0,037): у последних снижение легочного кровотока оказалось более выраженным (табл. 3).

Влияние серологического профиля больного РА на возникновение, развитие и исход поражения дыхательной системы в рамках основного заболевания стало широко изучаемой проблемой в последние годы. Несмотря на большое число работ в этой области, единогласного мнения о прогностической значимости указанного фактора у современных исследователей не сложилось до сих пор.
Ретроспективный анализ литературы показал, что наиболее часто противоречивые данные в исследованиях касаются влияния позитивности по РФ на развитие поражений легких у больных РА. Так, по результатам проспективного наблюдения за 2331 пациентом с ранним РА, проведенного S. Ajeganova et al. (2016), была установлена связь между высоким РФ и риском смерти от респираторных осложнений [10]. В то же время данные проспективного исследования Y. Yin et al. (2014), проведенного на 285 больных РА, опровергают предикторную значимость РФ в развитии поражений легких [12].
В нашем исследовании мы не получили достоверных различий в частоте и выраженности интерстициальных изменений у серопозитивных и серонегативных по РФ пациентов. Это может быть связано, с одной стороны, с относительно небольшой выборкой серонегативных пациентов. С другой стороны, РФ – крайне вариабельный показатель, поскольку он может значительно повышаться у больного РА при нарастании клинико-лабораторной активности суставного синдрома и резко снижаться при ее уменьшении (как спонтанно, так и на фоне использования базисной терапии) [13]. По всей вероятности, такая особенность РФ препятствует использованию его в качестве предиктора поражений легких, но не исключает более частого возникновения и тяжелого течения респираторных осложнений у пациентов с высокими значениями РФ [10].
Что касается влияния позитивности по АЦЦП на поражение дыхательной системы, то, согласно результатам последних исследований, высокие титры этого иммунологического показателя могут считаться прогностическим маркером развития и неблагоприятного течения интерстициальных поражений легких, ассоциированного с РА [6, 10, 12, 14]. АЦЦП служат более стабильным маркером патологии, так как обнаруживаются уже в доклинической стадии РА и, как правило, не подвергаются сероконверсии в течение заболевания [13], что создает определенные предпосылки для исследования и использования АЦЦП в качестве предиктора интерстициальных поражений легких.
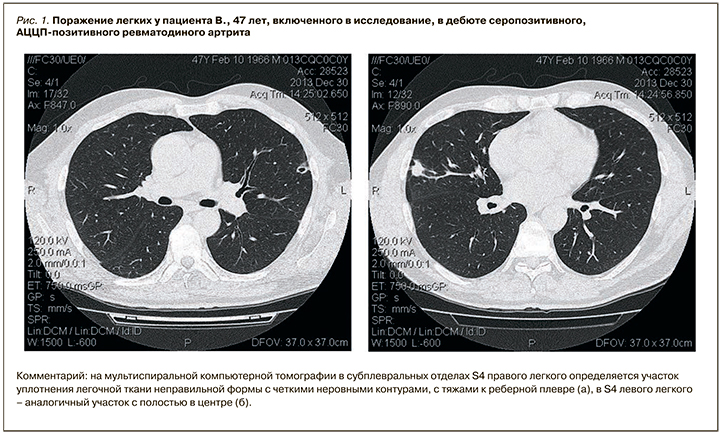
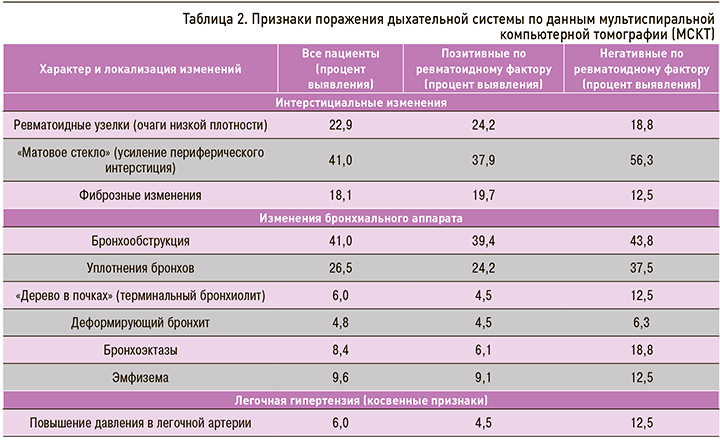
 По данным нашего исследования, у АЦЦП-позитивных пациентов достоверно чаще встречались ревматоидные узелки, а в отношении других МСКТ-признаков интерстициального поражения различия оказались статистически незначимыми. Факт того, что большинство различий оказалось недостоверным, также можно объяснить величиной выборки. Однако, на наш взгляд, полученные результаты в большей степени связаны с особенностью дизайна исследования и статистического анализа данных. Это обусловлено тем, что в цитируемых работах [6, 10, 12] осуществлялось сравнение титров АЦЦП у пациентов с клинически манифестированным интерстициальным поражением легких без учета субклинических вариантов, в то время как последние наблюдаются гораздо чаще – у 70–80% больных [11]. Судя по всему, именно это обстоятельство вызывает искажение данных статистического анализа. Не вызывает сомнений, что высокий титр АЦЦП ассоциирован с более тяжелым течением поражения легких [6, 12], но в то же время низкие цифры АЦЦП не исключают развитие субклинического интерстициального поражения легких (рис. 1 и 2).
По данным нашего исследования, у АЦЦП-позитивных пациентов достоверно чаще встречались ревматоидные узелки, а в отношении других МСКТ-признаков интерстициального поражения различия оказались статистически незначимыми. Факт того, что большинство различий оказалось недостоверным, также можно объяснить величиной выборки. Однако, на наш взгляд, полученные результаты в большей степени связаны с особенностью дизайна исследования и статистического анализа данных. Это обусловлено тем, что в цитируемых работах [6, 10, 12] осуществлялось сравнение титров АЦЦП у пациентов с клинически манифестированным интерстициальным поражением легких без учета субклинических вариантов, в то время как последние наблюдаются гораздо чаще – у 70–80% больных [11]. Судя по всему, именно это обстоятельство вызывает искажение данных статистического анализа. Не вызывает сомнений, что высокий титр АЦЦП ассоциирован с более тяжелым течением поражения легких [6, 12], но в то же время низкие цифры АЦЦП не исключают развитие субклинического интерстициального поражения легких (рис. 1 и 2).
В отличие от интерстициальных изменений при РА, поражение бронхиального дерева и бронхообструктивные нарушения, которые, как известно, могут развиваться у больных РА, остаются неизу-ченными. В единичных исследованиях, посвященных этой проблеме [15, 16], отсутствуют убедительные данные о связи вовлечения бронхиального аппарата при РА с серологическим профилем больного. Результаты нашего исследования продемонстрировали, что поражение бронхов и бронхообструкция чаще встречаются у серонегативных пациентов (см. табл. 2). Влияние других факторов, в частности курения, исключается, поскольку подгруппы серопозитивных и серонегативных больных были сопоставимы по распространенности курения и индексу курящего человека.
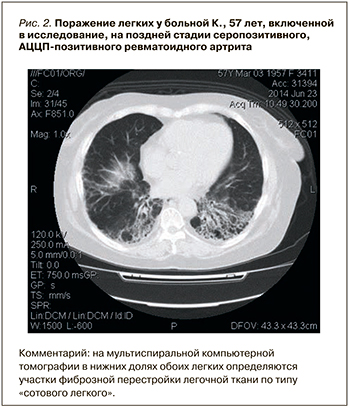
Обнаруженные у пациентов с РА перфузионные нарушения в легких по результатам ОФЭКТ оказались достоверно более выраженными у АЦЦП-негативных пациентов (рис. 3). Как было установлено нами ранее [17], сосудистые нарушения в легких у больных РА могут быть связаны не только с интерстициальным процессом, но и вовлечением бронхиального дерева: когда регионарный кровоток снижается в невентилируемых зонах легких, происходит шунтирование кровотока. Таким образом, более выраженное снижение легочной перфузии у серонегативных больных, очевидно, обусловлено более частым поражением у них бронхиального аппарата. Вероятно, что и легочная гипертензия, обнаруживавшаяся преимущественно у АЦЦП-негативных больных РА, связана в большей степени с перестройкой сосудистого русла легких как осложнением бронхообструктивного процесса.
Таким образом, серологический профиль больного РА оказывает влияние как на интерстициальный процесс в легких, так и на поражение бронхиального дерева, бронхообструктивные нарушения и сосудистые нарушения.
ЗАКЛЮЧЕНИЕ
- Серологический профиль больного РА определяет частоту возникновения и тяжесть поражения легких в рамках системного проявления заболевания.
- Высокие титры РФ и АЦЦП у больного РА позволяют отнести его к группе высокого риска развития клинически значимого интерстициального поражения легких, ассоциированного с этой ревматологической патологии.
- У серонегативных по РФ и АЦЦП пациентов превалируют поражение бронхиального аппарата и легочная гипертензия, а интерстициальный процесс чаще протекает субклинически.



