ВВЕДЕНИЕ
Гиперпаратиреоз – эндокринное заболевание, характеризующееся избыточной продукцией паратиреоидного гормона (ПТГ) в главных клетках околощитовидных желез (ОЩЖ). В зависимости от причины возникновения выделяют первичный (ПГПТ), вторичный (ВГПТ) и третичный гиперпаратиреоз. С учетом распространенности, сложности своевременной диагностики и клинических последствий наибольшую актуальность, на наш взгляд, представляет ПГПТ. Это заболевание сопровождается избыточной секрецией ПТГ при верхненормальном или повышенном уровне кальция крови вследствие первичной патологии ОЩЖ [1].
Официально регистрируемая распространенность ПГПТ в общей популяции колеблется в пределах 1% [2], однако в странах, где широко используются автоматические биохимические анализаторы и практикуется повсеместное определение уровня кальция в крови, наблюдается резкое увеличение выявляемости ПГПТ, в том числе и за счет его бессимптомных форм. Установлено, что ПГПТ может развиваться в любом возрасте, но чаще всего его регистрируют в диапазоне от 54 до 59 лет [3]. Соотношение заболевших женщин и мужчин составляет 3:1, причем у женщин ПГПТ часто развивается в первое десятилетие после наступления менопаузы.
Согласно современной классификации, выделяют бессимптомную и симптомную (манифестную) формы ПГПТ [1]. Клинические проявления заболевания чрезвычайно разнообразны, они включают костные, мышечные, почечные, гастроэнтерологические, кардиоваскулярные и нейрокогнитивные расстройства (табл.).
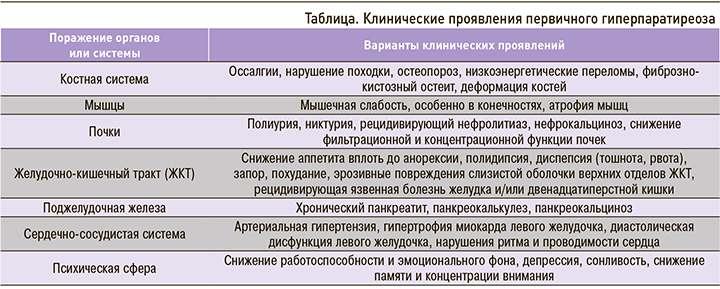
Клиническая картина начального периода ПГПТ, как правило, неспецифична, что может существенно затруднить своевременную диагностику заболевания.
Симптоматика гиперпаратиреоза в большинстве случаев пропорциональна выраженности гиперкальциемии [4]. Так, при сывороточном уровне общего кальция менее 3,0 ммоль/л жалобы пациентов неспецифичны – это общая и мышечная слабость, повышенная утомляемость, эмоциональная лабильность. Персистирующая гиперкальциемия в пределах 3,0–3,5 ммоль/л также протекает с минимальной симптоматикой, а быстропрогрессирующая гиперкальциемия, превышающая этот диапазон, сопровождается ухудшением состояния и сопряжена с развитием гастроэнтерологических, урологических, костных, кардиоваскулярных проявлений и осложнений.
Поражения со стороны опорно-двигательного аппарата при гиперпаратиреозе традиционно считаются наиболее частыми, очевидными и клинически значимыми. Причем эти нарушения вовсе не ограничиваются поражением только костной ткани, они включают чрезвычайно разнообразный спектр патологических изменений и в мышцах, и в суставах [5, 6]. Так, Pappu R. et al., проанализировав скелетно-мышечные симптомы у 74 пациентов с диагностированным ПГПТ, отметили, что среди суставных проявлений наиболее часто отмечались хондрокальциноз с отложением кристаллов гидроксиапатита кальция или без него (в 17,7% случаев), артралгии (15,2%) и неспецифический синовит (в 9,7%) [7]. В исследовании Н.Г. Мокрышевой было показано, что при ПГПТ практически одинаково часто встречается поражение суставов, мышц и костей (58, 46 и 66% соответственно) [8]. При этом в большей степени наблюдалось поражение крупных суставов (в 88% случаев) по сравнению с мелкими (в 12%).
К одному из проявлений суставной патологии при ПГПТ относят хондрокальциноз (частота встречаемости от 9 до 40% случаев) [6], который также служит одним из основных классификационных критериев болезни депонирования кристаллов пирофосфата кальция (ПФК) [9]. Согласно современной классификации этого заболевания, выделяют 4 его фенотипа: 1) бессимптомное депонирование кристаллов ПФК; 2) остеоартрит с депонированием кристаллов ПФК (ранее для обозначения этой формы использовался термин «псевдоостеоартроз»); 3) острый артрит с кристаллами ПФК («псевдоподагра»); 4) хронический артрит с кристаллами ПФК («псевдоревматоидный артрит») [10]. Последний фенотип болезни, как правило, представлен олиго- или полиартритом с симметричным поражением суставов, в том числе мелких, с утренней скованностью, припухлостью и нередко с повышением острофазовых показателей, перемежающимся вспышками артрита с характерными признаками кристаллического воспаления. Описанная клиническая картина хронического артрита схожа с симптоматикой ревматоидного артрита (РА), что может стать причиной поздней диагностики болезни депонирования кристаллов ПФК. В свою очередь, болезнь депонирования кристаллов ПФК может выступать не самостоятельным заболеванием, а проявлением гиперпаратиреоза, обусловленного аденомой ОЩЖ.
В подтверждение сказанному приводим соответствующий клинический случай из практики.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка А., 65 лет, в июне 2022 г. обратилась за консультацией к врачу-ревматологу с жалобами на ноющие боли в коленных и тазобедренных суставах, преимущественно во второй половине дня, к вечеру, после физической нагрузки, временами в первой половине ночи; после пробуждения отмечает непродолжительную скованность в коленных суставах, их тугоподвижность. Пациентка также указывала на боли в костях при ходьбе, общую и мышечную слабость, вялость, повышенную утомляемость, полиурию и полидипсию, похудание на 12 кг за последний год, уменьшение в росте на 4 см за всю жизнь.
Из анамнеза заболевания: в июне 2020 г. у пациентки появились жалобы на боли в области лучезапястных и межфаланговых суставах обеих кистей с их незначительным припуханием, утренней скованностью в течение получаса и затруднением сжатия кистей в кулак. Врачом-терапевтом по месту жительства ей был рекомендован двухнедельный прием нестероидных противовоспалительных препаратов (НПВП), в частности напроксена натрия 1100 мг/сут. Пациентка отметила лишь незначительное уменьшение интенсивности болей в мелких суставах кистей.
В августе 2020 г. у нее впервые развился острый артрит правого коленного сустава, который сопровождался его припуханием, локальными явлениями гипертермии и гиперемии кожи над пораженным суставом. Учитывая недостаточный эффект от приема НПВП, пациентке в полость правого коленного сустава введен раствор бетаметазона в объеме 1 мл, что позволило купировать симптомы артрита. Эффект последействия препарата сохранялся на протяжении 4 нед, по истечении которых пациентка вновь стала обращать внимание на усилившиеся боли в лучезапястных, межфаланговых суставах кистей, а также в коленных суставах.
В сентябре 2020 г. наблюдался рецидив артрита правого коленного сустава, в связи с чем пациентка была направлена на консультацию к врачу-ревматологу в поликлинику по месту жительства. Принимая во внимание симметричное поражение мелких суставов кистей с их небольшим припуханием и утренней скованностью, недостаточную эффективность НПВП, врачи сосредоточились на исключении дебюта РА.
При объективном осмотре у пациентки были выявлены деформации дистальных межфаланговых суставов 2–3 пальцев кистей с формированием узелков Гебердена, вальгусная девиация первых плюснефаланговых суставов стоп, слабоположительный симптом поперечного бокового сжатия обеих кистей и стоп, сглаженность лучезапястных суставов, синовиты ряда проксимальных межфаланговых суставов кистей, дефигурация коленных суставов, больше выраженная справа, невозможность полного разгибания правой ноги в коленном суставе. Число болезненных при пальпации суставов составило 10, в том числе 8 мелких, число припухших суставов – 6.
Результаты лабораторного исследования: гемоглобин – 113 г/л; лейкоциты – 7,52×109/л; тромбоциты – 280×109/л; скорость оседания эритроцитов (СОЭ) по методу Вестергрена 43 мм/ч; С-реактивный белок (СРБ) – 24 мг/л; ревматоидный фактор (РФ) – 151 Ед/мл; антитела к циклическому цитруллинированному пептиду (АЦЦП) – 41,8 Ед/мл при верхней границе референсного диапазона (ВГРД) до 17 Ед/мл.
На рентгенограмме суставов кистей с захватом лучезапястных суставов обнаружены околосуставной остеопороз в головках пястных костей и основаниях проксимальных фаланг, сужение рентгеновской суставной щели, субхондральный остеосклероз, остеофиты на краях суставных поверхностей II–III дистальных межфаланговых суставов кистей, единичные мелкие кальцификаты в мягких тканях в области боковых краев сочленяющихся поверхностей костей.
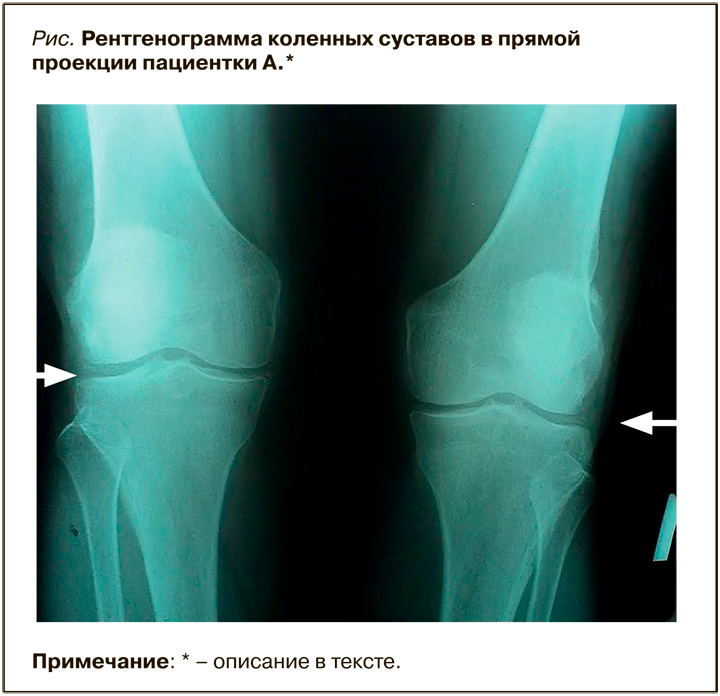
На рентгенограмме коленных суставов в прямой проекции в области латеральной рентгеновской суставной щели с обеих сторон выявлена линейная кальцификация суставного хряща (хондрокальциноз), небольшое сужение суставной щели, преимущественно в медиальных отделах, заострение межмыщелковых возвышений (рис.).
При ультразвуковом исследовании (УЗИ) коленных суставов был обнаружен двусторонний синовит.
У пациентки был диагностирован дебют РА, серопозитивного по РФ, АЦЦП, высокой активности (индекс DAS28 5,68), неэрозивный артрит (II рентгенологической стадии по Штейнброкеру). В качестве сопутствующего диагноза была поставлена генерализованная форма первичного остеоартрита.
В качестве базисного противовоспалительного препарата пациентке был назначен метотрексат, с учетом высокой степени активности заболевания проводилось парентеральное введение этого препарата с эскалацией дозы с 10 до 15 мг/нед. Последующие попытки наращивания дозировки метотрексата сопровождались рецидивирующей герпетической инфекцией. Ввиду предшествующей неэффективности НПВП был назначен преднизолон 10 мг/сут. На фоне проводимого лечения больная отметила улучшение состояния – купирование болей в периферических суставах. В последующем она продолжала получать комбинированную терапию метотрексатом и преднизолоном, рецидива артритов не наблюдалось.
Однако в начале 2021 г. у пациентки появились повышенная утомляемость, общая слабость, снижение концентрации внимания, ухудшение памяти, нарушение сна, подавленное настроение, эпизодическое проявление инсипидарного синдрома (полидипсия, полиурия в отсутствие гипергликемии), отсутствие аппетита. Больная уменьшилась в росте за полгода на 2 см. Участковый врач-терапевт связал эти клинические проявления с побочными действиями приема преднизолона, вследствие чего было принято решение постепенного снижения дозы препарата вплоть до его полной отмены. В августе 2021 г. пациентка прекратила применение преднизолона.
За последний год пациентка похудела на 12 кг, что вызвало у врача-терапевта по месту жительства онкологическую настороженность. При выполнении эзофагогастродуоденоскопии были обнаружены эндоскопические признаки эрозивного гастрита, а также рубцовая деформация луковицы двенадцатиперстной кишки, а при выполнении УЗИ почек – нефролитиаз. Онкопатология была исключена.
После отмены преднизолона и снижения дозы метотрексата до 10 мг/нед из-за рецидивирующей герпетической инфекции у пациентки усилились боли в периферических суставах, дважды отмечались синовиты коленных суставов. В связи с этим неоднократно проводились курсы терапии НПВП, в частности селективными ингибиторами циклооксигеназы-2 под прикрытием ингибиторов протонной помпы. Больная стала предъявлять жалобы на боли в коленных и тазобедренных суставах механического характера (во второй половине дня, после физической нагрузки, в первой половине ночи), временами боли в коленных суставах носили «стартовый» характер. В анализах крови сохранялось незначительное повышение СОЭ до 29 мм/ч и СРБ до 8,1 мг/л. Не претерпели обратного развития проявления миопатии, инсипидарного синдрома и нейрокогнитивные расстройства, не наблюдалось прибавки в массе тела.
С вышеперечисленными жалобами пациентка была отправлена на консультацию к врачу – травматологу-ортопеду Федерального центра травматологии, ортопедии и эндопротезирования (г. Чебоксары). Поскольку были выявлены только рентгенологические признаки остеоартроза коленных и тазобедренных суставов, соответствующие его II стадии (по классификации Келлгрена–Лоуренса), хондрокальциноз на рентгенограмме коленных суставов, а также клинические проявления хронического симметричного артрита с реакцией со стороны острофазовых белков и иммунологическими нарушениями, пациентке было рекомендовано обратиться за консультацией к врачу-ревматологу.
При проведении объективного осмотра врачом-ревматологом у пациентки отмечены узелковая деформация ряда дистальных, проксимальных межфаланговых суставов кистей и вальгусная девиация первых плюснефаланговых суставов стоп, комбинированное плоскостопие. Симптом поперечного бокового сжатия кистей и стоп был отрицательным с обеих сторон. Болезненность при пальпации и ограничение активных движений в области периферических суставов не выявлялась, за исключением болезненности при пальпации в проекции суставной щели коленных суставов с медиальной стороны. Окружность правого коленного сустава составила 34 см, левого – 33 см. При пассивных движениях в коленных суставах отмечалась крепитация.
При повторной оценке иммунологических показателей уровни РФ и АЦЦП в крови составили 42,7 Ед/мл (при ВГРД до 14 Ед/мл) и 10 Ед/мл (при ВГРД до 17 Ед/мл) соответственно.
В биохимическом анализе крови: общий билирубин –12 мкмоль/л; аланинаминотрансфераза (АЛТ) –21 Ед/л; аспартатаминотрансфераза (АСТ) –18 Ед/л; щелочная фосфатаза – 325,9 Ед/л (при ВГРД до 258 Ед/л); креатинин – 109 мкмоль/л; общий белок – 72,6 г/л; альбумин – 39,9 г/л; глюкоза – 4,5 ммоль/л; общий холестерин – 5,9 ммоль/л; мочевая кислота – 436 мкмоль/л; общий кальций – 3,23 ммоль/л (за 3 нед до этого – 2,81 ммоль/л); фосфор – 0,93 ммоль/л (при нижней границе нормы от 0,9 ммоль/л). Расчетная скорость клубочковой фильтрации (СКФ) равнялась 53 мл/мин/1,73 м2. При проведении электрофореза белков крови данных за патологический (моноклоновый) белок не получено. Протеинурия в общем анализе мочи не наблюдалась.
При оценке ранее выполненных биохимических анализов крови оказалось, что впервые гиперкальциемия (2,78 ммоль/л при верхней границе нормы до 2,57 ммоль/л) была выявлена у пациентки еще в августе 2020 г., но на нее тогда не обратили внимания.
Исходя из особенностей клинической картины и персистирующей гиперкальциемии, было проведено дополнительное лабораторно-инструментальное исследование для исключения гиперпаратиреоза. При исследовании было выявлено восьмикратное повышение уровня ПТГ в сыворотке крови (519,9 пг/мл при ВГРД до 65 пг/мл), обнаружен выраженный дефицит витамина D (сывороточный уровень 25-гидроксихолекальциферола – 7,93 нг/ мл). При УЗИ ОЩЖ слева лоцировалось гипоэхогенное образование размерами 36×33×24 мм, отделенное от вышележащей гиперэхогенной ткани щитовидной железы.
В условиях Республиканского клинического онкологического диспансера пациентке была выполнена сцинтиграфия ОЩЖ (однофотонная эмиссионная компьютерная томография в сочетании с многослойной компьютерной томографией), по результатам которой обнаружилось метаболически активное образование позади и ниже заднего контура нижней трети левой доли щитовидной железы с ровными четкими контурами размерами 34×22×30 мм, медиально примыкающее к трахее и пищеводу на уровне тела первого грудного позвонка, латерально прилежащее к сосудистым структурам.
По данным двухэнергетической рентгеновской абсорбциометрии был подтвержден остеопороз в поясничном отделе позвоночника (минеральная плотность кости (МПК) в L2–L4 позвонках равнялась «-2,7» стандартных отклонений (СО) по Т-критерию) и лучевой кости (МПК в точке 33% длины лучевой кости – «-3,7» СО по Т-критерию). МПК в шейке бедра составила «-2,2» СО по Т-критерию. На рентгенограмме нижнегрудного и поясничного отдела позвоночника, выполненной в боковой проекции, был выявлен компрессионный перелом тела первого поясничного позвонка.
Учитывая рентгенологический выявляемый хондрокальциноз, пациентке была выполнена диагностическая пункция правого коленного сустава. По данным поляризационной микроскопии в пунктате синовиальной жидкости были найдены кристаллы пирофосфата кальция.
Таким образом, у пациентки была обнаружена солитарная аденома левой нижней ОЩЖ, сопровождаемая избыточной секрецией ПТГ. Также был диагностирован хронический артрит, ассоциированный с отложением кристаллов ПФК, который, согласно современным представлениям, является одним из фенотипов соответствующей болезни [10].
Больная была проконсультирована врачом-эндокринологом, который, учитывая патогенетическую связь между гиперплазией (аденомой) ОЩЖ и дефицитом витамина D, установленным у пациентки, назначил ей c лечебной и в известной мере с диагностической целью активный метаболит витамина D альфакальцидол (1 мкг/ сут) под контролем показателей биохимического анализа крови (кальций общий и ионизированный, фосфор, щелочная фосфатаза, креатинин с расчетом СКФ 1 раз в месяц). В последующем в зависимости от природы гиперпаратиреоза (ПГПТ или ВГПТ) было запланировано определиться с дальнейшей лечебной тактикой в соответствии с рекомендуемыми в этих случаях методическими подходами [11].
ОБСУЖДЕНИЕ
Таким образом, в начале заболевания у пациентки имела место картина симметричного артрита с поражением мелких суставов кистей, который протекал с утренней скованностью, припухлостью суставов, затруднением сжатия кистей в кулак, недостаточной эффективностью НПВП; все это могло соответствовать клиническим проявлениям дебюта РА в пожилом возрасте. О вероятном РА свидетельствовали также иммунологические маркеры, выражавшиеся в повышение значений РФ и АЦЦП. Однако при этом обращало на себя внимание то, что у пациентки клиника симметричного полиартрита с поражением мелких суставов кистей сопровождалась эпизодами острого артрита правого коленного сустава (в последующем и левого). Подобные клинические проявления у пожилого человека должны ориентировать врача на исключение кристаллического артрита и, в частности, болезни депонирования кристаллов ПФК. Вероятность этой патологии возрастает при наличии такого рентгенологического синдрома, как хондрокальциноз, наблюдавшегося у нашей пациентки. Обнаружение кристаллов ПФК при поляризационной микроскопии пунктата синовиальной жидкости правого коленного сустава позволило окончательно удостовериться в правомочности этого диагноза у нашей больной. В конкретном случае диагноз болезни депонирования кристаллов ПФК в полной мере соответствовал классификационным критериям заболевания, предложенным McCarty D.J. в 1966 г. [21].
Как и полагается, в случае верификации болезни депонирования кристаллов ПФК необходимо было выявить вероятные факторы риска и сопутствующие метаболические заболевания, такие как остеоартрит, предшествующие травмы суставов, гипомагниемия, гипофосфатазия, гемохроматоз, гиперкальциемия, а также часто ассоциированный с этой болезнью гиперпаратиреоз, что и было сделано. В результате в качестве наиболее вероятной причины болезни депонирования кристаллов ПФК у нашей пациентки мы вправе рассматривать гиперпаратиреоз.
На тесную связь между гиперпаратиреозом (в частности, ПГПТ), хондрокальцинозом и болезнью депонирования кристаллов ПФК указывают многие авторы [5, 7, 13, 14]. Есть предположение, что ассоциация между ПГПТ и кальцификацией хряща обусловлена стойко персистирующей гиперкальциемией, повреждением хрящевой ткани, предрасполагающей к кальцификации суставного хряща. Считается, что повышенный сывороточный уровень кальция может приводить к снижению синтеза протеогликанов, которые, в свою очередь, способствуют ингибированию кристаллизации ПФК [14, 15]. В исследовании Rachow J.W. и Ryan L.M. было выявлено повышение активности фермента аденозинтрифосфатпирофосфогидролазы в синовиальной жидкости у пациентов с хондрокальцинозом, вызывающее повышение концентрации пирофосфата и, как следствие, депонирование кристаллов ПФК в хрящевой ткани [16].
Развитие болезни депонирования кристаллов ПФК чаще описывают у пациентов либо с ранее диагностированным ПГПТ, либо как дебют заболевания после паратиреоидэктомии на фоне резкого снижения содержания кальция в сыворотке крови [17, 18]. М.С. Елисеев с соавт. описали клиническое наблюдение пациента 67 лет с достоверным диагнозом болезни депонирования кристаллов ПФК, у которого развитие хондрокальциноза предшествовало дебюту ПГПТ [19]. В приведенном нами клиническом случае обнаружение хондрокальциноза на рентгенограмме и гиперкальциемия совпали по времени, что может быть косвенным свидетельством патогенетической связи между этими отклонениями. Принимая во внимание наличие у пациентки функционально активной аденомы ОЩЖ с сопутствующим повышением уровня кальция крови, с высокой долей вероятности можно предположить, что болезнь депонирования кристаллов ПФК в данном случае стала следствием гиперпаратиреоза. Вместе с тем природа самого гиперпаратиреоза (первичный или вторичный), как было указано нами, требует дальнейшего уточнения.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай со всей очевидностью демонстрирует сложность диагностики гиперпаратиреоза, манифестация которого способна, как известно, протекать под клиническими «масками» многочисленных заболеваний, в том числе ревматологического спектра. В нашем клиническом наблюдении показано, как пациентке с суставным синдромом последовательно и, казалось бы, вполне обоснованно в качестве основного сначала был выставлен диагноз РА, затем болезнь депонирования кристаллов ПФК, в результате же оказалось, что наиболее очевидной причиной всех клинических проявлений был гиперпаратиреоз вследствие развития аденомы ОЩЖ. Поздняя диагностика гиперпартиреоза в анализируемом случае, на наш взгляд, стала следствием недостаточной осведомленности врачей об этой патологии и ее клинических проявлениях, а также недооценки важности определения и учета концентрации кальция в крови при суставной патологии. В частности, в анализируемом случае не было уделено должного внимания гиперкальцемии, впервые зафиксированной задолго до диагностики аденомы ОЩЖ.



