Саркоидоз – системное воспалительное заболевание неизвестной этиологии, характеризующееся образованием неказеифицирующихся гранулем, мультисистемным поражением различных органов и активацией Т-клеток в месте гранулематозного воспаления с высвобождением различных хемокинов и цитокинов, включая фактор некроза опухоли альфа (ФНО-альфа). В 2019 г. проект клинических рекомендаций по диагностике и лечению этого заболевания, разработанный группой экспертов пульмонологов, терапевтов, педиатров, бронхологов, рентгенологов и морфологов, был одобрен тремя научными сообществами России: Российским респираторным обществом, Общероссийским педиатрическим респираторным обществом и Российским научным медицинским обществом терапевтов [1]. Цель этой публикации – представить ключевые положения этих рекомендаций, которые важны для врачей-терапевтов.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Точные причины возникновения саркоидоза неизвестны. Решающую роль в развитии заболевания играет воздействие факторов окружающей среды на генетически предрасположенный организм. Установлено, что имеется генетическая предрасположенность к развитию саркоидоза, связанная с генами, отвечающими за иммунный ответ. Вероятными триггерами развития саркоидоза у лиц с генетической предрасположенностью считаются микобактерии туберкулеза с измененными свойствами (ревертанты), которые при этом не вызывают развитие туберкулеза, пропионовокислые бактерии (Propionibacterium acnes, Propionibacterium granulosum) и возбудитель Лаймской болезни Borrelia burgdorferi.
Фактором развития саркоидной реакции или саркоидоза может быть применение интерферонов и индукторов интерфероногенеза, которые используются при лечении вирусного гепатита С, рассеянного склероза, опухолевых заболеваний, а в России и для лечения простудных и вирусных респираторных заболеваний. Также при наличии генетической предрасположенности саркоидоз может развиться при установке имплантов, после нанесения татуировок. При саркоидозе наблюдается возникновение иммунологического парадокса: признаки локального воспаления с участием Т-хелперов 1-го типа, сосуществуют с периферической анергией, индуцированной Т-регуляторными клетками. Отличительной чертой активного саркоидоза является преобладающая экспрессия интерферона-гамма в пораженных органах при участии таких активных цитокинов, как интерлейкин-2 (IL-2), IL-12 и ФНО-альфа. В типичных случаях формируются компактные неказеифирующиеся эпителиоидно-клеточные гранулемы, которые стерильны и располагаются в легких преимущественно по ходу путей лимфооттока.
ЭПИДЕМИОЛОГИЯ И КЛАССИФИКАЦИЯ
Саркоидоз встречается во всем мире, поражает представителей обоего пола, всех рас и возрастов. Пик заболеваемости у мужчин приходится на возраст 20–30 лет, у женщин же существуют два пика: первый – в 20–30 лет, второй – после 50 лет. В последние три десятилетия повсеместно отмечен рост распространенности этого гранулематоза. Среди детей саркоидоз встречается редко. С частотой от 3 до 9% заболевание носит семейный характер, что подтверждает значимость генетической предрасположенности.
Согласно действующей Международной классификации болезней, саркоидоз имеет код D86 и относится к болезням крови, кроветворных органов и отдельным нарушениям, вовлекающим иммунный механизм:
D86 – саркоидоз:
- D86.0 – саркоидоз легких;
- D86.1 – саркоидоз лимфатических узлов;
- D86.2 – саркоидоз легких с саркоидозом лимфатических узлов;
- D86.3 – саркоидоз кожи;
- D86.8 – саркоидоз других уточненных и комбинированных локализаций:
- иридоциклит при саркоидозе +(H22.1);
- множественные параличи черепных нервов при саркоидозе +(G53.2);
- саркоидозная(ый): атропатия +(M14.8), миокардит +(I41.8), миозит +(M63.3);
- D86.9 – саркоидоз неуточненный.
В мировой практике также признана лучевая классификация внутригрудного саркоидоза (табл. 1).

Фенотипы (особенные варианты течения) саркоидоза отражены в таблице 2.

Постановка диагноза проводится следующим образом:
- Указывается локализация (перечисляют органы и системы, поражение которых было диагностировано в процессе обследования). При легочной локализации указывают лучевую стадию 0–IV.
- Активность: 0 степень (неактивный) – бессимптомное течение, отсутствие лабораторных признаков воспаления; 1 степень (активный) – наличие клинико-лабораторных признаков воспаления, при наличии полной клинической картины вместо активности могут быть указаны «синдром Лефгрена» или «синдром Хеерфордта–Вальденстрема».
- Течение: стабильное, прогрессирующее, регрессирующее, обострение, рецидив.
- Осложнения: функциональная недостаточность (указывается пораженный орган) и/или стойкие структурные изменения (фиброз, кальцинация, кисты и т.п.) [34].
ДИАГНОСТИКА
Диагностика саркоидоза зависит от начальных проявлений заболевания. Наиболее часто (до 50%) он является случайной находкой у бессимптомного больного при проведении профилактического лучевого обследования. Характерными синдромами являются увеличение внутригрудных лимфатических узлов, легочная диссеминация или их сочетание. В этой ситуации наиболее актуальна дифференциальная диагностика с онкологической патологией (центральные опухоли, лимфогранулематоз) и туберкулезом внутригрудных лимфатических узлов и легких. Детализацию синдрома дает рентгеновская компьютерная томография высокого разрешения, проведения кожной пробы Манту или Диаскин-тест. Окончательный диагноз поможет установить биопсия – трансбронхиальная или при видеоторакоскопии.
У лиц старшего возраста саркоидоз может проявляться одышкой, и диагностический путь увеличивается, если сразу не проведены лучевое обследование, спирометрия и оценка диффузионной способности. Долгое время при дифференциальной диагностике саркоидоза обычной практикой считалось проведение пробной противотуберкулезной терапии в течение 3–6 мес. В настоящее время к терапии ex juvantibus необходимы веские основания, такие как положительный Диаскин-тест, отягощенный эпидемиологический анамнез и др.
При острых формах саркоидоза диагностический путь может быть не быстрым. Первым признаком острой формы саркоидоза может выступать боль и опухание суставов, и терапевт и ревматолог идут по пути дифференциальной диагностики суставного синдрома. Присоединение узловатой эритемы может только закрепить уверенность в ревматологическом диагнозе. В этой ситуации крайне важно сделать обычную рентгенограмму, чтобы распознать синдром Лефгрена – вариант острого течения саркоидоза, проявляющийся внутригрудной лимфаденопатией, узловатой эритемой, суставным синдромом и лихорадкой. На пути к этому диагнозу пациенту нередко проводят исследования сосудов нижних конечностей или исключают рожистое воспаление.
Синдром Хеерфордта–Вальденстрема – другой вариант острого течения саркоидоза, проявляющийся увеитом, паротитом, лихорадкой и параличом лицевого нерва (паралич Белла – факультативный симптом). В ходе обследования пациента с предполагаемым саркоидозом следует обязательно осмотреть его кожные покровы, особенно если у него есть шрамы или татуировки, в области которых могут быть проявления саркоидоза кожи. Выявление кожных или подкожных изменений может позволить избежать других инвазивных вмешательств для взятия биоптата. Среди значимых для дифференциальной диагностики саркоидоза жалоб наиболее значимой является беспричинная слабость, усталость уже в начале рабочего дня, снижение работоспособности без видимых на первый взгляд причин.
Клинические проявления саркоидоза очень многообразны, поскольку он способен поражать все органы и системы. Если наиболее частым для России проявлением саркоидоза выступает поражение органов дыхания, то, к примеру, в Японии очень распространен кардиосаркоидоз, который сопровождается угрожающими жизни нарушениями ритма и проводимости сердца. Для чернокожих жителей США (афроамериканцев) характерно тяжелое поражение кожи – ознобленная волчанка (lupus pernio), которая обезображивает лицо и часто является признаком хронического, трудно поддающегося лечению саркоидоза.
Саркоидоз периферических лимфатических узлов, доступных пальпации, встречается в 10–25% случаев. Чаще в процесс вовлечены задние и передние шейные лимфатические узлы, надключичные, локтевые, подмышечные и паховые. Лимфатические узлы плотно-эластической консистенции, не размягчаются и не образуют свищей. Биопсия такого лимфатического узла также может быть высокоинформативной.
Увеличение селезенки встречается при саркоидозе часто, но клинически значимые поражения этого органа с гиперспленией встречаются редко.
Поражение органа зрения относят к неблагоприятным проявлениям саркоидоза, поэтому консультация офтальмолога и осмотр глазного дна (исключение увеита) служат важными этапами обследования больного.
Нейросаркоидоз встречается в 5–10% случаев. Выделяют следующие его клинические проявления: поражение черепных нервов, поражение оболочек головного мозга, нарушения функции гипоталамуса, поражения ткани головного и спинного мозга, судорожный синдром, периферическая нейропатия, миопатия.
Для саркоидоза не существует облигатных лабораторных признаков. Они долгое время могут быть в пределах нормы. В пользу саркоидоза говорят моноцитоз и лимфопения, повышение уровня кальция в крови и особенно в суточной моче.
К критериям активности саркоидоза относят определение уровня ангиотензинпревращающего фермента (АПФ).
Методы получения биопсийного материала определяются индивидуально в каждом клиническом случае. Во всех случаях подозрения на саркоидоз и при наличии согласия пациента следует проводить биопсию. Если преобладает увеличение внутригрудных лимфатических узлов, то проводят трансбронхиальную биопсию, лучше под контролем ультразвуковой картины. Если преобладает поражение легких, то выбирают биопсию во время видеоторакоскопии. Открытая биопсия легких проводится в исключительных случаях. Среди доступных методов следует рассматривать биопсию кожи и подкожных образований, слизистых оболочек, периферических лимфатических узлов. Кроме того, проводят биопсию тканей сердца, кроветворной системы и других локализаций.
Важно понимать, что выявление эпителиоидно-клеточной неказеифицирующейся гранулемы в сочетании с гигантскими клетками Пирогова–Лангханса не является критерием окончательного диагноза, а только сужает диагностический поиск, проводимый лечащим врачом. Наличие некроза в гранулеме не исключает саркоидоза. При выявлении «гранулематозного воспаления саркоидного типа» следует помнить о возможности развития саркоидной реакции – образования в различных органах и тканях локализованных групп эпителиоидно-клеточных неказеифицирующихся гранулем саркоидного типа в ответ на инородные тела (экзогенные факторы) различного происхождения (например, импланты, татуировки), при применении препаратов интерферона, а также перифокально при злокачественных опухолях, паразитарных заболеваниях. Саркоидная реакция отличается от саркоидоза локальным поражением.
Постановка окончательного диагноза является результатом сопоставления клинических, лучевых, морфологических, функциональных, бактериологических, иммунологических и лабораторных данных, поскольку до настоящего времени какого-либо специфичного метода диагностики саркоидоза не установлено.
ЛЕЧЕНИЕ
Лечение саркоидоза – сложный тактический вопрос, поскольку причина заболевания точно неизвестна, а доказательная база фармакотерапии крайне слаба. Целью его лечения служит преду-преждение или уменьшение повреждения, облегчение симптомов и улучшение качества жизни больных.
Этиотропной терапии саркоидоза не существует. Во всех случаях основная тактика врача – сопоставление необходимости назначения лечения с тяжестью последствий от современной кортикостероидной, цитостатической или биологической («таргетной») терапии.
 Существует две причины для начала активной терапии саркоидоза – угроза развития недостаточности органов и систем, угроза жизни или потеря качества жизни. Все существующие схемы являются рекомендательными, и в каждом случае лечащий врач берет на себя ответственность за назначенное лечение. При морфологически верифицированном диагнозе саркоидоза, отсутствии угрожающего жизни состояния, снижения функций органов и систем, очевидных данных в пользу быстрого прогрессирования заболевания предпочтительно активное наблюдение.
Существует две причины для начала активной терапии саркоидоза – угроза развития недостаточности органов и систем, угроза жизни или потеря качества жизни. Все существующие схемы являются рекомендательными, и в каждом случае лечащий врач берет на себя ответственность за назначенное лечение. При морфологически верифицированном диагнозе саркоидоза, отсутствии угрожающего жизни состояния, снижения функций органов и систем, очевидных данных в пользу быстрого прогрессирования заболевания предпочтительно активное наблюдение.
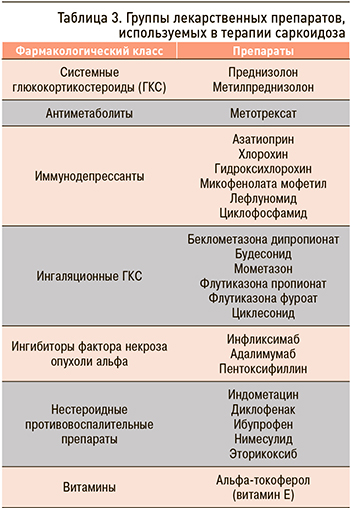
Накопленный опыт реальной практики, мнения экспертов и небольшое количество контролируемых клинических исследований позволяют свести в один перечень препаратов, используемых в лечении саркоидоза (табл. 3).
Наблюдение и лечение саркоидоза лучше проводить в многопрофильном учреждении, обладающем хорошей диагностической базой, согласно действующим клиническим рекомендациям у специалистов, имеющих опыт работы с этим гранулематозом.
Поскольку частота спонтанных ремиссий высока, бессимптомным больным с первой лучевой стадией саркоидоза лечение не показано. Альтернативной является применение альфа-токоферола по 200 мг 2 раза/сут не менее 6 мес. Риск нежелательных явлений при этом низкий.
Тактика активного наблюдения показана также бессимптомным больным с саркоидозом II и III лучевой стадий при отсутствии или легких нарушениях функции дыхания и стабильном состоянии. Альтернативой служит прием альфа-токоферола по 200 мг 2 раза/сут и/или пентоксифиллина в суточной дозе 300–1200 мг не менее 6 мес. Риск нежелательных реакций на пентоксифиллин средний.
Системные глюкокортикостероиды (ГКС) пока остаются препаратами первой линии, но показания к их назначению строго ограничены. Они показаны только больным с прогрессирующим течением болезни любой локализации по данным клинического, рентгенологического, лабораторного и функционального исследования, при выраженных симптомах или значимых внелегочных проявлениях, нарушающих функцию органа, или развитии lupus pernio. Риск нежелательных явлений при этом высокий.
Преднизолон (или эквивалентную дозу другого ГКС) назначают ежедневно утром per os в начальной дозе 25–30 мг/сут на 4 нед, затем дозу снижают до 5 мг в месяц ступенчато до поддерживающей дозировки в 10 мг для контроля над симптомами и прогрессированием болезни и продолжают 12–24 мес.
Через 3 мес от начала лечения необходимо оценить эффект ГКС, поскольку возможна рефрактерность к препаратам этой группы. Если эффекта нет, переходят на альтернативную терапию.
У больных, получавших системные ГКС и закончивших их прием, чаще развиваются обострения (30–80%), чем у тех, кто не получал гормональную терапию. У бессимптомных пациентов при применении системных ГКС развивающиеся нежелательные явления могут в большей степени нарушать качество жизни пациента, чем проявления саркоидоза. Речь о повышении артериального давления и уровня сахара в крови, увеличении массы тела, остеопорозе, развитии надпочечниковой недостаточности, глаукомы и катаракты, повышения свертываемости крови, изменениях кожи и др. Нет убедительных данных, доказывающих, что применение системных ГКС улучшает отдаленный прогноз жизни больных саркоидозом.
Пульс-терапия системными ГКС проводится в исключительных случаях (прогрессирование при полиорганном поражении, рефрактерность к обычным дозам ГКС и/или другим препаратам) в дозе преднизолона 15 мг/кг массы тела внутривенно (800–1000–1200 мг на введение) всего трехкратно ежедневно или через день. Применение депо-препаратов системных ГКС не рекомендовано.
Ингаляционные ГКС назначают только пациентам с выраженным кашлем и бронхиальной гиперреактивностью. Сочетание ингаляционных ГКС и бронхолитиков применяется только при доказанном спирограммой бронхообструктивном синдроме.
Метотрексат внутрь или подкожно назначают 1 раз в неделю в дозе 10–15 мг как препарат второй линии при рефрактерности к системным ГКС, при побочных реакциях, вызванных системными ГКС, как средство снижения дозы гормональных средств и как препарат первой линии при наличии противопоказаний к последним. В период лечения назначают фолиевую кислоты в дозе 5 мг 1 раз в неделю или 1 мг ежедневно (не ранее чем через 24 ч после приема метотрексата). Длительность терапии от 6 мес и более.
До начала лечения метотрексатом проводят исследования крови: активность АлАТ, АсАТ, уровень креатинина, полный клинический анализ крови; спирометрия; серологические исследования на ВИЧ, гепатиты B, C, кожные туберкулиновые пробы, при возможности тест QuantiFERON на наличие микобактериальной инфекции.
В ходе лечения каждые 1–3 мес повторяют клинический анализ крови, оценку АлАТ и АсАТ. Применение метотрексата сопровождается рисками развития гепатотоксичности, интерстициальных изменений в легких, лейкопении, инфекций. Препарат тератогенен, при беременности противопоказан. Учитывая возможность токсического воздействия метотрексата на легочную ткань, целесообразно исследование DLco на фоне лечения.
Азатиоприн используется в качестве препарата второй линии в дозе 100–200 мг/сут. Для достижения клинического эффекта лечение проводится не менее 6 мес. Препарат более токсичен, чем метотрексат, но при непереносимости метотрексата и противопоказаниях к его применению азатиоприн служит альтернативой. При кардиосаркоидозе азатиоприн эффективен в сочетании с ГКС. Нежелательные реакции при его применении проявляются гепатотоксичностью, лейкопенией, развитием инфекций, повышением риска развития лимфомы и лейкемии.
Лефлуномид – препарат второй линии, разработанный для лечения ревматоидного артрита, с меньшей токсичностью, чем метотрексат и азатио-прин, но с более слабой доказательной базой. Он применяется в дозе 10–20 мг/сут, эффект наступает не ранее 3 мес от начала приема. Лефлуномид обладает тератогенностью. Полный клинический анализ крови, оценка функции печени и почек должны быть проведены до начала лечения этим препаратом и каждые 1–3 мес лечения.
Микофенолата мофетил разработан как иммунодепрессант при трансплантации органов, доказательства эффективности этого средства при саркоидозе ограничены сериями случаев. Препарат назначают, начиная с 500 мг 2 раза/сут, и затем увеличивают дозу до 750–1000 мг 2 раза/сут. Микофенолат у каждого пятого больного может вызывать тошноту, диарею, лейкопению, повышение риска инфекций. Пока пациент находится на стабильной дозе, полный клинический анализ крови должен проводиться регулярно
Циклофосфамид применяется редко, преимущественно при полиорганном поражении и рефрактерности к другим препаратам. Среди всех иммуносупрессивных средств именно его применение при саркоидозе наиболее часто сопровождается развитием инфекционных осложнений.
Хлорохин и гидроксихлорохин – препараты 4-аминохинолинового ряда, разработанные для лечения малярии. Они ограниченно показаны только при хронических, рефрактерных к ГКС случаях саркоидоза, особенно при саркоидозе кожи, глаз и гиперкальциемии. Лечение хлорохином начинают с 750 мг/сут в течение 6 мес, затем дозу снижают до 250 мг/сут. Применение гидроксихлорохина начинают с дозы в 400 мг, которая может быть снижена до 200 мг/сут. Курс лечения составляет 6–12 мес.
Хлорохин более токсичен, чем гидроксихлорохин. При легочном саркоидозе эти препараты не рекомендуются в качестве стартовой терапии ввиду развития нежелательных реакций со стороны органа зрения (ретинопатия).
Пентоксифиллин – ингибитор фосфодиэстеразы-4 с активностью ингибитора фактора некроза опухоли альфа – применяется при саркоидозе более 20 лет. Стероидзамещающий эффект пентоксифиллина при монотерапии проявляется в дозе 1200–2000 мг/сут. При стартовой терапии препарат назначают по 600–1200 мг/сут, в том числе совместно с альфа-токоферолом. Нежелательные явления в виде расстройств со стороны желудочно-кишечного тракта, слабости, головной боли, нарушении сна носят нетяжелый, иногда преходящий характер, развиваются в первый месяц применения пентоксифиллина.
Нестероидные противовоспалительные препараты показаны только при острых формах саркоидоза и/или артритах, при выраженном болевом синдроме в качестве симптоматических средств. Длительность приема средств этой группы точно не определена.
Альфа-токоферол (витамин Е) применяется на ранних стадиях саркоидоза в качестве антиоксиданта в виде монотерапии по 200–400 мг/сут в виде монотерапии или совместно с пентоксифиллином (длительно).
Ингибиторы фактора некроза опухоли-альфа (ФНО-α) считаются препаратами третьей линии. Наибольшую доказательную базу имеет инфликсимаб в виде внутривенных инфузий, которые начинают с 3–5 мг/кг, с нагрузочными дозами на 0, 2 и 6 нед, после которых пациенты получают инфузию каждые 4–8 нед. Большинство экспертов рекомендует интервал дозирования от 4 до 6 нед.
Адалимумаб рекомендован в дозе 40 мг в неделю. Не все ингибиторы ФНО-α эффективны при саркоидозе, кроме того, они сами способны вызывать саркоидную реакцию.
ЗАКЛЮЧЕНИЕ
Современные клинические рекомендации по саркоидозу представляют собой консенсус трех научных медицинских обществ России и дают основные опорные точки для практических врачей в диагностике и лечении этого гранулематоза.



