Миокардит представляет собой полиэтиологическое заболевание, причиной которого могут быть вирусные и бактериальные агенты, а также неинфекционные факторы. Согласно статистическим данным, более чем в 50% случаев развитие миокардита обусловлено вирусами, среди которых особой кардиотропностью обладают парвовирусы В19, энтеровирусы Коксаки А и В, ЕСНО-вирусы, вирус краснухи, аденовирусы, вирус герпеса человека типа 6, вирус Эпштейна–Барр, цитомегаловирус, вирус гриппа и др.
Клиническая картина миокардитов разнообразна и неспецифична, а их диагностика в общеврачебной практике базируется на триаде анамнестических данных: острое начало заболевания, связь дебюта/обострений аритмии с инфекцией, давность менее года. Дополнительными критериями служат системные иммунные проявления, тонзиллиты и герпес, сочетание нарушений̆ ритма и проводимости, эффект от стероидной терапии в анамнезе [1, 2].
Миокардит нередко манифестирует нарушениями ритма сердца с явлениями прогрессирующей сердечной недостаточности и внезапной сердечной смертью, которые могут возникнуть на любом этапе заболевания [3].
Основной задачей данного клинического наблюдения является привлечение внимания врачей общей практики, врачей-терапевтов и других специалистов догоспитального этапа к пациентам молодого возраста с впервые возникшими синкопальными состояниями и нарушениями ритма сердца, что позволит своевременно заподозрить миокардит и направить пациента в лечебное учреждение для оказания специализированной медицинской помощи.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка В., 30 лет, поступила в кардиологическое отделение городской клинической больницы (ГКБ) № 13 в феврале 2018 г. с жалобами на одышку при физической нагрузке, сердцебиение, утомляемость и неоднократные обморочные состояния в течение последнего года.
Впервые одышка при физической нагрузке и сердцебиение появились 8 мес назад после родоразрешения методом кесарева сечения. После физического и эмоционального перенапряжения отмечала эпизоды синкопальных состояний, но за медицинской помощью не обращалась, самостоятельно лечилась метопрололом для «профилактики сердцебиения» с незначительным положительным эффектом. В феврале 2018 г. сердцебиение усилилось, появились эпизоды урежения пульса до 30–40 уд./мин и потери сознания, что заставило пациентку обратиться за помощью к терапевту поликлиники. Учитывая урежение пульса и появление обморочных состояний, пациентке была экстренно проведена ЭКГ-диагностика. По результатам исследования: частота сердечных сокращений (ЧСС) 34–38 уд./мин, продолжительность интервалов PQ 0,12 c, QRS 0,10 c, QT 0,52 c. Вольтаж нормальный. Заключение: положение ЭОС-ось S1, S2, S3. Ритм эктопический предсердный, брадикардия (рис. 1).

В связи нарастанием жалоб и изменений на ЭКГ пациентка была госпитализирована в кардиологическое отделение ГКБ для обследования и лечения.
 Анамнез жизни: пациентка имеет высшее медицинское образование, врач-реаниматолог, ведет активный образ жизни, двое родов методом кесарева сечения. Вредных привычек нет, сердечно-сосудистый семейный анамнез не отягощен. В декабре 2017 г. перенесла ОРВИ с подъемом температуры до 37,7 °C, к врачу за помощью не обращалась.
Анамнез жизни: пациентка имеет высшее медицинское образование, врач-реаниматолог, ведет активный образ жизни, двое родов методом кесарева сечения. Вредных привычек нет, сердечно-сосудистый семейный анамнез не отягощен. В декабре 2017 г. перенесла ОРВИ с подъемом температуры до 37,7 °C, к врачу за помощью не обращалась.
При поступлении в стационар состояние средней тяжести, обусловленное выраженной одышкой при нагрузке и сердцебиением. Кожные покровы и видимые слизистые чистые, нормальной влажности, обычной окраски. Пастозность голеней. Дыхание в легких везикулярное, проводится во все отделы, хрипы не выслушиваются, частота дыхания 18/ мин. Тоны сердца умеренно приглушенные, ритм правильный, ЧСС 52 уд./мин, артериальное давление (АД) сидя в покое 120/80 мм рт.ст. Живот при пальпации мягкий, безболезненный. Печень пальпируется по правому краю реберной дуги. Размеры по Курлову 9×8×7 см. Край при пальпации заострен, безболезненный. Перистальтика сохранена. Мочеиспускание свободное.
В клиническом анализе крови в период госпитализации отклонений от нормы не было. В биохимическом анализе крови отмечалось повышение уровней креатинфософокиназы (КФК), креатинфософокиназы-МБ (КФК-МВ), АСТ, АЛТ, лактатдегидрогеназы (ЛДГ), миоглобина. Данные иммунологического исследования представлены в таблице 1.
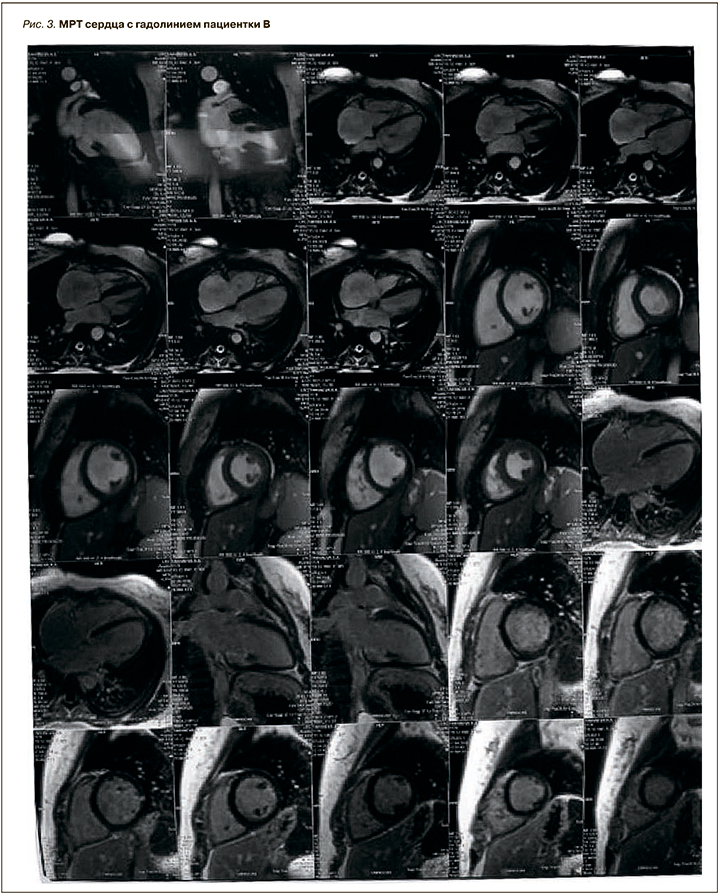
Онкомаркеры и гормоны щитовидной железы были в пределах нормы (табл. 2).
По данным холтеровского мониторирования (ХМ) ЭКГ выявлено чередование узлового ритма с эпизодами атриовентрикулярной (АВ) диссоциации, с эктопическим предсердным ритмом, с миграцией водителя ритма по предсердиям, одиночные выскальзывающие сокращения из АВ-соединения, из предсердий, с минимальной ЧСС 32 уд./мин, средней ЧСС 44 уд./мин, максимальной ЧСС 112 уд./мин. Выявлено 7 эпизодов ускоренного предсердного ритма, 1451 эпизод наджелудочковых экстрасистол, 12 парных, одна групповая, 14 по типу бигеминии, тригеминии, 657 эпизодов желудочковых экстрасистол двух морфологий. Количество пауз – 13, минимальная длительность – 3,5 с, максимальная длительность – 7,0 с, обусловленные угнетением функции синусового узла (СУ) и миграцией водителя ритма по предсердиям. Синдром тахи-бради. Во время проведения исследования эпизодов синкопальных состояний не было.
 Данные ЭхоКГ: левое предсердие 4,4 см (норма <4,0 см), правое предсердие 5,0 см (норма <3,8 см), конечно-диастолический размер левого желудочка (ЛЖ) 4,7 см (норма <5,6 см), конечно-систолический размер ЛЖ 3,0 см (норма <4,0 см), конечно-диастолический объем ЛЖ 138 мл (норма <157 мл), конечно-систолический объем ЛЖ 65 мл (норма <68 мл), фракция выброса (ФВ) ЛЖ >50%. Зон гипокинезии, акинезии, дискинезии миокарда, выпота в полости перикарда не выявлено. Аортальная регургитация 1 степени, митральная регургитация 1–2 степени, трикуспидальная регургитация 2 степени. Систолическое давление в легочной артерии 43,0 мм рт.ст. В правом предсердии визуализируется нитевидное образование, возможно, сеть Хиари (рудимент) (рис. 2).
Данные ЭхоКГ: левое предсердие 4,4 см (норма <4,0 см), правое предсердие 5,0 см (норма <3,8 см), конечно-диастолический размер левого желудочка (ЛЖ) 4,7 см (норма <5,6 см), конечно-систолический размер ЛЖ 3,0 см (норма <4,0 см), конечно-диастолический объем ЛЖ 138 мл (норма <157 мл), конечно-систолический объем ЛЖ 65 мл (норма <68 мл), фракция выброса (ФВ) ЛЖ >50%. Зон гипокинезии, акинезии, дискинезии миокарда, выпота в полости перикарда не выявлено. Аортальная регургитация 1 степени, митральная регургитация 1–2 степени, трикуспидальная регургитация 2 степени. Систолическое давление в легочной артерии 43,0 мм рт.ст. В правом предсердии визуализируется нитевидное образование, возможно, сеть Хиари (рудимент) (рис. 2).
 При ультразвуковом исследовании (УЗИ) брюшной полости признаки деформации желчного пузыря, диффузные изменения паренхимы поджелудочной железы. Печень расположена типично; контуры ровные, четкие; размеры не увеличены; толщина правой доли 127 мм, левой доли – 42 мм; нижний край не выступает из-под реберной дуги. Структура печени мелкозернистая, однородная; паренхима средней эхогенности. Сосудистый рисунок не изменен. Печеночные вены 0,9 мм в диаметре, воротная вена 10,0 мм в диаметре. Селезенка: контур ровный, размеры: площадь 48 см2.
При ультразвуковом исследовании (УЗИ) брюшной полости признаки деформации желчного пузыря, диффузные изменения паренхимы поджелудочной железы. Печень расположена типично; контуры ровные, четкие; размеры не увеличены; толщина правой доли 127 мм, левой доли – 42 мм; нижний край не выступает из-под реберной дуги. Структура печени мелкозернистая, однородная; паренхима средней эхогенности. Сосудистый рисунок не изменен. Печеночные вены 0,9 мм в диаметре, воротная вена 10,0 мм в диаметре. Селезенка: контур ровный, размеры: площадь 48 см2.
УЗИ органов малого таза без патологии. Свободная жидкость определяется в позадиматочном пространстве (слой до 10 мм).
Компьютерная томография (КТ). Продольный размер печени по верху 350 мм, высота левого сегмента 168 мм, высота правого сегмента 230 мм. Длина селезенки 17 см, ширина 11 см, толщина 6 см. Отмечено неравномерное контрастирование печени в портальной фазе, особенно ее правой доли, лимфаденопатия. Нельзя исключить цирроз и диффузную форму лимфомы.
Магнитно-резонансная томография (МРТ). Размеры печени: косой – 264,6 мм, вертикальный – 180,5 мм, переднезадней – 136,8 мм; левой доли (косой) – 102,0 мм. Контуры печени четкие ровные, структура однородная. Внутрипеченочные желчные протоки умеренно расширены. Селезенка обычного расположения, формы, однородной структуры, размерами до 98,5×76,6×136,6 мм. Желчный пузырь с изгибами и перетяжками; узкий холедох, умеренное количество жидкости в плевральных синусах, поддиафрагмальном пространстве брюшной полости.
МРТ сердца с контрастированием. Небольшой интрамиокардиальный участок фиброза в миокарде ЛЖ, возможно поствоспалительной природы. Данных за расширение ЛЖ не получено (размеры ЛЖ в 4-камерной проекции: 3,4×5,2 см, левого предсердия – нет данных), сократимость ЛЖ не снижена. Размеры правого желудочка в 4-камерной проекции 3,4×5,2 см, правого предсердия 6,3×7,1 см. Заключение: расширение правого предсердия, трикуспидальная регургитация 2 степени (рис. 3).
Заключения специалистов с рекомендациями представлены в таблице 3.
Острое начало заболевания, синкопальные состояния, появление нарушений ритма сердца явились основанием для постановки предварительного диагноза: дилатационная кардиомиопатия (ДКМП), синдром слабости синусового узла (эктопический предсердный ритм, АВ-диссоциация, угнетение синусового узла, синдром тахи-бради).
После лечения ингибиторами АПФ (периндоприл в дозе 5 мг), бета-адреноблокаторами (пропранолол по 40 мг), спиронолактоном по 50 мг, НПВП (диклофенак раствор 2,5%, 3 мл) состояние пациентки улучшилось: уменьшилась выраженность одышки и пастозность голеней. Лабораторные показатели в динамике представлены в таблице 4.
В связи с улучшением клинического состояния пациентка выписана под наблюдение терапевта и кардиолога по месту жительства. 24.04.2018 после консультации врача-аритмолога в плановом порядке по показаниям имплантирован электрокардиостимулятор (ЭКС).
Гепатоспленомегалия, повышение уровней АЛТ, АСТ, наличие антител к токсоплазме, вирусу простого герпеса, цитомегаловирусу, митохондриям, кардиомиоцитам, гладкой мускулатуре, волокнам проводящей системы сердца и миокарду явились основанием для направления пациентки в МКНЦ им. А.С. Логинова ДЗМ для дообследования с целью исключения аутоиммунного процесса печени.
Результаты комплексного лабораторного и инструментального обследования с биопсией печени подтвердили наличие первичного билиарного негнойного деструктивного холангита, хронического портального и лобулярного гепатита низкой степени активности.
Таким образом, данные анамнеза (перенесенная вирусная инфекция), клинической картины, результатов лабораторно-инструментальных методов исследования (повышение кардиоспецифических ферментов, наличие антител к кардиомиоцитам и цитомегаловирусу, интрамиокардиальный участок фиброза в миокарде ЛЖ поствоспалительной природы) позволили определиться с окончательным диагнозом: миокардитический кардиосклероз. Нарушение ритма сердца: синдром слабости синусового узла (эктопический предсердный ритм, АВ-диссоциация, угнетение синусового узла, синдром тахи-бради), ХСН I ФК. Имплантация двухкамерного ЭКС в режиме DDDR от 24.04.2018. Варикозная болезнь нижних конечностей, первичный билиарный холангит антимитохондриальный-М2 негативный. Гастроэзофагеальная рефлюксная болезнь, стадия эрозивного рефлюкс-эзофагита (LA F). Хронический гастродуоденит, обострение. Эрозивный гастрит.
ОБСУЖДЕНИЕ
Актуальность данного клинического наблюдения обусловлена несвоевременностью постановки диагноза миокардита в связи с отсутствием общепризнанных доступных информативных диагностических критериев и разнообразием «масок» его проявлений. Клиническая картина миокардита зависит от этиологического фактора, состояния иммунной системы и соматического статуса пациента, сопутствующей патологии, локализации, степени выраженности и объема поражения сердечной мышцы [4].
В представленном выше клиническом наблюдении пациентке молодого возраста был первоначально поставлен диагноз ДКМП на основании клинических проявлений заболевания, несмотря на отсутствие дилатации всех камер сердца, систолической дисфункции ЛЖ и повышения уровня NT-proBNP, однако при дополнительном дообследовании диагноз ДКМП был исключен.
Данный диагноз широко используется кардиологами, терапевтами, кардиохирургами и выставляется при наличии дилатации камер сердца со снижением его сократимости без учета причин, приведших к этому состоянию. Однако нозологический диагноз ДКМП предполагает отсутствие не только ишемического повреждения миокарда и пороков сердца, но и других причин кардиомегалии [5]. ДКМП относится к группе заболеваний со смешанной этиологией и может иметь в своей основе генетические, инфекционные, аутоиммунные и токсические причины, а также не исключено их сочетание. Перечисленные факторы приводят к дилатации желудочков и систолической дисфункции.
В качестве примера неоправданного использования понятия ДКМП можно привести случаи острого и подострого миокардита, который быстро приводит к дилатации камер и систолической дисфункции [2, 6]. Действительно, при тяжелом течении миокардита с выраженной кардиомегалией и прогрессирующей сердечной недостаточностью необходимо исключить ДКМП.
Основным диагностическим критерием миокардита является связь кардиальных симптомов с перенесенной инфекцией и наличие признаков воспаления, хотя при затяжном и хроническом течении эта связь может отсутствовать. В этом случае помогает комплексное клинико-лабораторное и инструментальное обследование пациента, а также проведение эндомиокардиальной биопсии (ЭМБ) по определенным показаниям для исключения воспалительной природы поражения сердца [7].
В европейских рекомендациях 2013 г. по ведению пациентов с миокардитами [8], которые представляют собой согласованное мнение ведущих экспертов ЕС, рекомендовано обязательное проведение ЭМБ для подтверждения диагноза миокардита, что, к сожалению, не всегда возможно не только в российской рутинной клинической практике. Вместе с тем клинические критерии миокардита, предложенные европейскими коллегами, не лишены недостатков: например, связь симптомов с перенесенной инфекцией рассматривается лишь как второстепенный признак; значимость большинства критериев не оценивается в сопоставлении с ЭМБ, а информативность МРТ сердца с гадолинием достаточно высока лишь при острых формах миокардита. В отношении целого ряда категорий пациентов, медикаментозных и немедикаментозных методов лечения авторы воздерживаются от комментариев.
Современная диагностика вирусного миокардита имеет ряд трудностей. «Рутинные» методы обследования не улучшают диагностику миокардитов, не всегда прослеживается связь между биохимическими показателями воспаления и морфологическими изменениями миокарда, изменениями на ЭКГ и клинико-лабораторными данными, т.е. подтверждение воспаления рутинными методами исследованиями не всегда возможно, что значительно затрудняет своевременную диагностику, особенно на догоспитальном этапе [9].
Убедительно верифицировать диагноз миокардита возможно, лишь используя современные методы диагностики, а именно ЭМБ с последующей ПЦР-диагностикой. Но сложность ситуации заключается в том, что не везде можно провести данные методы исследования, включая и МРТ сердца с гадолинием для верификации очага миокардита [10]. В настоящее время известно, что вирусные инфекции являются самой частой причиной развития инфекционного миокардита. У 50–80% больных с воспалительными изменениями миокарда присутствует связь с предшествующей вирусной инфекцией, а доказать ее происхождение возможно лишь косвенно по диагностически значимому нарастанию титра вирус-нейтрализующих антител в сыворотке крови пациента. Однако титр антител повышается медленно, и нередко результаты этого исследования имеют ретроспективное значение. Кроме того, не всегда положительные данные серологических исследований совпадают с обнаружением вирусного генома в ткани миокарда при ЭМБ и наоборот, что существенно затрудняет верную диагностику.
Наибольшей кардиотропностью обладают энтеровирусы, особенно вирусы Коксаки группы В. Эти вирусы считаются причиной половины всех cлучаев вирусных миокардитов. Особенно показательна кардиотропность вирусов, приводящих к развитию миокардитов, в 30% случаев которых развивается аритмия в молодом возрасте. У пациентки В. были обнаружены АТ к вирусу простого герпеса и цитомегаловирусу, что не исключает вирусную этиологию развившегося у нее миокардита, который проявил себя нарушениями ритма и проводимости сердца.
Таким образом, можно проследить следующую картину прогрессирования миокардита у пациентки. Перенесенный ОРВИ летом 2017 г. привел к развитию миокардита, проявляющегося нарушениями ритма сердца и синкопальными состояниями. По ЭКГ и анализам крови значимых изменений выявлено не было. В феврале 2018 г. произошла манифестация миокардита с зафиксированными изменениями на ЭКГ, в связи с чем пациентка была госпитализирована в стационар для дообследования, где был выставлен предварительный диагноз ДКМП. На основании лабораторных данных был заподозрен вирусный миокардит. МРТ сердца с гадолинием позволила выявить небольшой интрамиокардиальный участок фиброза в миокарде ЛЖ, возможно, поствоспалительной природы. Из-за отсутствия показаний ЭМБ не проводилась. Учитывая наличие синкопальных состояний в анамнезе, асистолии более 3 с по данным холтеровского мониторирования ЭКГ, эпизодов брадикардии менее 50 уд./мин, синдрома слабости синусового узла, пациентке был имплантирован постоянный ЭКС [11].
Оставался открытым вопрос о причине высокого уровня печеночных ферментов, что не исключало системный аутоиммунный процесс. При проведении биопсии печении был обнаружен первичный негнойный деструктивный холангит, хронический портальный и лобулярный гепатит низкой степени активности. Данных за аутоиммунный процесс получено не было. По заключению врачебного консилиума, рост печеночных ферментов указывал на наличие как кардиотропного, так и гепатропного цитомегаловируса.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай иллюстрирует не только трудность своевременной диагностики миокардита, но и подтверждает, что пациенты с жалобами на слабость, перебои в работе сердца, эпизоды синкопальных состояний после перенесенного ОРВИ требуют особого внимания и входят в группу риска развития миокардита.



