ВВЕДЕНИЕ
Проблема аллергических заболеваний, которые Всемирная организация здравоохранения (ВОЗ) относит к шести наиболее часто встречающимся патологиям, имеющим хроническое течение, приобретает глобальные масштабы и актуальна во всех странах мира. Согласно данным ВОЗ, аллергическими заболеваниями страдают от 20 до 40% жителей планеты, и, по прогнозам, они могут занять первое место в общей структуре заболеваемости к 2050 г. [1]. По данным эпидемиологических исследований, проведенных в ГНЦ Институт иммунологии ФМБА России, в Российской Федерации атопическими болезнями страдает от 15 до 35% населения. При этом распространенность бронхиальной астмы среди взрослых составляет 5,6–7,3%, аллергического ринита (АР) – от 12 до 24%, атопического дерматита (АтД) – от 5,9 до 15,5% в различных регионах РФ. У 15–20% больных аллергопатология протекает в тяжелой форме [2, 3].
Бронхиальная астма, представляя собой хроническое воспалительное заболевание дыхательных путей с неоднородными механизмами патогенеза, до настоящего времени остается медико-социальной проблемой большинства стран мира, что связано с высокой распространенностью болезни во всех возрастных группах населения и неуклонным ростом численности больных [4–6].
Существенная часть больных (20–30%) БА, сочетающейся с внелегочными формами аллергических заболеваний, такими как аллергический ринит и атопический дерматит, получающих базисную противовоспалительную терапию, в реальной практике имеет более низкий, чем в клинических исследованиях, контроль заболевания. Подобное сочетание утяжеляет течение не только астмы, но и коморбидной с ней аллергопатологии и характеризуется резистентностью к традиционной противовоспалительной терапии ингаляционными глюкокортикостероидами (ИГКС), особенно при наличии поливалентной сенсибилизации к нескольким группам неинфекционных аллергенов [7].
В современной медицине активно ведется поиск эффективных и патогенетически обоснованных методов лечения данной патологии. Имеются данные об успешном применении в лечении атопической БА аллерген-специфической иммунотерапии (АСИТ). Многолетний положительный опыт по АСИТ атопических заболеваний получил в последнее десятилетие строго научное подтверждение ее эффективности [8–9].
Среднетяжелая атопическая БА, коморбидная с АР и АтД, представляет собой актуальную проблему для врачей амбулаторно-поликлинического звена. Коморбидная патология диктует необходимость максимальной индивидуализации подхода к лечению среднетяжелой атопической БА.
Цель исследования: повысить эффективность лечения больных с атопической бронхиальной астмой средней степени тяжести, коморбидной с аллергическим ринитом и атопическим дерматитом, при поливалентной сенсибилизации за счет введения аллерген-специфической иммунотерапии.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 132 пациента с атопической БА, ассоциированной с АР и АтД. Возраст обследованных колебался от 18 до 32 лет (средний возраст 22,3±5,0 лет), среди них мужчин было 83 (63%), женщин 49 (37%). Средняя длительность заболевания составила 11,3±6,0 лет.
Пациенты были рандомизированы методом «слепых конвертов 2:1» на две группы. Первую группу (I группа, n=88, из них 63,6% мужчин и 36,4% женщин в возрасте 18–32 лет; средний возраст 22,4±0,7 лет) составили пациенты с атопической БА средней тяжести, коморбидной с АР и АтД, которым на фоне базисной противовоспалительной терапии в течение 3-летнего периода была добавлена АСИТ. Вторую группу (II группа II, n=44, из них 61,4% мужчин и 38,6% женщин в возрасте 18–32 лет; средний возраст 22,1±0,5 лет) составили пациенты с атопической БА средней тяжести, коморбидной с АР и АтД, которые продолжали получать базисную противовоспалительную терапию.
Комплексное обследование включало детальный сбор жалоб, изучение анамнеза заболевания, аллергологического анамнеза и анамнеза жизни, оценку факторов, влияющих на течение заболевания, физикальное обследование.
Стандарт лабораторного исследования включал общий анализ крови, общий анализ мочи. Всем пациентам проводилось исследование функции внешнего дыхания методом спирографии и пикфлоуметрии.
С целью диагностики аллергического заболевания (АЗ), выявления причинно-значимого фактора (аллергена), способствующего его развитию, использовались аллергологические методы обследования, которые включали сбор аллергологического анамнеза, кожные тесты с неинфекционными группами аллергенов, провокационные тесты (по показаниям), иммунологические лабораторные методы обследования (определение уровня антиген-специфических иммуноглобулинов класса Е (IgE) в сыворотке крови (по показаниям).
Клиническая эффективность АСИТ оценивалась по общепринятым критериям, основанным на оценке интенсивности исходного и после АСИТ состояния больного по общепринятой 4-балльной системе А.Д. Адо, дополненной Л.А. Горячкиной и Н.И. Рошаль (1991). Критериями оценки служила динамика клинических проявлений заболевания (интенсивность назальных, респираторных симптомов, кожных проявлений, потребность в медикаментах). Каждый симптом оценивается по шкале от 0 до 3 баллов, где 0 — отсутствие симптомов, 1 — легкие, 2 — средней тяжести, 3 — тяжелые симптомы.
Материалы исследования были подвергнуты статистической разработке с использованием непараметрических критериев. Накопление, корректировка, систематизация, статистический анализ исходной информации и визуализация полученных результатов проводилась в электронных таблицах Excel. Биометрический анализ осуществлялся с использованием пакетов STATISTICA 7.0, возможностей MS Excel. Проверка нормальности распределения производилась с использованием методов Колмогорова–Смирнова и Шапиро–Уилки, проверка гипотез о равенстве генеральных дисперсий – с помощью критерия Левена. Во всех процедурах статистического анализа критический уровень значимости нулевой статистической гипотезы (р) принимался равным 0,05 [10].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Группы больных, включенных в исследование, были сопоставимы по возрасту и полу (табл. 1, 2)
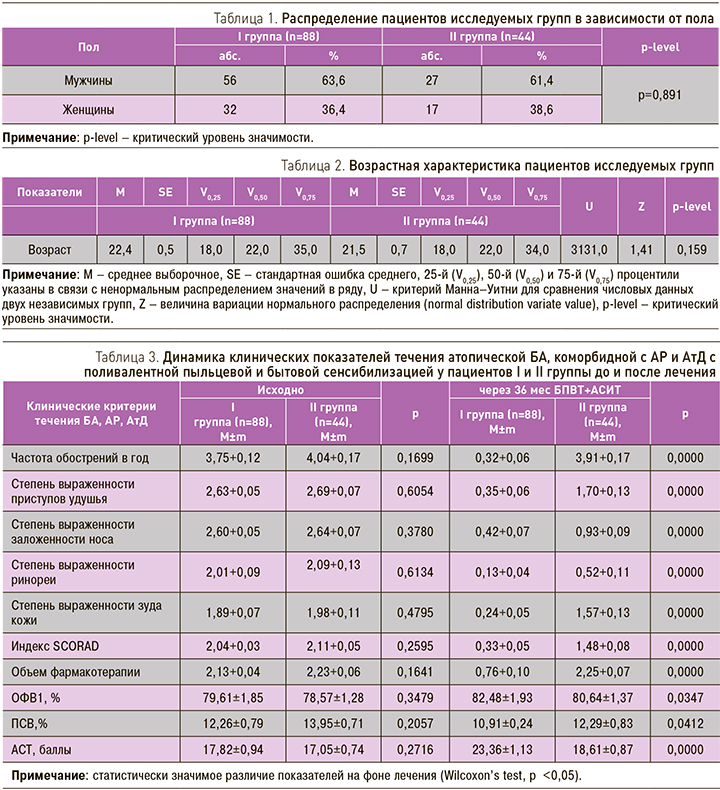
Все 132 пациента с атопической БА, коморбидной с АР и АтД, получали базисную противовоспалительную терапию ингаляционными и топическими (спреи, мази) ГКС, а также по показаниям антилейкотриеновые препараты (35,3%), блокаторы Н-1 гистаминовых рецепторов (13,3%), топические ингибиторы кальциневрина (9,8%), что соответствовало международным и отечественным рекомендациям по диагностике и лечению атопической БА, АР и АД [22–24]. У большинства больных (n=92; 77,3%) приступы удушья купировалиcь однократным или повторным использованием коротко действующего ингаляционного бронхолитика, доcтоверно реже, у каждого пятого (n=24; 20,2%) пациента, наблюдалось спонтанное исчезновение cимптомов.
У всех 132 пациентов с атопической БА, коморбидной с АР и АтД, было установлено сочетание бытовой (домашняя пыль, клещ домашней пыли) с поливалентной пыльцевой (к трем группам пыльцевых аллергенов – деревьев (береза), злаковых (костер, овсяница) и сорных трав (полынь, лебеда)) сенсибилизации, что имело значение при подборе АСИТ.
Аллерген-специфическое лечение пациентам I группы (n=88) проводилось в виде подкожного введения постепенно нарастающих доз причинно-значимых аллергенов (использовали 4 неродственные группы аллергенов: бытовые, аллергены пыльцы деревьев, злаковых и сорных трав) на протяжении трехлетнего периода.
В исследовании использовались методы классической предсезонной профилактической АСИТ при поллинозе (Freeman, Noon, 1911) и круглогодичной непрерывной иммунотерапии (Feinberg, 1946) при бытовой сенсибилизации, проводимые амбулаторно в условиях специализированного аллергологического процедурного кабинета, а также ускоренный метод (Sheppegrell, 1964), используемый в условиях стационара.
При проведении балльной оценки клинических симптомов в период проведения АСИТ было выявлено, что сумма отличных (отсутствие симптомов) и хороших (легкие симптомы) результатов увеличивалась с каждым последующим курсом иммунотерапии (табл. 3).
Анализ результатов влияния аллерген-специфической иммунотерапии у пациентов I группы на тяжесть течения атопической БА, коморбидной с АР и АтД, при наличии поливалентной сенсибилизации к пыльце деревьев, злаковых, сорных трав, бытовых аллергенов показал, что на фоне проводимой БПВТ в комбинации с АСИТ уже после первого курса у 64 пациентов наблюдалось улучшение клинического состояния в виде исчезновения или уменьшения частоты и выраженности симптомов БА (табл. 4).
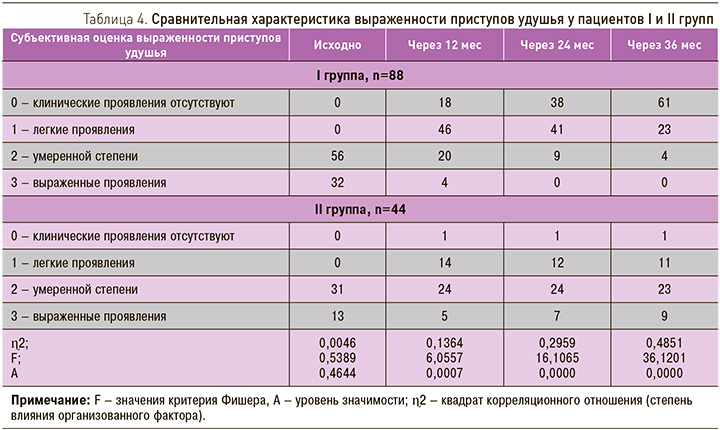
Для пациентов II группы также была характерна положительная динамика тяжести течения БА на фоне БПВТ, однако к концу третьего курса терапии более чем у 70% больных сохранялась среднетяжелая и тяжелая степень БА.
Эффективность проводимой терапии прослеживалась и в отношении коморбидной патологии. Статистически значимое снижение выраженности симптомов заложенности носа у пациентов I группы (n=79), по сравнению с пациентами II группы (n=30), проявлялось к концу 2 курса терапии и увеличилось к окончанию 3 курса (n=82). К окончанию исследования до 70% пациентов I группы (n=67) отметили купирование зуда и нормализацию сна, а количество пациентов II группы с положительной динамикой уменьшилось втрое (n=4). У пациентов I группы показатели кожного процесса к окончанию наблюдения улучшились в 6,4 раза по сравнению с исходным уровнем, что превосходило показатели II группы, где индекс SCORAD к окончанию 3-летнего лечения на фоне БПВТ снизился в 2,8 раза.
Кроме того, за время проведения АСИТ оценивался объем лекарственной терапии. Через 12 мес наблюдения в I группе у 2 больных удалось отменить базисную ингаляционную терапию, у 21 – уменьшить дозу противоастматического препарата в 2 раза, у 64 пациентов доза базисной ингаляционной терапии осталась прежней. Во II группе к окончанию первого года терапии у всех 44 пациентов доза базисного ингаляционного препарата осталась в прежнем объеме, 2 пациента использовали системные глюкокортикостероиды (ГКС).
Через 24 мес лечения у 33 пациентов, получающих комплексную терапию (БПВТ+АСИТ), удалось полностью отменить базисную противовоспалительную терапию, у 40 – уменьшить дозу ИГКС в 2 раза, у 15 пациентов базисная противовоспалительная терапия осталась в прежнем объеме. При этом во II группе к окончанию второго года наблюдения доза ингаляционных ГКС не изменилась, увеличилось число пациентов с расширенным объемом БПВТ за счет включения в терапию антилейкотриеновых препаратов (с n=12 до n=26), 3 пациента продолжали использовать системные ГКС.
К концу третьего года в I группе значительно увеличилась доля пациентов, не получавших лекарственную противоастматическую терапию (60,2±0,74%, р <0,05); практически в 8 раз уменьшилось число больных получавших низкие дозы ИГКС (с 24,1±0,06 до 3,4±0,11%, р <0,05), однако треть пациентов остались с прежней дозой базисной терапии (36,4±0,96%, р >0,05). Количество пациентов II группы, использующих системные ГКС, к окончанию третьего года наблюдения увеличилось до 8, антилейкотриеновых препаратов – с 26 до 33, дозы базисных ингаляционных препаратов для всех 44 пациентов не изменились.
Таким образом, на фоне терапии с комбинированным использованием БПВТ и АСИТ количество лекарственных средств, используемых пациентами, имело четкую динамику к снижению. Так, через год от начала проводимой терапии полностью отменить использование ингаляционных и таблетированных форм удалось 2,3% пациентов I группы, к концу второго года терапии – 37,5% больных, к концу третьего года терапии – в 60,2% случаев. Увеличилось число пациентов, получающих низкие дозы ИГКС (с 0 до 28), при этом к концу трехлетнего курса АСИТ пациентов с использованием высоких доз ИГКС не зарегистрировано. Системные ГКС на протяжении всего исследования не применялись для лечения ни одного пациента.
При этом у пациентов II группы объем лекарственной терапии к окончанию третьего года наблюдения не уменьшился, а по отношению к системным ГКС несколько увеличился по сравнению с началом терапии (от 15,9 до 18,2% соответственно, р=0,04). Отменить медикаментозную терапию не удалось ни одному пациенту. Статистически значимого снижения потребления β2-агонистов и дозы ингаляционных кортикостероидов у обследованных пациентов II группы не зарегистрировано.
В итоге на фоне БПВТ с использованием АСИТ атопическая БА у пациентов I группы из персистирующего течения средней тяжести через год перешла в БА легкого персистирующего течения, а к концу третьегогода терапии в 39,8% случаев достигла интермиттирующего течения, при этом в 60,2% случаев был достигнут полный контроль над течением БА с достижением ремиссии заболевания, что позволило отменить базисную противовоспалительную ингаляционную терапию ИГКС. При этом тяжесть течения БА у пациентов II группы имела тенденцию к уменьшению по изменению объема терапии (уменьшение числа больных, принимающих системные ГКС), снижению частоты обострений на фоне коррекции базисной противовоспалительной терапии в течение первого года наблюдения. Однако в последующие два года как частота, так и объем БПВТ вернулись к исходному значению с переходом к высоким дозам ИГКС в 25,8% случаев и в 13,6% – к потребности использования системных ГКС, что свидетельствовало об отсутствии контроля БА.
Результаты проведенного исследования показали высокую эффективность комбинированной БПВТ и АСИТ у больных атопической БА, коморбидной с АР и АтД, при наличии поливалентной сенсибилизации к пыльцевым и бытовым аллергенам, оказывая благотвоpное влияние на течение как БА, так и коморбидной патологии (АР и АтД). На начальном этапе лечения ГКС, обеспечивая контролируемое течение астмы, позволяют осуществить АСИТ, а постепенно наpастающий эффект специфической иммунотерапии способствует в свою очеpедь отмене ИГКС или значительному снижению их дозы.
ВЫВОДЫ
- Положительный клинический эффект АСИТ характеризуется снижением объема получаемой базисной противовоспалительной терапии.
- Комбинированная терапия (БПВТ+АСИТ) у пациентов с атопической БА средней степени тяжести, коморбидной с АР и АтД, при наличии поливалентной сенсибилизацией к бытовым и пыльцевым аллергенам через 3 года от начала комплексной терапии позволяет достичь полного купирования клинических проявлений БА (86,3%), с отменой БПВТ – в 63,6% случаев.
- Улучшение течения коморбидной патологии на фоне комбинированной БПВТ и АСИТ к окончанию 3 курса терапии дает максимальный клинический эффект в виде отсутствия обострений кожных проявлений (76,1%) и полного купирования назальной обструкции (64,8%).



