27 октября 2021 г. в рамках XXXI Национального конгресса по болезням органов дыхания под эгидой межрегиональной общественной организации «Российское респираторное общество» состоялся симпозиум с международным участием, посвященный некоторым вопросам терапии новой коронавирусной инфекции и реабилитации пациентов с постковидным синдромом.
На симпозиуме был представлен доклад из Стэнфордского университета (Bollyky P.L.), а также доклады ведущих отечественных специалистов (Г.Л. Игнатова, В.Н. Антонов), в которых, в частности, всесторонне освещался вопрос о роли гиалуроновой кислоты (гликозаминогликана) в патогенезе COVID-19: развитии и поддержании воспалительного процесса, формировании патологического респираторного отделяемого со специфичными физико-химическими свойствами, а также в постковидных остаточных изменениях легочной ткани. Был приведен положительный клинический опыт применения препарата бовгиалуронидаза азоксимер (Лонгидаза) в лечении и реабилитации ковидных больных.
ОСОБЕННОСТИ МОКРОТЫ У ПАЦИЕНТОВ С COVID-19
Пол Боллики (Bollyky P.L., MD, PhD), иммунолог, доцент кафедры инфекционных заболеваний медицинского факультета Стэнфордского университета (США), в своем докладе представил новые сведения о патогенезе COVID-19 и рассказал об исследованиях биофизических и биохимических свойств патологического отделяемого из дыхательных путей у пациентов с тяжелым течением этого заболевания. Данные исследования были начаты группой сотрудников Стэнфордского университета (Bollyky P.L., Milla C., Rogers A. et al.) и имели большое значение для понимания патофизиологических механизмов развития заболевания. Было выяснено, что гиалуроновая кислота (гиалуронан) и ДНК являются отличительными компонентами респираторного секрета у больных коронавирусной инфекцией. Из этого был сделан вывод, что гиалуроновую кислоту можно использовать в качестве терапевтической мишени для того, чтобы бороться с воспалением и остаточными изменениями при ковиде, ускоряя восстановление функции легких и облегчая состояние пациентов.
Когда началась эпидемия новой коронавирусной инфекции, это заболевание стали распознавать по характерной картине компьютерной томографии (КТ): участки пораженной легочной ткани выглядели как непрозрачное матовое стекло. Подобная картина типична для острого респираторного дистресс-синдрома (ОРДС) и связана с образованием очень плотной густой трудноотделяемой мокроты и сопутствующим развитием отека. Это приводит к ухудшению оксигенации и отрицательно влияет на растяжимость легочной ткани. Перед исследователями стояла задача выяснить, что именно приводит к образованию столь вязких выделений и можно ли, изменяя их консистенцию, повлиять на течение и исход заболевания.
Ранее уже сообщалось, что при ОРДС наблюдается повышение уровня гиалуроновой кислоты [1]. Были сведения и о том, что уровень экспрессии генов, отвечающих за ее производство, при этом также значительно увеличивается. Гиалуроновая кислота (гиалуронан) – биополимер, очень хорошо поглощающий воду, может приводить к развитию и поддерживать отек и воспаление. Продукты распада внеклеточного матрикса – фрагменты гиалуронана – посредством TLR2- и TLR4-сигналлинга участвуют в иммунных реакциях и тем самым поддерживают воспалительный процесс.
Группа ученых из Стэнфордского университета исследовала образцы мокроты у интубированных ковидных пациентов. Эти образцы отбирали в течение 24–48 ч после начала применения искусственной вентиляции легких (ИВЛ). В ходе их изучения было обнаружено, что полученный секрет по целому ряду параметров имеет существенное сходство с респираторным отделяемым у больных муковисцидозом (кистозным фиброзом). В обоих случаях (муковисцидоз, COVID- 19) в секрете присутствует значительное количество преимущественно фрагментированной (низкомолекулярной) гиалуроновой кислоты. Дыхательные пути буквально заполнены гиалуронаном, что определяется благодаря специфичному окрашиванию на гистологических срезах. Присутствие гиалуроновой кислоты подтверждается тем, что при обработке образцов гиалуронидазой (ферментом, расщепляющим гиалуронан) специфическое окрашивание участков гистологических срезов, заполненных секретом, исчезает.
Другие ученые также пришли к похожим выводам, обнаружив значительные количества гиалуроновой кислоты не только в легких [2], но и в сыворотке крови пациентов с COVID-19. Было показано, что вирусная РНК способствует продукции гиалуронана. На снимках, полученных с использованием люминесцентной микроскопии, визуализируются фибробласты, продуцирующие гиалуронан. Этот процесс ингибировался применением РНКазы. Под более сильным увеличением хорошо определяются волокна гиалуроновой кислоты, которые предположительно захватывают вирусные частицы. Помимо гиалуронана, также обнаруживается большое количество ДНК-материала.
Вязкоэластические свойства образцов мокроты, отобранных у пациентов с COVID-19, изучались методом динамического светорассеяния. Часть образцов обрабатывалась гиалуронидазой, другая – ДНКазой, третья – физраствором. В результате выяснилось, что обработка ферментами существенно снижала вязкость субстрата. При этом эффект был пропорционален его изначальной плотности и вязкости: чем более вязким и плотным был исследуемый образец, тем лучше он поддавался обработке ферментом.
Ожидаемо возник вопрос: возможно ли применение выявленных закономерностей в лечении пациентов с COVID-19? В симптоматической терапии муковисцидоза подобная тактика давно используется: речь об активном применении ингаляционного препарата Дорназа альфа (рекомбинантная человеческая ДН-аза) – генно-инженерного варианта природного фермента человека, расщепляющего внеклеточную ДНК.
Наряду с этим в настоящее время ведутся клинические испытания высокомолекулярной гиалуроновой кислоты, а также изучается действие 4-метилумбеллиферона (гимекромона) – ингибитора синтеза гиалуроновой кислоты. Результаты данных исследований вскоре будут известны. Кроме того, можно считать уже доказанным, что таргетирование фрагментированной (низкомолекулярной) гиалуроновой кислоты – один из эффективных путей улучшения состояния пациентов с COVID-19.
Отвечая на вопросы российских коллег, Пол Боллики сообщил, что пока остается неясным, на какой из стадий развития заболевания (COVID-19) применение препаратов, расщепляющих гиалуроновую кислоту и/или ингибирующих ее синтез, было бы наиболее эффективно – в стадии экссудации, пролиферации или фиброза.
Основными выводами в докладе американского эксперта стали следующие положения.
1. Мокрота пациентов с COVID-19 имеет высокую концентрацию гиалуроновой кислоты, преимущественно низкой молекулярной массы.
2. Применение гиалуронидазы улучшает физико-химические свойства мокроты, что может значительно помочь пациентам в тяжелом состоянии;
3. Таргетирование гиалуроновой кислоты может стать многообещающей терапевтической стратегией при борьбе с COVID-19 как в комплексной, так и в монотерапии.
СНИЖЕНИЕ УРОВНЯ ГИАЛУРОНОВОЙ КИСЛОТЫ В ОЧАГЕ ВОСПАЛЕНИЯ КАК ПОТЕНЦИАЛЬНАЯ МИШЕНЬ ТЕРАПИИ ПРИ СOVID-19
Некоторые вопросы реабилитации пациентов, перенесших COVID-19, осветила в своем выступлении Г.Л. Игнатова, д.м.н., профессор, заведующая кафедрой терапии ИДПО ФБГОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, член правления Российского респираторного общества, главный внештатный специалист-пульмонолог Уральского федерального округа, г. Челябинск.
Гиалуроновая кислота – ключевой компонент межклеточного вещества, который играет важную структурную роль, участвует в организации фибриллярных белков, обеспечивает взаимодействие клеток и межклеточного вещества. Она выполняет функцию цементирующего материала при взаимодействии с компонентами межклеточного вещества, служит резервуаром для воды и ионов. При этом многое зависит от длины молекулы. Так, высокомолекулярная гиалуроновая кислота обладает противовоспалительными свойствами, высокой способностью связывать фибриноген, тогда как низкомолекулярная, напротив, проявляет провоспалительное действие, и именно она способствует формированию рубцов [3].
При COVID-19 ослабляется контроль над активатором транскрипции-3 (STAT3). Этот сигнальный белок способен активировать синтетазу гиалуроновой кислоты, что, в свою очередь, приводит к избыточному синтезу гиалуроновой кислоты, создает условия для развития диффузного альвеолярного повреждения с образованием гиалиновых мембран на стенках альвеол [4, 6]. Количество гиалуроновой кислоты у пациентов с тяжелым течением COVID-19 существенно повышено, при микроскопии высокого разрешения обнаруживается ее накопление внутри альвеолярного пространства. В респираторных секретах таких пациентов наблюдалось статистически значимое, кратное увеличение концентрации гиалуроновой кислоты в сравнении со здоровыми людьми. Такая гиалуроновая кислота преимущественно представлена фрагментами с низкой молекулярной массой, что характеризует состояние гипервоспаления.
Согласно данным аутопсии, гиалуроновая кислота присутствует в большом количестве в легочной ткани, в частности в альвеолярном пространстве. Стенки альвеол при этом гиперпластичны и повреждены. Окрашивание гиалуроновой кислоты наблюдается и в утолщенном периальвеолярном интерстиции. Также выявляется обширная окклюзия дыхательных путей гиалуроновой кислотой: эти области ассоциированы с диффузным альвеолярным инфильтратом. Окрашивание теряется на срезах, предварительно обработанных гиалуронидазой.
Гиалуроновая кислота в очаге воспаления способствует формированию экссудата и развитию отека. Ее молекулы способны связываться между собой, а также с муцином, повышая вязкость секрета. При этом гиалуроновая кислота экстремально гигроскопична. На доклинической модели альвеолярного повреждения была показана связь между ее накоплением в интерстиции легких и отеком.
Низкомолекулярная гиалуроновая кислота усиливает воспаление. Известно, что фрагменты гиалуроновой кислоты запускают воспалительные реакции путем TLR2- и TLR4-сигналлинга. Исследования показали, что накопление продуктов распада внеклеточного матрикса в месте повреждения приводит к хроническому воспалению.
Кроме того, гиалуроновая кислота, повышая вязкость респираторных секретов, затрудняет их выведение, а также газообмен в легких. С точки зрения пульмонолога, уменьшение содержания этого вещества может быть значимой терапевтической задачей при COVID-19 [2, 5].
Гиалуронидаза способна разрушать гиалуроновую кислоту в поврежденных альвеолярных пространствах, заполненных экссудатом и альвеолярными пробками и тем самым облегчать газообмен. Разрушение гиалуроновой кислоты может способствовать снижению уровня гиперинфляции легких и увеличению потока выдыхаемого воздуха за счет уменьшения количества избыточной жидкости.
Одно из исследований, проведенных в США, изучало уровень гиалуроновой кислоты в образцах сыворотки крови и бронхоальвеолярного лаважа [6]. Было установлено, что уровень гиалуроновой кислоты в альвеолах ассоциирован с индексом повреждения легких (LIS), а ее уровень в крови связан и с индексом LIS, и с индексом полиорганной недостаточности (SOFA). Из этой работы можно сделать заключение, что альвеолярная гиалуроновая кислота в первую очередь связана с дисфункцией органов дыхания, в то время как циркулирующая в крови гиалуроновая кислота – с полиорганной дисфункцией в целом. Эти данные также свидетельствуют о том, что уровни гиалуроновой кислоты и в кровеносном русле, и в альвеолах ассоциированы с тяжестью повреждения легких, степенью гипоксемии, показателями положительного давления на выдохе.
Резюмируя вышеприведенные факты, можно отметить следующее.
1. Эмпирические данные свидетельствуют о повышении уровня гиалуроновой кислоты при СOVID-19 как в респираторном секрете, так и в срезах легких (альвеолы, интерстиций), что согласуется с изученными молекулярными механизмами патогенеза СOVID-19.
2. Снижение уровня гиалуроновой кислоты – потенциальная мишень терапии СOVID-19 и постковидного синдрома.
Во второй части своего доклада профессор Г.Л. Игнатова познакомила слушателей с предварительными результатами «Многоцентрового открытого проспективного когортного исследования эффективности и безопасности препарата Лонгидаза при профилактике и лечении поствоспалительного пневмофиброза и интерстициальных заболеваний легких, развившихся после СOVID-19, осложненного легочными проявлениями» (исследование DISSOLVE). Это исследование проводилось с июля 2020 г. по апрель 2021 г. на базе 13 клинических центров, включив 160 взрослых пациентов. В нем сравнивались показатели пациентов, которые получали препарат Лонгидаза 3000 МЕ, и пациентов, за которыми проводилось исключительно динамическое наблюдение. Были сделаны следующие выводы.
1. Терапия с использованием препарата Лонгидаза способна помочь улучшить функцию легких; более выраженный эффект был показан в подгруппе пациентов с наибольшими отклонениями этого показателя.
2. У больных в группе применения Лонгидазы по сравнению с контролем наблюдалось более выраженное улучшение общего физического состояния:
- снижение выраженности одышки;
- повышение толерантности к физической нагрузке;
- повышение уровня сатурации капиллярной крови в покое.
ВОПРОСЫ КОМПЛЕКСНОЙ РЕАБИЛИТАЦИИ ПОСЛЕ ПЕРЕНЕСЕННОГО COVID-19
Доклад «Недостающий элемент в комплексной реабилитации пациента, перенесшего COVID- 19. Клинические случаи» на симпозиуме представил В.Н. Антонов, д.м.н., профессор кафедры терапии ИДПО ФБГОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, главный пульмонолог Челябинской области.
Для пациента тягостен не только сам острый, активный процесс заболевания, но и его последствия, выражающиеся в так называемом постковидном синдроме. Всемирная организация здравоохранения (ВОЗ) считает этот синдром серьезным перманентным патологическим состоянием. Последствия перенесенного COVID-19 сказываются на психическом здоровье, проявляются нарушениями свертываемости крови, отклонениями в работе системы кровообращения. Особенно сильный удар заболевание наносит по бронхолегочной системе. При этом, к сожалению, единый комплексный подход к реабилитации пациентов до сих пор не выработан. В докладе профессора В.Н. Антонова содержалась информация об основных составляющих комплексной реабилитации после COVID-19.
Реабилитационные мероприятия в отношении пациентов, перенесших COVID-19, на сегодняшний день носят несколько хаотичный и зачастую формальный характер. Основная задача состоит в том, чтобы максимально упорядочить этот процесс и выработать к нему единый подход. И, поскольку пандемия продолжается, а пациентов, перенесших COVID-19, становится все больше, такая потребность с каждым днем становится все актуальнее. Характерная особенность коронавирусной инфекции – тяжелое течение с резистентностью к терапии, медленное восстановление, риски инвалидизации, ухудшение качества жизни. Основные проблемы реабилитации после COVID-19 состоят в следующем.
1. Увеличивается количество переболевших пациентов с потребностью в восстановлении работоспособности, снижении рисков и своевременной терапии отсроченных неблагоприятных исходов.
2. Заболеваемость, количество тяжелых случаев, смертность продолжают бить всевозможные рекорды.
3. Нет готовых решений как в острой фазе, так и на этапе реабилитации.
4. Оценки будущих расходов на здравоохранение, социальные нужды, а также затрат, связанных со снижением производительности труда, продолжают расти.
Исследование, проведенное командой Сеченовского университета [7], продемонстрировало, что через полгода после выписки из госпиталя у 47,1 % пациентов отмечают продолжающиеся симптомы. Ведущая жалоба – слабость (у 21,2 % от числа выписанных), вторая по частоте – одышка (14,5 %).
Оценка пациентов с заболеваниями легких после COVID-19 требует выделения трех основных клинических фенотипов [8].
1. Пациенты с существенными отклонениями по данным рентгенографии с нарушением функции легких и сопутствующими симптомами (одышка с кашлем или без него). Именно такие пациенты составляют большинство.
2. Пациенты без нарушений при визуализации на рентгенограмме, но имеющие симптомы, связанные с нарушением функции легких.
3. Пациенты с существенными рентгенологическими отклонениями, но без симптомов.
Следует отметить, что стойкие симптомы и аномалии на КТ грудной клетки могут отмечаться в том числе после COVID-19 легкой степени. Так, после выздоровления среди всех пациентов с положительным ПЦР-тестом на SARS-CoV-2, включая бессимптомных, одышка, тахипноэ, гипоксия и/ или «матовое стекло» встречаются у 14% (согласно прогнозу на основании оценок 72 314 случаев в Китае). Среди пациентов, перенесших COVID-19 амбулаторно в легкой степени, симптомы наблюдаются у 26% в течение минимум 2 мес и у 15% – в течение 8 мес (согласно исследованию более 2000 медицинских работников в Швеции). Среди выписанных из стационара пациентов у 39% через месяц отмечалось сохранение симптомов (согласно наблюдательному исследованию 837 пациентов в Великобритании).
После выписки из стационара нарушения функции легких могут сохраняться довольно длительно. Так, в сравнении со здоровым контролем, у таких пациентов выявлялись отклонения в отношении общей емкости легких, форсированной жизненной емкости легких, объема форсированного выдоха, модифицированного индекса Тиффно, диффузионной способности легких по оксиду углерода. Нарушения функции легких и сохранение симптомов после выписки из стационара наблюдались у 50% и более пациентов в первый месяц, у 25,45% – через 3 мес, у 20% – через полгода. В соответствии с данными по SARS у 28% больных тяжелое течение инфекции может предопределить долговременные изменения функции легких через год, у 23,7% – через 2 года.
При выписке из стационара аномальная функция легких может иметь место даже у больных с некритическим течением COVID-19.
Постковидный синдром (Long-COVID, post-acute sequelae of COVID-19, PASC) был внесен в Международную классификацию болезней (МКБ- 10) в конце 2020 г. В начале октября 2021 г. ВОЗ признала, что постковидный синдром не просто выступает остаточным явлением болезни, а сам по себе представляет серьезное состояние. По определению ВОЗ, постковидный синдром – это состояние после COVID-19, возникающее у людей после вероятной или подтвержденной инфекции SARS-CoV-2, обычно через 3 мес от начала COVID-19, и протекающее с симптомами, которые длятся не менее 2 мес и не могут быть объяснены альтернативным диагнозом. Наиболее частые симптомы постковидного синдрома – беспричинная усталость, одышка, затрудненное дыхание, когнитивные расстройства. Они могут как исчезать с течением времени, так и появляться вновь, нося волнообразный характер.
К факторам риска развития постковидного синдрома относят:
1. Пожилой возраст.
2. Повышенный индекс массы тела (ИМТ).
3. Женский пол.
4. Большое число симптомов в остром периоде.
Установлена корреляция между снижением диффузионной способности легких и тяжестью заболевания. Более высокий уровень такой корреляции наблюдается у женщин и пожилых людей.
Постковидный синдром – это еще один вызов как для пульмонологов, так и врачей общей практики. Необходимы новые программы реабилитации, что означает появление новой ветви в исследованиях и поисках эффективной терапии. Постковидный синдром только описан, но нет единого подхода к тому, как бороться с этим состоянием. В настоящее время особенно остра потребность в оперативном распространении опыта и быстром обновлении соответствующих рекомендаций.
Профессор В.Н. Антонов привел клинические примеры для иллюстрации эффективности использования реабилитационных мероприятий.
КОМПЛЕКСНАЯ РЕАБИЛИТАЦИЯ ПОСЛЕ ПЕРЕНЕСЕННОГО COVID- 19: КЛИНИЧЕСКИЙ ПРИМЕР №1
Пациент XYZ, 1952 г.р., был доставлен 01.08.2020 г. в пульмонологическое отделение № 2 ГБУЗ «Областная клиническая больница № 3» г. Челябинска со следующими жалобами:
- повышение температуры тела до 38,5 °С;
- появление одышки в покое;
- общая слабость;
- ограничение физической активности;
- сухой надсадный кашель.
Данные анамнеза: пациент считал себя больным в течение 7–8 дней, когда у него появились вышеуказанные жалобы. Контакты с инфекционными больными отрицал, за границы Челябинской области в последние 14 дней до поступления в стационар не выезжал. Сопутствующее заболевание – гипертоническая болезнь; курильщик, стаж курения более 30 лет, по 1 пачке в день.
Объективные данные: рост 172 см, вес 46 кг, ИМТ = 15,55 кг/м2; цианоз губ; грудная клетка нормостеническая; перкуторный звук – легочный; при аускультации дыхание ослабленное, проводится во все отделы, в средних и нижних отделах рассеянные сухие хрипы, частота дыхательных движений (ЧДД) 26/мин (электронным фонендоскопом); тоны сердца глухие, ритм правильный, частота сердечных сокращений (ЧСС) 90/мин, артериальное давление (АД) 110/72 мм рт.ст.
Данные обследования пациента при поступлении отражены в таблице 1.
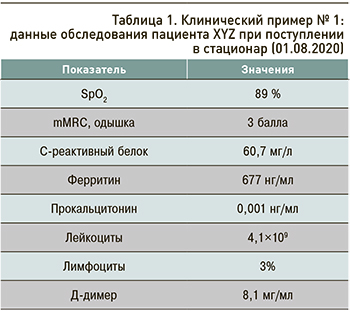
Тест ПЦР на SARS-CoV-2 от 01.08.2020 положительный.
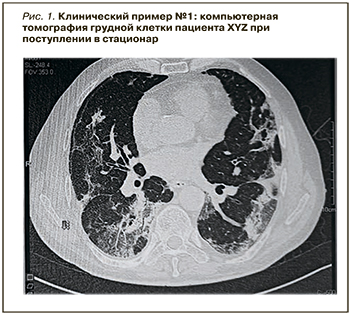
На картине КТ грудной клетки – классические признаки коронавирусной инфекции (рис. 1).
Был сформулирован следующий диагноз:
- U07.1. Новая коронавирусная инфекция COVID-19, вирус идентифицирован, тяжелая форма;
- J12.8. Внебольничная вирусно-бактериальная пневмония, двусторонняя, полисегментарная, тяжелой степени тяжести, КТ-4, дыхательная недостаточность степени 2 (ДН2);
- гипертоническая болезнь стадии 2, артериальная гипертензия степени 1, группа риска 3 (курение, дислипидемия, гиперхолестеринемия).
Пациенту была назначена следующая терапия.
1. Фавипиравир – 200 мг по схеме.
2. Эноксапарин натрия (Клексан) – 1,2 мл/сут подкожно.
3. Ацетилцистеин (Флуимуцил) – 600 мг 2 раза/ сут внутривенно.
4. Дексаметазон – 20 мг внутривенно № 3 со снижением дозы.
5. Эртапенем – 1 г внутривенно капельно 1 раз/ сут.
6. Упреждающая противовоспалительная терапия: олокизумаб (Артлегиа) – 64 мг подкожно однократно.
7. Длительная кислородотерапия.
8. Периндоприл – 2,5 мг 1 раз/сут.
9. Торасемид – 5 мг 1 раз/сут.
Данные обследования пациента на 11.08.2020 приведены в таблице 2.
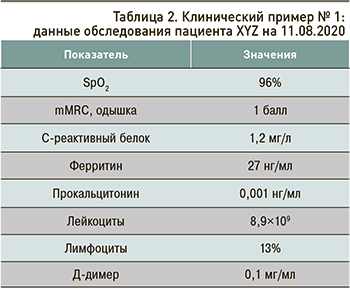
Тест ПЦР на SARS-CoV-2 от 10.08.2020 отрицательный.
На контрольной мультиспиральной КТ сохранялись остаточные изменения легочной ткани, соответствующие поражению при COVID-19, КТ-3.
При выписке пациенту были даны следующие рекомендации.
1. Дыхательная гимнастика.
2. Расширение двигательного режима.
3. Массаж грудной клетки, вибромассаж.
4. Эноксапарин натрия – 0,4 мл подкожно 1 раз/ сут.
5. С целью антифибротической терапии был назначен препарат бовгиалуронидаза азоксимер (Лонгидаза) 3000 МЕ внутримышечно на 2 мл лидокаина, курс – 3 мес.
По истечении 3 мес на картине КТ грудной клетки наблюдалось практически полное восстановление нормальной структуры легочной ткани (рис. 2).

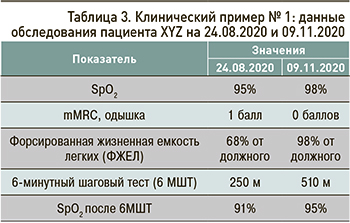
Данные обследования пациента XYZ, проведенного 24.08.2020 и 09.11.2020, отражены в таблице 3.
КОМПЛЕКСНАЯ РЕАБИЛИТАЦИЯ ПОСЛЕ ПЕРЕНЕСЕННОГО COVID- 19: КЛИНИЧЕСКИЙ ПРИМЕР № 2
Пациент ABC, 1953 г.р., был направлен 23.07.2020 в пульмонологическое ГБУЗ «Областная клиническая больница № 3» г. Челябинска со следующими жалобами:
- повышение температуры тела до 38,5 °С;
- появление одышки в покое;
- общая слабость;
- ограничение физической активности;
- сухой кашель.
Данные анамнеза: пациент считал себя больным в течение 7–8 дней, когда появились вышеприведенные жалобы. Контакты с инфекционными больными отрицал, за границы Челябинской области в последние 14 дней до поступления в стационар не выезжал. Сопутствующих заболеваний нет.
Объективные данные: рост 176 см, вес 97 кг, ИМТ 31 кг/м2; кожные покровы чистые, цианоза нет; грудная клетка обычной формы; перкуторный звук – легочный; при аускультации дыхание ослабленное, проводится во все отделы, в средних и нижних отделах рассеянные влажные хрипы, ЧДД 24–26/мин; тоны сердца глухие, ритм правильный, ЧСС 81/мин, АД 115/78 мм рт.ст.
Данные обследования пациента при поступлении отражены в таблице 4.
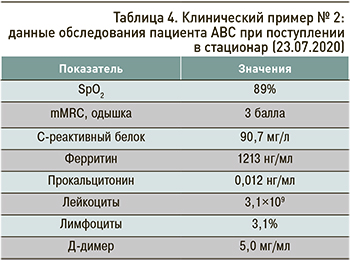
Тест ПЦР на SARS-CoV-2 от 23.07.2020 положительный.
Был сформулирован следующий диагноз:
- U07.1. Новая коронавирусная инфекция COVID-19, вирус идентифицирован, тяжелая форма;
- J12.8. Внебольничная вирусно-бактериальная пневмония, двусторонняя, полисегментарная, тяжелой степени тяжести, КТ-4, ДН2.
Пациенту была назначена следующая терапия.
1. Фавипиравир – 200 мг по схеме.
2. Эноксапарин натрия (Клексан) – 1,2 мл/сут подкожно.
3. Ацетилцистеин (Флуимуцил) – 600 мг 2 раза/ сут внутривенно.
4. Дексаметазон – 20 мг внутривенно № 3 со снижением дозы.
5. Имипенем/ципастатин – 1 г внутривенно капельно 4 раза/сут.
6. Упреждающая противовоспалительная терапия: олокизумаб – 64 мг подкожно однократно
7. Длительная кислородотерапия.
При этом данному пациенту по каким-то причинам не было рекомендовано лечение препаратом Лонгидаза (бовгиалуронидаза азоксимер) после выписки из стационара. Контрольная КТ показала сохранение остаточных явлений, отмечавшихся при выписке (рис. 3).

ЗАКЛЮЧЕНИЕ
Впервые возможная роль препарата Лонгидаза в иммунотерапии пациентов, перенесших COVID- 19, была описана в клиническом руководстве под редакцией М.П. Костинова «Основы иммунореабилитации при новой коронавирусной инфекции (COVID-19)». В этом издании обобщены материалы, которые описывают последствия COVID-19, обусловленные поражением функции бронхолегочной, сердечно-сосудистой, нервной систем и других патологий, и их взаимосвязь с нарушением функционирования иммунной системы. На основе современных данных об иммунопатогенезе SARS-CoV-2 представлены возможные пути коррекции последствий COVID-19 с использованием отечественных лекарственных препаратов в комплексе с иными реабилитационными стратегиями ведения пациентов.
В частности, в этом руководстве подробно описан механизм действия препарата Лонгидаза. Благодаря своей ферментативной активности гиалуронидаза способна расщеплять гликозаминогликаны, составляющие основу межклеточного матрикса соединительной ткани. В результате деполимеризации под действием гиалуронидазы гликозаминогликаны теряют вязкость, способность связывать воду, ионы металлов. Как следствие, увеличивается проницаемость тканей, улучшается их трофика, уменьшаются отеки, улучшается диффузия кислорода в ткани, повышается биодоступность лекарств. Лонгидаза (бовгиалуронидаза азоксимер) подавляет стимуляцию избыточного синтеза компонентов соединительной ткани за счет хелатирующих свойств, связывая ионы железа, меди, гепарин, которые в том числе стимулируют синтез коллагена.
Таким образом можно считать, что накоплена достаточная доказательная база (с учетом опыта зарубежных коллег), позволяющая уверенно применять данный препарат для лечения и реабилитации пациентов с COVID-19. Рутинная клиническая практика подтверждает, что Лонгидаза эффективна и при лечении остаточных изменений, и постковидного синдрома.



