ВВЕДЕНИЕ
Ожирение является одним из наиболее распространенных хронических заболеваний в мире. При этом связанные с ним патологии, такие как сахарный диабет 2-го типа, болезни системы кровообращения, хроническая болезнь почек, вносят основной вклад в рост нетрудоспособности и смертности населения [1]. По данным Всемирной гастроэнтерологической организации, ассоциация ожирения с неалкогольной жировой болезнью печени (НАЖБП) значимо увеличивает показатели смертности от сердечно-сосудистых осложнений [2].
Рост заболеваемости НАЖБП среди лиц трудоспособного возраста обусловлен большим влиянием факторов внешней среды, в то время как роль генетического аспекта в формировании и прогрессировании этого заболевания носит дискутабельный характер. В качестве генов-кандидатов, предрасполагающих к развитию НАЖБП, рассматривают ряд генетических полиморфизмов, участвующих в метаболизме триглицеридов – PNPLA3 (rs738409), жирных кислот – MBOAT7 (rs641738), липидов – HSD17B13 (rs72613567), TM6SF2 (rs58542926) [3]. В России лишь небольшое количество работ посвящено изучению молекулярно-генетических аспектов наследственной предрасположенности к НАЖБП при ожирении. Учитывая же, что одним из важнейших механизмов формирования НАЖБП служит нарушение чувствительности к инсулину, изучение полиморфизма генов, участвующих в формировании инсулинорезистентности и активации воспалительного ответа, видится перспективной темой. В изученной нами литературе представлены немногочисленные работы о вкладе полиморфизма гена матриксных металлопротеиназ ММР12 (rs2276109) и гена PPARG (rs1801282) в развитие сахарного диабета 2-го типа и артериальной гипертензии (АГ) [4, 5], однако их результаты неоднозначны. Таким образом, исследование вовлеченности полиморфизма генов ММР12 (rs652483) и PPARG (rs1801282) в формирование НАЖБП у трудоспособных лиц c ожирением представляет интерес в рамках первичной профилактики метаболических осложнений.
Цель исследования – изучить частоту встречаемости аллельных пар по полиморфным локусам генов матриксных металлопротеиназ ММР12 (rs652483) и гамма-рецептора, активируемого пролифератором пероксисом PPARG (rs1801282), у женщин с ожирением и НАЖБП, оценить взаимосвязь носительства полиморфных локусов с метаболическими параметрами и сопоставить полученные результаты с практически здоровыми женщинами г. Перми.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 100 женщин с ожирением, которые были распределены по группам:
- 1-я группа (n=50) – пациенты без НАЖБП (средний возраст – 43,3±5,6 лет, индекс массы тела 33,9±3,3 кг/м2);
- 2-я группа (n=50) – пациенты с установленной НАЖБП (возраст 45,3±3,2 лет, индекс массы тела 34,5±2,3 кг/м2).
Группу контроля составили 100 здоровых женщин г. Перми (возраст 43,6±5,5 лет, индекс массы тела 22,5±1,6 кг/м²).
Не включались в исследование пациенты с алкогольным поражением печени, вирусными гепатитами, сахарным диабетом, артериальной гипертензией, заболеваниями почек, с уровнем трансаминаз более 3 нормальных значений.
Диагноз НАЖБП ставился на основании клинических рекомендаций EASL–EASD–EASO по диагностике и лечению этого заболевания [2]. Для исключения алкогольной этиологии и дифференциации между алкогольной болезнью печени и НАЖБП использовались апробированные опросники для количественной оценки потребления алкоголя. Стеатоз печени определяли методом ультразвуковой диагностики. Фиброз печени оценивался методом фиброэластографии на приборе Fibrockan-502 (Echosens, Франция) с измерением упругости исследуемых тканей в цифровых показателях (kPa) и оценкой стадии фиброза по шкале МETAVIR (F0 – до 5,8; F1 – 5,9–7,2; F3 – 7,3–9,5 F4 – 9,6–12,5).
Всем пациентам проводилось антропометрическое и общеклиническое обследование в соответствии с рекомендациями по обследованию больных ожирением, оценивался офисный уровень артериального давления. В сыворотке крови методом иммуноферментного анализа на аппарате Stat Fax 2100 (США) определялись уровни инсулина (MonobindInc, Германия), цистатина С (BioVendor, Чехия), инсулиноподобного фактора роста-1 (DRG Diagnostics, Германия, США), моноцитарного хемоаттрактантного протеина-1 (ВекторБест, Россия). За референтные были приняты значения инсулиноподобного фактора роста 1 (ИФР-1) 40–300 нг/мл, инсулина – 2–25 мкЕД/мл, моноцитарного хемоаттрактантного протеина 1 (МСР- 1) – 10–400 пг/ мл. Инсулинорезистентность рассчитывалась по критерию HOMA-IR: НОМА-IR = концентрация инсулина (мкЕД/мл) × концентраця глюкозы (ммоль/л)/22,5.
Согласно национальным рекомендациям, функциональное состояние почек оценивалось путем расчета скорости клубочковой фильтрации (СКФ) по формулам CKD EPI и Hoek. В исследуемых группах в цельной крови выявляли однонуклеотидные полиморфные варианты генов методом аллель-специфической полимеразной цепной реакции на амплификаторе CFХ-96 (Bio-Rad Laboratories Inc., США) с использованием наборов генов ММР12 (rs652483), PPARG (rs1801282) производства ООО «Синтол» (г. Москва) и детекцией продуктов в режиме реального времени. Результаты интерпретировались в зависимости от характера кривых амплификации, отображаемых в программном обеспечении CFX Manager v.3.0 для амплификатора CFX96, с использованием метода аллельной дискриминации.
Для статистической обработки данных использовалась программа STATISTICA 12.0. Для описания соотношения частот генотипов и аллелей исследуемых генов применялся метод χ2. Различия в двух популяциях рассчитывались по отношению шансов (ОШ, OR), которое определялось как отношение вероятности того, что событие произойдет, к вероятности того, что событие не произойдет, с использованием подхода «случай–контроль» для различных моделей наследования. При ОШ ≥1,0 вероятность развития события оценивалась как высокая. Для оценки зависимости количественного (фактор) и качественного (генотип) признаков количественные признаки были преобразованы в качественные по квартильным отклонениям. Сила связи признаков измерялась коэффициентом сопряженности (информативности) Пирсона. Зависимость считалась статистически достоверной при уровне значимости (р) <0,05.
РЕЗУЛЬТАТЫ
В ходе исследования было установлено, что пациенты с ожирением в сочетании с НАЖБП по сравнению с пациентами без НАЖБП имеют более высокий уровень систолического (133,0±12,7 против 116,8±8,4 мм рт.ст.; р=0,005) и диастолического артериального давления (85,1±7,2 против 75,9±5,7 мм рт.ст.; р=0,04). Также между группами были выявлены различия в значениях метаболических параметров (табл. 1).
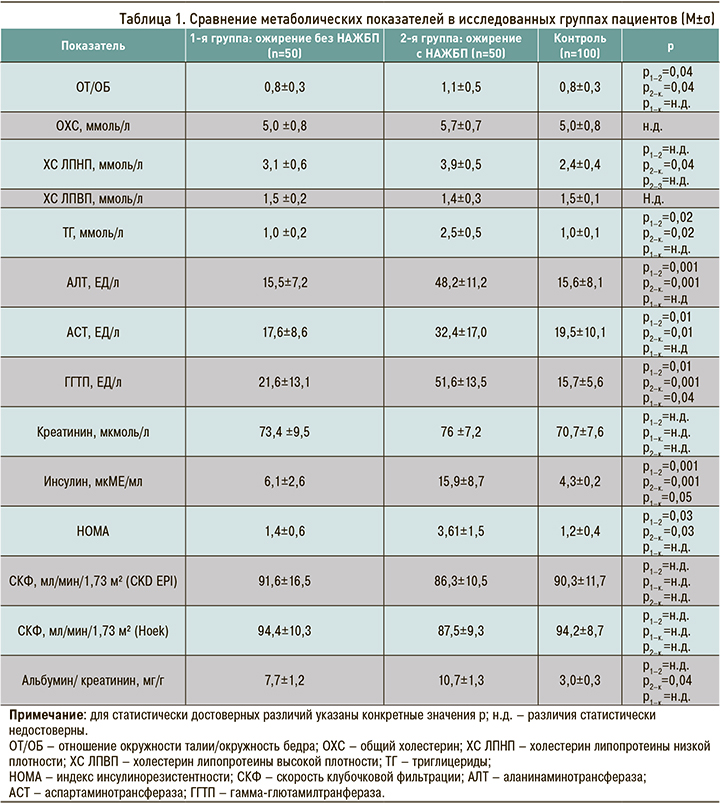
Во 2-й группе пациентов (ожирение с НАЖБП) уровень цистатина C был достоверно выше, чем в 1-й группе (ожирение без НАЖБП) и группе контроля (р=0,01; рис. 1), тогда как между группой контроля и 1-й группой значимых различий установлено не было.

Анализ уровня ИФР-1 показал тенденцию к снижению этого показателя у пациентов с НАЖБП: в этой группе он был достоверно ниже, чем в контроле (р=0,03), при этом значения ИФР-1 оставались в референсном диапазоне в обеих группах наблюдения и в группе контроля (рис. 2).
Уровень МСР-1 в группе ожирения с НАЖБП превышал значения группы в группе ожирения без НАЖБП и контроле (р=0,008 и р=0,001 соответственно). В группе ожирения без НАЖБП МСР-1 был достоверно выше, чем в группе контроля (р=0,02; рис. 3).
В группе пациентов с НАЖБП были установлены ассоциации уровней аланинаминотрансферазы (АЛТ) и аспартаминотрансферазы (АСТ) с САД (r=0,30 и r=0,28), НОМА (r=0,41 и r=0,39), уровнями глюкозы (r=0,39 и r=29), триглицеридов (r=0,59 и r=34), холестерина липопротеидов низкой плотности (r=0,32 и r=0,29), холестерина липопротеидов высокой плотности (r=-0,29 и r=0,3), индексом атерогенности (r=0,34 и 0,41), значениями цистатина С (r=0,36 и r=0,32), МСР-1 (r=0,32 и r=0,32), фиброзом печени по данным фиброэластографии (r=0,46 и r=0,51).
В соответствии с целью исследования нами был проведен анализ частоты распределения полиморфизма гена PPARG (rs1801282) в группах (табл. 2). Полиморфизм гена PPARG (rs1801282) представляет собой однонуклеотидную замену аллеля C на G, что приводит к замене аминокислоты пролин (Pro) на аланин (Ala) в 12 положении белка гамма-рецептора. Аллель G является минорным с частотой MAF=0,07 (MAF Source: 1000 Genomes – http://www.1000genomes.org/node/506).
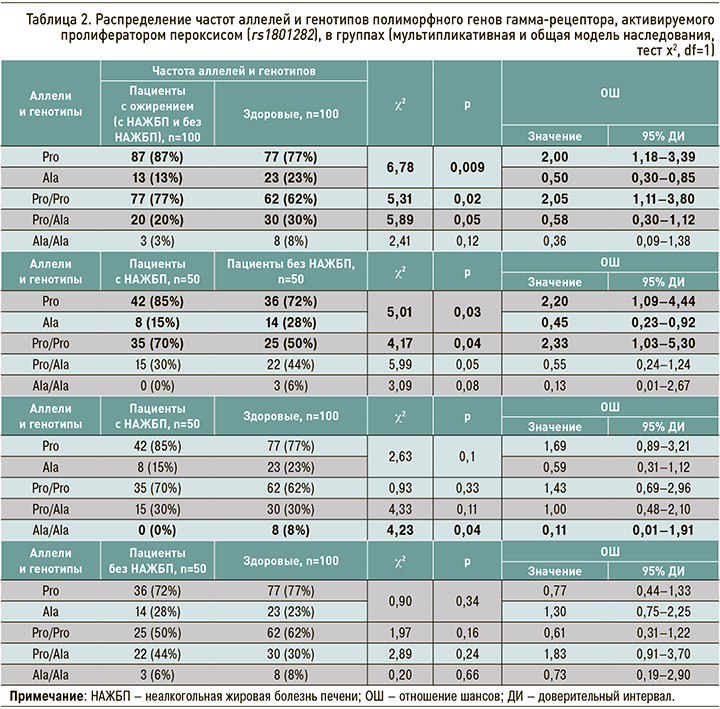
При исследовании полиморфизма гена PPARG, согласно мультипликативной модели наследования, у больных с ожирением (как с НАЖБП, так и без нее) была выявлена более высокая частота генотипа Pro12 Pro по сравнению с группой здоровых респондентов (77 против 62%) и минорного аллеля C (Pro) – 87 против 77% (χ2=6,78; p =0,009; ОШ 2,0; 95% ДИ: 1,18–3,39). Частота аллеля типа G (Ala), напротив, преобладала в группе здоровых респондентов – 23 против 13% у пациентов с ожирением соответственно (χ2=6,78; р=0,009; ОШ 0,50; 95% ДИ: 0,30–0,85), что было связано уменьшением риска развития ожирения и, возможно, НАЖБП в 2 раза. В рецессивной модели наследования установлено, что носительство генотипа Pro12Pro гена PPARG увеличивает вероятность развития ожирения в 2,05 раза (χ2=5,31; р=0,02; ОШ 2,05; 95% ДИ: 1,11–3,80) и, напротив, носительство генотипа Pro12Ala данного гена уменьшает риски развития ожирения и НАЖБП в 1,7 раз (χ2=5,89; р=0,04; ОШ 0,58; 95% ДИ: 0,30–1,12). Анализ мультипликативной модели наследования показал преобладание носительства аллеля Pro в группе больных с ожирением и НАЖБП – 85 против 72% в группе пациентов с ожирением без НАЖБП (χ2=5,01; р=0,03; ОШ 2,20; 95% ДИ: 1,09–4,44). Носительство минорного аллеля G (Ala) гена PPARG в группе ожирения без НАЖБП было достоверно выше, чем в группе ожирения и НАЖБП – 28 и 15% соответственно (χ2=5,01; р=0,03; ОШ 0,45; 95% ДИ: 0,23–0,92), что уменьшало риск развития НАЖБП у больных ожирением в 2,2 раза. Обращает на себя внимание тот факт, что в рецессивной модели наследования в группе НАЖБП превалировало носительство генотипа Pro12Pro – 70% (χ2=4,17; р=0,04; ОШ 1,03–5,30) против 50% в группе ожирения без НАЖБП – с повышением риска развития НАЖБП у больных ожирением практически в 2,5 раза. Интересным представляется преобладание носительства генотипа Ala12Ala у здоровых лиц (группа контроля). В нашем исследовании по данным доминантной модели наследования выявлено, что полиморфизм генотипа Ala12Ala гена PPARG уменьшает риск развития ожирения в 9 раз (χ2=4,23; р=0,04; ОШ 0,11; 95% ДИ: 0,01–1,91).
Исследование показало, что более трети пациентов с НАЖБП имеют начальные признаки фиброза печени по шкале Metavir. Стадия F1 была верифицирована у 32% (n=16) человек, стадии F2 и более в этой группе не выявлялись. Мы провели анализ частоты встречаемости полиморфизма гена PPARG (rs1801282) в группе НАЖБП в зависимости от наличия фиброза печени. Достоверных различий в подгруппах получено не было (рис. 4).
В ходе исследования установлена связь полиморфизма генотипа Ala12Ala гена PPARG с возрастанием уровня ИФР-1 (р=0,024). Также установлена ассоциация носительства генотипа Pro12Pro с увеличением уровня триглицеридов (р=0,018).
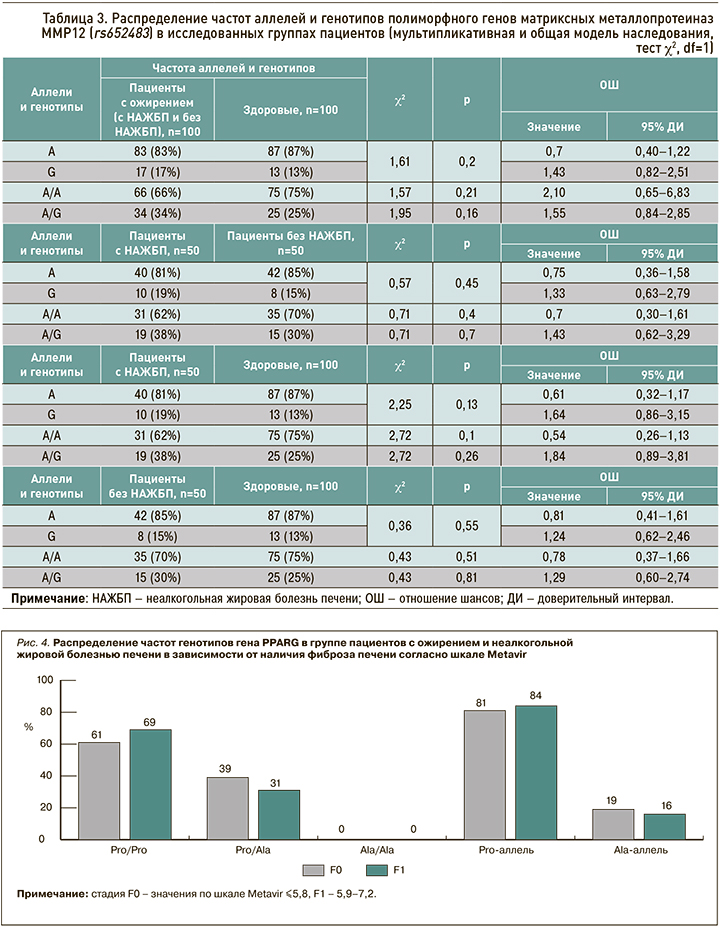
Анализ частоты распределения полиморфизма гена ММР12 (rs652483) в изучаемых группах не выявил достоверных различий между ними по этому показателю (табл. 3).
Отдельное внимание следует обратить на наличие взаимосвязи между носительством полиморфной позиции гена ММР12 с повышением отношения «талия/бедро» (р=0,02), увеличением уровней цистатина C в крови (р=0,01) и МСР-1 (р=0,004).
ОБСУЖДЕНИЕ
Ген PPARG является ключевым транскрипционным фактором регуляции внутриклеточного содержания свободных жирных кислот и адипогенеза. Он экспрессируется во многих клетках организма – макрофагах, миоцитах, эндотелиоцитах, но наиболее выражен в адипоцитах [6]. В ряде исследований показана ассоциация полиморфизма Pro12Ala гена PPARG с интенсивностью липидного метаболизма, что проявляется путем повышения активности ацетил-КоА-синтетазы, интенсификации перекисного окисления липидов и активации пролиферации адипоцитов [6, 7]. Данные литературы свидетельствуют о снижении активации контролируемых геном функций в случае аминокислотной замены, что приводит к снижению транскрипционной активности некоторых генов-мишеней [4], в том числе генов фактора некроза опухоли-альфа, лептина, резистина, адипонектина и ингибитора активатора плазминогена-1, играющих ключевую роль в развитии инсулинорезистентности и хронического воспаления в тканях [7, 8].
Заслуживает внимания редкая частота встречаемости гомозиготы по минорному аллелю как в нашем исследовании, так и в популяции в целом [8]. Данные литературы достаточно противоречивы относительно ассоциации этого полиморфизма гена PPARG с развитием метаболических нарушений [3, 4]. Ряд авторов доказал протективную роль носительства генотипа GG (Ala12Al), связанную с уменьшением инсулинорезистентности, риска развития сахарного диабета 2-го типа и метаболического синдрома (МС); при этом у носителей аллеля С, напротив, отмечался повышенный риск развития метаболического синдрома, ожирения, дислипидемии и артериальной гипертензии [4, 8, 9]. В некоторых работах показана значимая ассоциация носительства G-аллеля полиморфизма PPARG с избыточной массой тела и ожирением в европеоидных выборках Индии и Италии [7, 10]. Наше исследование продемонстрировало снижение риска развития ожирения в 9 раз у носителей генотипа GG (Ala12Al) и уменьшение вероятности развития НАЖБП у больных ожирением в 2,5 раза при носительстве аллеля G. При этом носительство генотипа СС (Pro12Pro) увеличивало угрозу развития ожирения в 2,5 раза, а носительство аллеля C в 2 раза повышало риск развития НАЖБП у пациентов с ожирением.
Известно, что НАЖБП сопровождается избыточным накоплением триглицеридов в гепатоцитах [2, 11]. Ассоциация носительства генотипа Pro/Pro гена PPARG с уровнем триглицеридов (р=0,018), полученная в нашем исследовании, указывает на вклад этого полиморфизма в развитие дислипидемии. Интерес исследователей вызывают особенности секреции ИФР-1 у больных с метаболическим синдромом и заболеваниями печени. ИФР-1 синтезируется преимущественно печенью в ответ на стимуляцию соматотропным гормоном (СТГ). Реализуя эффекты СТГ, ИФР-1 также обладает собственной активностью – анаболической, антиоксидантной, противовоспалительной и цитопротекторной [12]. Секреция ИФР-1 может снижаться в результате нарушения синтетической функции печени, в том числе у пациентов с НАЖБП в сочетании с сахарным диабетом 2-го типа [13, 14]. В нашей работе было выявлено снижение уровня ИФР-1 в группе пациентов с ожирением и НАЖБП относительно группы контроля. Наибольшую важность представляет установленная нами связь полиморфизма гена PPARG (Ala/Ala) c уровнем ИФР-1 (р=0,024). Существует вероятность, что значительное снижение риска ожирения у носителей полиморфизма PPARG (Ala/Ala) опосредовано через регуляцию синтеза ИФР-1, увеличение которого приводит к усилению липолиза и снижает инсулинорезистентность.
У больных с ожирением доказана роль системного воспаления в формировании НАЖБП и метаболических нарушений [11]. Одним из потенциальных генетических факторов риска развития эндотелиальной дисфункции в женской популяции является полиморфизм матриксных металлопротеиназ [15, 16]. ММР12 – член семейства матриксных металлопротеиназ, разрушающих внеклеточный матрикс. Повышенная экспрессия ММР12 часто ассоциирована с усилением воспалительного ответа, сосудистого ремоделированиия, нарушением дифференцировки адипоцитов и развитием артериальной гипертензии и инсульта [17, 18]. В исследовании М.И. Москалено с соавт. (2020) было обнаружено увеличение риска развития артериальной гипертензии у женщин с носительством аллеля G [5]. В нашем исследовании различий частоты встречаемости носительства аллеля G в группах пациентов с ожирением + НАЖБП и ожирением без НАЖБП выявлено не было.
Исследования ряда авторов показали, что одним из ведущих молекулярных маркеров повреждения эндотелия сосудистого русла и активации системного воспаления служит МСР-1 [19]. В нашем исследовании его уровень у больных с НАЖБП был достоверно выше, чем в группе ожирения без метаболических осложнений и у здоровых респондентов, что свидетельствует об инициации воспалительного ответа и дисфункции эндотелия.
Цистатин С является ингибитором цистеиновых протеиназ, который синтезируется всеми ядросодержащими клетками, в том числе клетками жировой ткани. В ряде работ было продемонстрировано, что уровень цистатина С может выступать неблагоприятным маркером развития метаболических осложнений у больных с ожирением [20]. Литературные данные указывают, что по мере прогрессирования фиброза печени у больных с вирусными гепатитами В и С уровень цистатина С повышается, что позволяет рассматривать его как возможный неинвазивный сывороточный маркер фиброза, связанный с нарушением функционирования клеток соединительной ткани [21]. В ходе нашего исследования было установлено, что в группе НАЖБП уровень цистатина С был значимо выше, чем в группе ожирения и у здоровых респондентов, при этом различий в значениях расчетной СКФ во всех исследуемых группах получено не было.
В проведенном исследовании носительство полиморфизма ММ12 было ассоциировано с увеличением отношения ОТ/ОБ, уровней МСР-1 и цистатина С в плазме крови. Полученные данные могут свидетельствовать о значении носительства полиморфизма гена ММ12 в развитии системного воспалительного ответа у пациенток с абдоминальным ожирением и, возможно, в формировании ранней ренальной дисфункции.
ЗАКЛЮЧЕНИЕ
1. В женской популяции носительство полиморфизма гена PPARG (rs1801282) генотипа G/G (Ala12Al) уменьшает риск развития ожирения и метаболических нарушений, тогда как присутствие генотипа С/С (Pro12 Pro) и аллеля С, напротив, увеличивает этот риск.
2. Носительство полиморфизма гена ММР 12 (rs 652438) у женщин вероятно связано с развитием абдоминального ожирения, системного воспалительного ответа и метаболической болезни почек.



