ВВЕДЕНИЕ
Хроническая обструктивная болезнь легких (ХОБЛ) является одной из ведущих причин заболеваемости и смертности в современном обществе и представляет собой значительную экономическую и социальную проблему. В европейской популяции показатель ее распространенности у лиц старше 40 лет составляет 10%, старше 70 лет – 20%. По данным исследования GARD (2014), частота встречаемости ХОБЛ в России у лиц с респираторными симптомами достигает 21,8%, в общей численности населения – 15,3%. При этом наблюдается неуклонный рост смертности от этого и других хронических заболеваний легких, что связано с демографическими факторами, ухудшающейся экологией, изменением образа жизни. По прогнозам экспертов ВОЗ, к 2030 г. ХОБЛ будет занимать 4-е место среди «других причин смертности» [1].
В настоящее время нет «золотого стандарта» прогнозирования течения ХОБЛ и четких указаний на то, как установить факторы, определяющие летальный исход в ближайшие 12 мес. Легко измеримые физиологические параметры не всегда взаимосвязаны со смертностью [2]. Клинические предикторы выживаемости часто неточны, поэтому повышение точности прогнозирования выживаемости является актуальной задачей. Был определен ряд параметров, которые могут быть использованы в прогнозировании течения ХОБЛ в дополнение к выраженности бронхообструкции, служащей исторически признанным прогностическим маркером. Разработаны различные индексы, объединяющие ряд переменных, однако ни один из них не получил широкого распространения в клинической практике. Отчасти это связано с тем, что некоторые из этих параметров не регистрируются во время рутинных визитов к врачу. Наиболее достоверные прогностические показатели у больных ХОБЛ – это индекс BODE, объем форсированного выдоха за первую секунду (ОФВ1), индекс одышки MRC и 6-минутный шаговый тест [3].
Сердечно-сосудистые заболевания (ССЗ) до сих пор остаются важной проблемой современного здравоохранения. По данным различных регистров и исследований, частота выявления у больных ССЗ сопутствующей ХОБЛ варьирует от 6 до 60%. Сочетанное течение ХОБЛ и ССЗ характеризуется неблагоприятным прогнозом, повышением риска смерти от инфаркта миокарда (ИМ).
Цель исследования – выявить факторы риска неблагоприятных исходов у больных ХОБЛ в течение 12 мес после госпитализации по поводу ее обострения.
МАТЕРИАЛ И МЕТОДЫ
Методом сплошной выборки под наблюдение были взяты 103 пациента с ХОБЛ, проходивших стационарное лечение в ГУЗ «Областная клиническая больница» г. Саратова (табл. 1). Все участники, включенные в исследование, подписали информированное согласие. Через 12 мес после включения была проведена оценка развития неблагоприятных исходов путем телефонного контакта с больными (или их родственниками). Оценивались такие конечные точки, как декомпенсация хронической сердечной недостаточности (ХСН), сердечно-сосудистые события (ИМ, нестабильная стенокардия, инфаркт головного мозга), летальный исход.
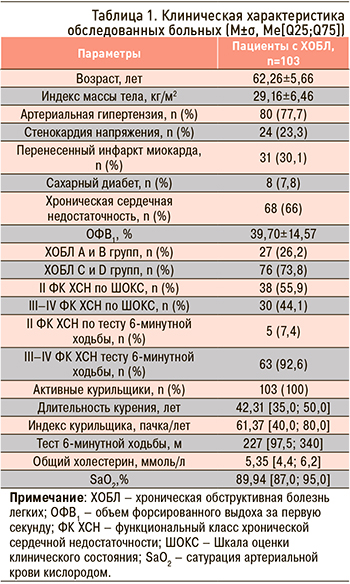
Критериями декомпенсации ХСН служили следующие признаки: усиление одышки при невозможности занимать горизонтальное положение, появление отеков нижних конечностей, назначение и эффективность проводимой терапии петлевыми диуретиками, подтверждение врачом по месту жительства или в стационаре декомпенсации ХСН, госпитализация по поводу обострения ХСН, подтвержденная документально.
В исследование включались пациенты с ХОБЛ (диагностированной согласно рекомендациям GOLD) мужского пола в возрасте старше 40 и менее 80 лет. Критерием невключения являлось наличие у пациента нестабильной ишемической болезни сердца (ИМ, острый коронарный синдром) и острого нарушения мозгового кровообращения менее чем за 3 мес до включения в исследование, пороков сердца, миокардита, кардиомиопатии, неконтролируемой артериальной гипертензии, других респираторных заболеваний, онкологических заболеваний.
Для оценки функционального класса (ФК) ХСН использовалась Шкала оценки клинического состояния (ШОКС) в модификации В.Ю. Мареева (2000) и тест 6-минутной ходьбы. Участникам выполнялось биохимическое исследование крови в соответствии со стандартами оказания медицинской помощи при ХОБЛ. Также проводилось определение уровней N-концевого фрагмента натрийуретического пептида (NT-proBNP) с использованием набора реагентов NT-proBNP (BIOMEDICA, Словакия), галектина-3 (Human Galectin-3 Platinum ELISA производства BenderMedSystemsGmbH, Австрия), высокочувствительного С-реактивного белка (вч-СРБ) с помощью реагентов CRP U-hs (DiaSys, Германия), белков, связывающих жирные кислоты (сБСЖК), с применением набора реагентов БСЖК-ИФА-БЕСТ (ЗАО «Вектор-Бест», Россия).
Артериальную жесткость определяли с помощью артериографа Tensioclinic (Tensiomed, Венгрия). Оценивались систолическое и диастолическое артериальное давление (САД и ДАД), число сердечных сокращений (ЧСС), пульсовое АД, скорость пульсовой волны в аорте (СРПВ), брахиальный и аортальный индекс аугментации (ИА), центральное давление в аорте (SBPao), площадь систолического и диастолического компонента пульсовой волны.
Также пациентам проводилось суточное мониторирование артериальной ригидности и АД с применением аппарата BPLab МнСДП-2 («Петр Телегин», Россия). Исследования выполнялись в течение 24 ч. Для оценки жесткости сосудистой стенки использовали СРПВ, индекс ригидности артерий (Arterial Stiffness Index, ASI), индекс аугментации (augmentation index, Aix), время распространения пульсовой волны (Pulse Transit Time, PTT2), максимальную скорость нарастания АД (dP/dt max).
Наличие коморбидной патологии учитывали с помощью индекса Чарльсона (the Charlson Comorbidity Index, CCI), который включает 19 медицинских состояний. Суммарное значение индекса может варьировать от 0 до 37 баллов.
Эхокардиография (ЭхоКГ) проводилась на комплексе Acuson 128 XP/10 с использованием М-модального режима, двухмерного (В) режима по общепризнанной методике.
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России.
В рамках статистического анализа полученные результаты обследований вносили в базу данных, насчитывающую 413 переменных для каждого пациента. Для статистической обработки материала использовались методы описательной статистики. В случае нормального распределения для обработки непрерывных данных применялся t-тест для независимых выборок. При анализе данных, отличных от нормального распределения, использовались непараметрические методы. Различия между значениями показателей признавались достоверными при уровне р <0,05. Для сравнения частот бинарного признака в двух несвязанных группах применялся критерий χ2. Для изучения взаимосвязей между различными показателями выполнялся корреляционный анализ. Коэффициент корреляции r считался достоверным при уровне р <0,05.
Для описания признаков использовали следующие формы: если распределение нормальное, то данные представлялись в виде M±SD, где М – среднее арифметическое, SD – стандартное отклонение; если распределение отличное от нормального, тогда результаты представлялись как Me [Q1; Q3], где Ме – медиана, Q1 и Q3 – первый и третий квартили соответственно. Для статистической обработки полученных данных применялся пакет прикладных программ STATISTICA 8.0 (StatSoftInс., США).
Ограничения данного исследования определяются относительно небольшой длительностью наблюдения и количеством включенных пациентов.
РЕЗУЛЬТАТЫ
Через один год у 28 (27,2%) пациентов с ХОБЛ развилась сердечная недостаточность, у 13 (12,6%) – сердечно-сосудистые осложнения, 8 (7,8%) больных умерли. Основными причинами смерти пациентов с ХОБЛ стали дыхательная недостаточность (n=3) и сердечно-сосудистые осложнения (n=4), один пациент умер от злокачественного новообразования.
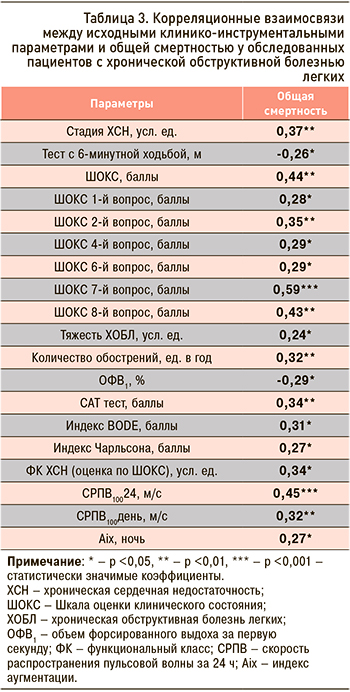
Для определения прогноза неблагоприятных исходов был осуществлен анализ изученных параметров у больных в зависимости от развития у них конечных точек (табл. 2, 3).
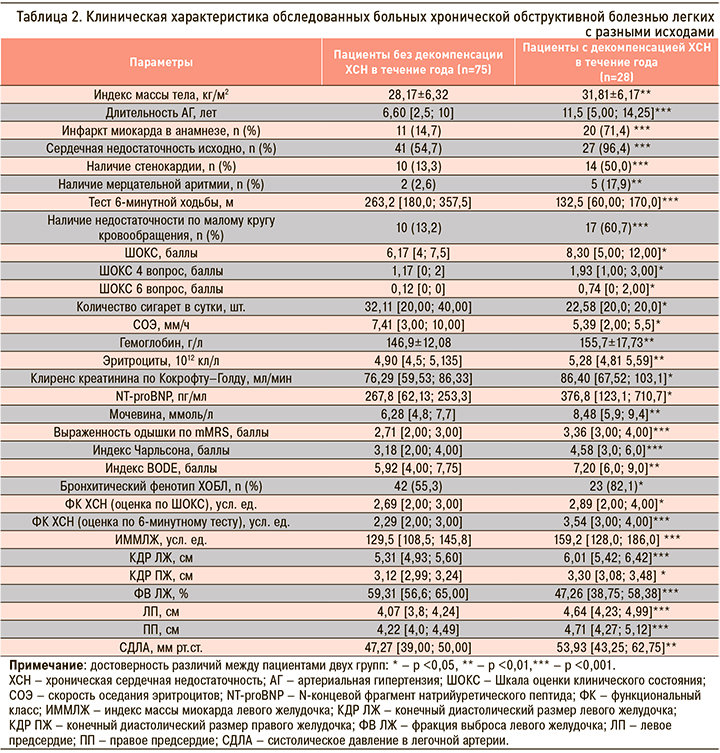
В группу риска по развитию декомпенсации ХСН в течение ближайших 12 мес вошли пациенты с преимущественно бронхитическим фенотипом ХОБЛ, повышенной массой тела, длительностью артериальной гипертензии более 10 лет, ИМ в анамнезе, стенокардией, имеющие проявления декомпенсации по малому кругу кровообращения, ФК ХСН 3–4, индекс коморбидности Чарльсона более 4 баллов, индекс BODE более 7 баллов, повышенные уровни эритроцитов, гемоглобина, мочевины, NT-proBNP (>350 пг/мл). Наиболее значимыми параметрами эхокардиографии являются увеличение размеров (дилатация) левого желудочка (ЛЖ), левого и правого предсердий, снижение фракции выброса (ФВ) ЛЖ менее 45% и наличие легочной гипертензии (систолическое давление в легочной артерии выше 50 мм рт.ст.).
Развитие сердечно-сосудистых осложнений у пациентов с ХОБЛ взаимосвязано с повышением NT-proBNP (r=0,32, p <0,05) и повышением СРПВ в аорте (r=0,27, p <0,05). Увеличение СРПВ более 10 м/с было выявлено у 46,6% пациентов без сердечно-сосудистых осложнений и у 92,3% больных с развившимися в течение года сердечно-сосудистыми событиями (p <0,01). Других значимых прогностических факторов у пациентов данной группы установлено не было.
Увеличение общей смертности ассоциировано с выраженностью сердечной недостаточности (стадия, ФК по ШОКС), ограничением физической активности (тест с 6-минутной ходьбой), тяжестью ХОБЛ (ОФВ1, количество обострений за прошедший год, сумма баллов по САТ, значение индекса BODE), наличием коморбидной патологии (индекс Чарльсона), повышенной жесткостью сосудистой стенки (СРПВ за сутки, день, AIx за ночь). Обнаружена взаимосвязь общей смертности с большим значением баллов по школе ШОКС при ответе на вопросы 1 (выраженность одышки), 4 (положение в постели), 2 (изменение веса за последнюю неделю), 6 (хрипы в легких), 7 (наличие ритма галопа), 8 (увеличение печени).
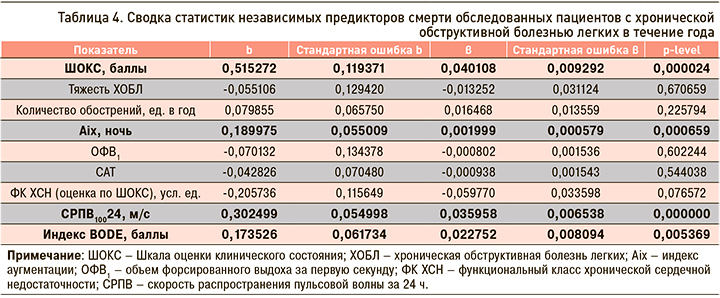
Для проведения логистического регрессионного анализа нами были отобраны предикторы, значимо связанные с зависимой переменной – летальным исходом. После пошагового множественного регрессионного анализа значимыми предикторами смерти пациентов с ХОБЛ в течение первого года после ее обострения оказались выраженность ХСН (количество баллов по ШОКС), тяжесть ХОБЛ (индекс BODE) и повышение артериальной ригидности (СРПВ за сутки, ночной AIx; табл. 4).
ОБСУЖДЕНИЕ
Выявление факторов риска неблагоприятных исходов у больных ХОБЛ является актуальной задачей, решение которой позволяет своевременно оценить риск развития того или иного неблагоприятного исхода и принять меры для его предотвращения. Целью нашей работы стало определение взаимосвязи изученных клинико-инструментальных параметров у пациентов с ХОБЛ и развитием декомпенсации ХСН, сердечно-сосудистых катастроф и летального исхода.
В предыдущие годы риск смерти больных ХОБЛ обычно определялся одним физиологическим параметром – ОФВ1, который показал себя хорошим маркером прогрессирования заболевания и смертности [1, 4]. Однако проведенные ранее исследования установили, что к факторам риска смерти пациентов, госпитализированных с обострением ХОБЛ, относятся старший возраст, мужской пол, более низкий индекс массы тела (ИМТ), тяжелая одышка и более низкий уровень сознания [5–11]. В нашем исследовании возраст, пол, ИМТ не продемонстрировали свою значимость, что может быть обусловлено особенностями обследованных пациентов (преимущественно старший возраст, все пациенты мужского пола). В то же время, как и в ряде предыдущих работ [12–14], нами была подтверждена значимость ОФВ1 и частоты предшествующих обострений ХОБЛ в качестве факторов риска смерти пациентов. Обострение как неблагоприятный фактор прогноза пациентов с ХОБЛ привлекает внимание пульмонологов в последнее десятилетие, а фенотип ХОБЛ с частыми обострениями представляет собой наиболее сложную для ведения и лечения группу больных. В работе Prudente R. (2018) установлено, что частота обострений в предшествующие 3 года значимо повышает риск смерти (отношение рисков (ОР) 1,32; 95% доверительный интервал (ДИ): 1,00–1,76; p=0,04). Также в этой работе была показана неблагоприятная прогностическая значимость индекса BODE, что совпадает с полученными нами в данной работе и ранее результатами [11, 15].
Необходимо отметить, что одногодичная смертность в исследуемой нами популяции была не очень велика (умерло 8 больных), что, конечно, определяет некоторые статистические результаты. В частности, мы не выявили взаимосвязи неблагоприятного исхода с наличием ишемической болезни сердца (ИБС) и выраженностью гипоксемии – хорошо известными факторами риска смерти пациентов с ХОБЛ. Об отсутствии взаимосвязи между наличием ИБС и риском смерти у больных ХОБЛ указывали и некоторые другие авторы. Авторы объясняли выявленные данные тем, что такие пациенты находятся под наблюдением кардиологов, получают дополнительную кардиальную терапию, им проводится более тщательный мониторинг состояния [16]. В то же время нами подтверждено независимое прогностическое влияние индекса BODE и впервые установлена роль повышения артериальной ригидности (СРПВ100 за сутки) как маркера повышения риска смерти пациентов с ХОБЛ.
Коморбидные с ХОБЛ заболевания, включая легочные и внелегочные сопутствующие патологии, также повышают риск смерти пациентов с ХОБЛ [9, 11, 12, 17, 18]. Что касается внелегочных сопутствующих заболеваний, то сердечная недостаточность, сердечно-сосудистые и цереброваскулярные заболевания, болезни печени и почек рассматриваются в качестве независимых предикторов смерти пациентов с обострением ХОБЛ [9, 12, 14, 18]. Наше исследование также продемонстрировало, что сопутствующие заболевания, в частности, наличие и выраженность ХСН, были предикторами смерти пациентов с ХОБЛ; это необходимо учитывать при ведении больных с коморбидной патологией. ХСН относится к числу известных факторов риска неблагоприятного прогноза при ХОБЛ. В нашей работе также показана роль кардиореспираторной коморбидности в формировании декомпенсации сердечной недостаточности, прежде всего при наличии перенесенного ИМ, что совпадает с данными других авторов [19, 20]. Так, в работе А.Г. Арутюнова с соавт. (2015) у каждого третьего больного, госпитализированного с острой декомпенсацией сердечной недостаточности, имелось 3 и более заболевания [19].
Как уже говорилось, в нашей работе у пациентов определялись уровни NT-proBNP, галектина-3, вч-СРБ, сБСЖК. Ни один из этих маркеров не показал своей прогностической значимости в плане выживаемости у больных ХОБЛ. Эти данные отличаются от результатов исследований некоторых авторов, возможно, из-за меньшего количества больных и меньшей длительности наблюдения. Так, в исследовании Campo G. et al. (2015), метаанализе Pavasini R. (2016) показано, что уровень NT-proBNP служит независимым предиктором общей смертности пациентов с ХОБЛ [10, 21], а в работе Sato M. et al (2017) выявлена негативная роль повышенного уровня сБСЖК в отношении развития неблагоприятных исходов (помимо смерти, учитывались острая дыхательная недостаточность, необходимость респираторной поддержки и т.д.) при обострениях ХОБЛ [22].
В то же время нами установлено, что развитие сердечно-сосудистых осложнений у пациентов с ХОБЛ взаимосвязано с повышением NT-proBNP. Это также подтверждает данные, полученные Campo G. et al. [10].
Также у больных с сочетанием ХОБЛ и ХСН выявлена значимость дилатации правого и левого предсердий, левого желудочка в качестве факторов риска декомпенсации сердечной недостаточности в течение ближайших 12 мес. По результатам нашего исследования, не было отмечено взаимосвязи между СРПВ и частотой декомпенсации ХСН у пациентов с ХОБЛ и ХСН, что отличается от результатов Кошелевой Н.А. (2011) [23].
Развитие кардиоваскулярных осложнений и летального исхода у пациентов с ХОБЛ ассоциировано с повышением артериальной ригидности (СРПВ), что подтверждается данными других авторов о значении повышенной жесткости сосудистой стенки в увеличении сердечно-сосудистого риска [24, 25]. Имеющиеся в настоящий момент данные позволяют говорить об артериальной ригидности как полноценном независимом факторе риска развития неблагоприятных сердечно-сосудистых событий у пациентов с АГ, терминальной хронической почечной недостаточности, сахарным диабетом и у пожилых людей. В последние годы появились исследования, свидетельствующие о предиктивной значимости артериальной ригидности в общей популяции.
ЗАКЛЮЧЕНИЕ
Полученные в нашем исследовании результаты позволяют определить факторы, ассоциированные с неблагоприятными исходами у пациентов с ХОБЛ. Ведение больных, входящих в группу риска, требует от врача повышенного внимания в плане развития неблагоприятных осложнений.



