Дисплазия соединительной ткани (ДСТ) – одно из самых распространенных патологических состояний в практике врача-педиатра, которое, по данным ряда авторов, встречается с частотой от 30 до 80% [1, 2]. Оно представляет собой гетерогенную группу заболеваний cоединительной ткани полигенно-многофакторной природы, объединенных в фенотипы на основе общности внешних и/или висцеральных признаков [3].
ДСТ характеризуется многообразием клинических проявлений – от доброкачественных субклинических форм до полиорганной и полисистемной патологии, нередко с прогредиентным течением, которая не соответствует ни одному из известных моногенных заболеваний соединительной ткани. В связи с этим внимание отечественных ученых в последние годы направлено на изучение влияния ДСТ на течение многих заболеваний [4–7]. Проблема ДСТ значима для врачей практически всех специальностей, так как клинические проявления соединительнотканных нарушений настолько разнообразны, что специалист зачастую затрудняется интегрировать множество отдельных симптомов и не способен увидеть за ними единую системную патологию [8]. Подчас такие пациенты наблюдаются у специалистов разного профиля, каждый из которых назначает свое лечение, которое во многих случаях оказывается несвоевременным, а нередко и малоэффективным. Таким образом, тактика ведения детей с ДСТ должна определяться ранней диагностикой у них маркеров соединительнотканных нарушений; это позволит своевременно профилактировать развитие возможных осложнений и замедлять прогредиентность течения этой патологии. Все это определяет актуальность разработки новых неинвазивных и точных методов диагностики ДСТ у детей.
Цель исследования – оценить состояние костной ткани по данным микроскопического исследования зубов у детей и определить возможные маркеры прогрессирования у них ДСТ.
МАТЕРИАЛ И МЕТОДЫ
На первом этапе исследования в Областной детской клинической больнице г. Омска в 2018 г. проводился отбор детей с ДСТ среди обратившихся за медицинской помощью. Для первичной диагностики ДСТ у пациентов использовался критический порог стигматизации – наличие ≥6 фенотипических признаков этой патологии [9]. С учетом выбранных критериев включения было выделено 47 детей с ДСТ в возрасте от 6 до 9 лет.
У всех обследуемых оценивался перинатальный анамнез, особенности состояния здоровья в разные возрастные периоды на основании клинических данных и результатов стандартных обследований, а также этапность формирования признаков ДСТ при анализе амбулаторной карты. Кроме того, всем детям проводилось клиническое и лабораторно-инструментальное обследование (общий анализ крови и мочи, ультразвуковое исследование органов брюшной полости, ЭКГ и ЭхоКГ).
На основе полученных данных проводилось комплексное определение степени тяжести ДСТ в соответствии с оценочной таблицей фенотипических и висцеральных маркеров этой патологии [9]. По ее результатам 47 пациентов с ДСТ были определены в I группу: 35 человек – дети с умеренной ДСТ и 12 человек с выраженной формой. Обследование проводилось также у здоровых детей с низким порогом стигматизации – менее 6 признаков ДСТ. Они сформировали II (контрольную) группу (n=20).
Наряду с этим у детей обеих групп проведена оценка состояния костной ткани по данным атомно-силовой микроскопии (АМС) непостоянных зубов на базе кафедры судебной медицины, правоведения Омского государственного медицинского университета [10]. Исследование проводилось на 25 образцах молочных зубов детей с ДСТ (I группа) и 15 образцах, взятых у детей без признаков ДСТ (II группа). Осмотр образцов осуществлялся на оптическом микроскопе марки Olympus jx 41 с тысячекратным увеличением, при этом изучалось микроскопическое строение костной ткани и эмали зубов нижней челюсти. Ультраструктурное строение изучалось с использованием сканирующего зондового микроскопа Solver Pro (NT – MPT, Россия). Анализ образцов АСМ-изображения осуществлялся с использованием программного модуля обработки изображения Image Analysis NT – VDT. По цифровым снимкам эмали зубов проводился анализ степени упаковки и формы эмалевых призм, определялись размеры эмалевых призм и межпризменного промежутка, а также его высота и размер оболочки эмалевых призм.
Статистическая обработка полученных данных проводилась с использованием программы Statistica 6. Значимой являлась предельная ошибка р <0,05 при расчете χ2-критерия сравнения (хи-квадрата).
РЕЗУЛЬТАТЫ
В ходе проведенных исследований нами выявлено отягощение антенатального периода в группе детей с признаками ДСТ. Так, в структуре осложнений беременности у женщин I группы в 23,7% случаев отмечалось многоводие, в 11,9% – низкая плацентация, в 10,5% – плодово-плацентарная недостаточность, в 15% – пуповинный комплекс; при этом у 90,4% женщин II группы отмечалось физиологическое течение беременности (р <0,05). Кроме того, у матерей детей с ДСТ достоверно чаще определялась внутриутробная гипоксия плода – в 15,8% случаев.
При оценке особенности течения родов выявлено, что дети с ДСТ достоверно чаще рождались путем кесарева сечения – в 33,3% случаев, с применением вакуум-экстракции – в 7% и эпизиотомии – в 20%, в то время как дети без ДСТ в 81% случаев были рождены физиологическим путем (p <0,05).
Состояние здоровья детей основной и контрольной групп в неонатальный период оценивалось по шкале Апгар. У детей в момент рождения оценка была наименьшей в I группе – в среднем 7,8 баллов, что указывало на гипоксию в родах. Во II группе оценка по шкале Апгар составляла в среднем 8,6 баллов. При анализе особенностей состояния здоровья новорожденных детей от женщин с ДСТ в раннем неонатальном периоде установлено преобладание церебральной ишемии 2–3 ст. – в 63% случаев, асфиксии – в 11%, задержка внутриутробного развития– в 9% (p <0,05). Дети от женщин без ДСТ достоверно чаще рождались здоровыми, хотя у них также определялась церебральная ишемия (48%), но легкой степени, и неврологическая симптоматика купировалась уже к 7-му дню жизни.
При оценке параметров физического развития средние значения антропометрических данных у новорожденных I группы в большинстве своем были меньшими по сравнению со II группой: масса тела – 3110 против 3300 г; длина тела – 50,4 против 52,0 см; окружность головы – 34,5 против 35,0 см. Одинаковыми оказалась окружность груди – 34 см (p <0,05).
Маркеры ДСТ определялись только у детей, рожденных от женщин с ДСТ: нежная, бархатистая кожа – 50%, кривошея – 10%, дисплазия тазобедренных суставов – 60%, пупочные и паховые грыжи – 40% (р <0,05).
При динамическом наблюдении за детьми обеих групп в декретированные сроки было выявлено, что на 3-м и 6-м месяцах жизни масса и длина тела большинства исследуемых детей соответствовала 4-му коридору. Однако у 37% детей I группы физические параметры соответствовали 3-му коридору, в то время как у 48% детей контрольной группы физическое развитие было выше среднего (p <0,05).
Показатели массы тела к 1,5 годам у детей I группы достоверно чаще соответствовали 2-му и 3-му коридорам, тогда как показатели роста у 40 % детей были средними, и у 50% детей соответствовали 5-му коридору, что свидетельствовало о дисгармоничности физического развития детей основной группы. Кроме того, у детей, имеющих ДСТ, с 1,5 до 3 лет уже сформировались диагностически значимые маркеры ДСТ, включая малые аномалии сердца: множественные эктопически крепленные хорды – 70%, гиперэластичность кожи – 40%, истончение кожи – 37,5%, плоскостопие – 30%, вальгусная установка стоп – 40%, деформация грудной клетки в виде вдавления в области мечевидного отростка – 50%, умеренная гипермобильность суставов – 20%, аномалии прорезывания зубов – 10% (p <0,05).
К возрасту 6–9 лет отмечалось прогрессирующее течение ДСТ у детей I группы с вовлечением новых органов и систем организма. Среди локомоторных и висцеральных признаков ДСТ в исследовании наиболее часто встречались нарушение осанки – 56% случаев, умеренный гипермобильный синдром – 18%, нарушение функции желудочно-кишечного тракта по типу гастроэзофагального рефлюкса и дисфункции желчного пузыря – 50%, вегетативные расстройства – 74%, нарушение зрения с преобладанием миопии – 48%, аритмогенный синдром (тахи- и брадиаритмии) – 62%, клапанный синдром в виде миксоматозных изменений митрального клапана с его формирующимся пролапсом – 36% (p <0,05).
Проведенные исследования образцов молочных зубов у детей основной и контрольной групп также выявили преобладание патологических изменений эмали зубов у детей с признаками ДСТ.
По качественным характеристикам эмалевых призм у лиц без патологии соединительной ткани (n=15) отмечалось постоянство структуры в виде упорядоченных шестигранных и даже семигранных, с аркообразными формами, эмалевых призм. В исследуемой группе с патологией соединительной ткани (n=25) призмы располагались хаотично, имели и пятигранную и шестигранную структуру с разнообразными формами в виде различных геометрических фигур (рис. 1, 2).
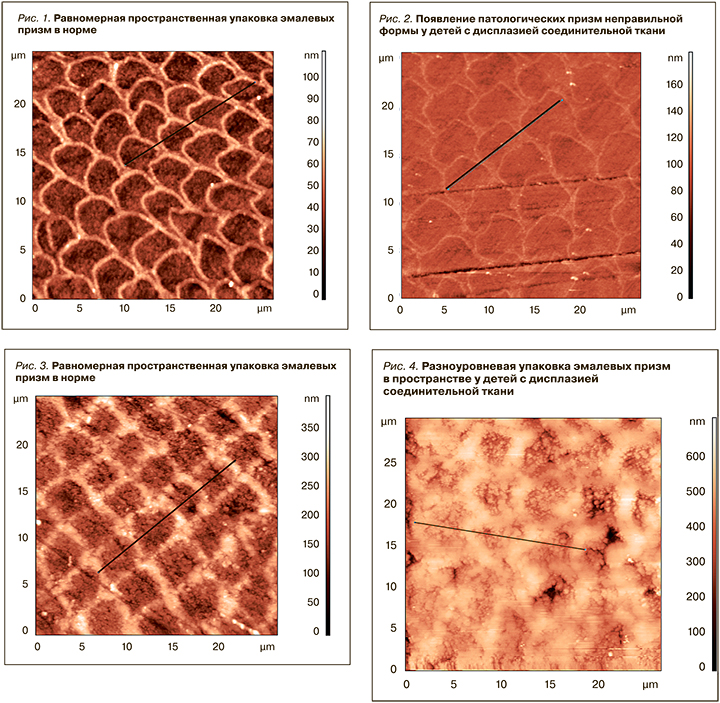
При зондовой микроскопии эмали зубов на нижней челюсти видно, что у лиц с патологией соединительной ткани эмалевые призмы отличаются меньшими размерами как в горизонтальной, так и вертикальной плоскостях. Параллельно этому следует уменьшение эмалевых призм в единице объема, что говорит о менее плотной их упаковке. Достоверное увеличение расстояния между эмалевыми призмами, увеличение высоты межпризменного промежутка у данной категории пациентов говорит об увеличении общей доли органического вещества в полностью прорезавшихся зубах. Величина оболочки эмалевой призмы у лиц с патологией соединительной ткани отличается большими размерами (рис. 3, 4).
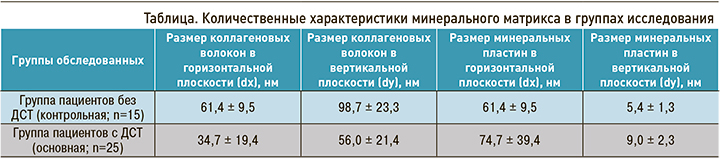
По результатам исследования эмали зубов, основным различием между группой контроля (n=15) и пациентами с патологией соединительной ткани (n=25) были наличие гипоминерализованной структуры кристаллической решетки гидроксиапатитов и неправильная их пространственная ориентация. Это влекло за собой изменение залегания органического матрикса, нарушение формирования полноценной структуры эмали вследствие нарушения нормального взаимоотношения органического матрикса и минерального компонента, не свойственных данному периоду созревания эмали зубов (табл.).
ЗАКЛЮЧЕНИЕ
Проведенное исследование продемонстрировало, что у детей с признаками ДСТ определялось отягощенное течение акушерского анамнеза, развитие внутриутробной гипоксии плода и высокая частота заболеваний в неонатальном периоде. Также у них прослеживалась этапность формирования маркеров повреждения соединительной ткани в разные возрастные периоды:
- в периоде новорожденности определялись преимущественно костно-мышечные и косметические изменения (нежная, бархатистая кожа, кривошея, дисплазия тазобедренных суставов, пупочные и паховые грыжи);
- к 3-летнему возрасту заметно прогрессировало вовлечение костной системы в патологический процесс с появлением новых признаков (плоскостопие, вальгусная установка стоп, деформация грудной клетки в виде вдавления в области мечевидного отростка, умеренная гипермобильность суставов, аномалии прорезывания зубов), и определялись малые аномалии сердца в виде эктопически крепленных хорд левого желудочка;
- к моменту смены зубов (6–9 лет) прогрессировало нарушение осанки, стала формироваться гипермобильность суставов и аритмогенный синдромы, а также дебютировали вегетативные расстройства и клапанный синдром.
Исследование морфологического строения эмали зубов при ДСТ и без ДСТ методами электронной и атомно-силовой микроскопии показали, что второй метод позволяет детально изучить отличительные признаки эмалевых призм (форму, строение, размеры в вертикальной и горизонтальной плоскостях, количество в единице объема, величину оболочки), а также расстояние между ними и высоту межпризменного промежутка. При этом для внутренних структур эмали зубов при ДСТ характерно конкретное содержание и определенные принципы формообразования их индивидуальных особенностей.
Прогнозирование тяжести течения ДСТ является актуальной проблемой, так как позволяет провести своевременную профилактику осложнений. Дети с отягощенной наследственностью или с появлением начальных признаков ДСТ требуют особого диспансерного наблюдения с целью своевременной диагностики соединительнотканной дисплазии путем объективной клинической оценки с использованием современных морфологических методов исследования соединительной ткани, профилактики прогрессирования выявленной патологии, начиная с первых дней жизни.



