ВВЕДЕНИЕ
В настоящее время продолжается пандемия новой коронавирусной инфекции COVID-19. Инфекция, вызванная SARS-CoV-2, представляет собой мультисистемное заболевание, проявляющееся различным спектром как легочных, так и внелегочных поражений [1]. Имеются данные, что, наряду с легкими, одним из часто поражаемых органов при COVID-19 являются почки [2].
Предполагается прямое действие вируса SARS- CoV-2 на этот орган в виде повреждения эндотелия, инфицирования подоцитов и проксимальных канальцев, митохондриальной дисфункции, острого канальцевого некроза. Рассматривается и поражение почек провоспалительными цитокинами; отметим в связи с этим, что инвазивная механическая вентиляция легких также способствуют выработке цитокинов. Описано, что на уровне мелких артерий в петлях клубочковых капилляров происходит процесс гиперкоагуляции – микротромбоз и микроэмболия [3]. В последнее время особое внимание обращают на коллапсирующую гломерулопатию вследствие прямой вирусной токсичности и цитокин-опосредованное повреждение канальцев [4].
Проявления нарушений функции почек при COVID-19 различны: чаще всего встречаются протеинурия (43,9%), гематурия (26,7%), повышение креатинина (14,4%). У 13,1% пациентов скорость клубочковой фильтрации (СКФ) составляет менее 60 мл/мин [5].
По данным Международного общества нефрологов, при тяжелом течении COVID-19 поражение почек в 25–50% случаев проявляется протеинурией и гематурией, а в 15% развивается острое повреждение почек (ОПП) [6]. В другом исследовании ОПП было отмечено у 17,6% пациентов [7].
Согласно имеющейся информации, частота встречаемости ОПП при COVID-19 в наблюдениях разных авторов колеблется в широком диапазоне – от 5 до 36,6%, а его развитие сопряжено с высоким уровнем смертности (60–90%) [8–10]. По данным Yang X. C et al. (2020), ОПП встречалось у каждого третьего пациента и диагностировалось чаще, чем заболевания сердца (23%) и печени (23%) [11].
Hirsch J.S. et al. изучили развитие ОПП при COVID-19 в Нью-Йорке в 2020 г. Это осложнение было диагностировано у 36,6% пациентов и при этом ассоциировалось с дыхательной недостаточностью. Среди пациентов с выявленным ОПП умерли 35%. Независимыми факторами риска развития ОПП у больных с COVID-19 являлись необходимость в искусственной вентиляции легких (ИВЛ) или вазопрессорной терапии, а также пожилой возраст, артериальная гипертония, сахарный диабет и сердечно-сосудистые заболевания [12].
Исходная патология почек выступает фактором риска развития новой коронавирусной инфекции [13]. Хроническая болезнь почек (ХБП) была выявлена у 48% пациентов старше 70 лет с COVID- 19; при этом такой фактор риска, как сахарный диабет, наблюдался в данной выборке вдвое реже [14]. Зарегистрировано развитие летальных случаев почти у каждого второго пациента с COVID-19 и ХБП [15].
В другом исследовании летальный исход у пациентов с COVID-19 на фоне ХБП был выявлен в 13,2% случаев, что оказалось сопоставимо с частотой летальных исходов в группе пациентов, имеющих сердечно-сосудистые заболевания. В то же время в отсутствие сопутствующей патологии летальный исход был отмечен лишь у 1,4% пациентов [14]. В целом поражение почек при COVID-19 служит второй по частоте причиной смерти пациентов после респираторного дистресс-синдрома [16]. По данным метаанализа, относительный риск смерти при сочетании COVID-19 с ХБП достигает 1,48 [17].
К сожалению, в настоящее время недостаточно данных о распространенности ОПП и ХБП среди больных новой коронавирусной инфекцией в России и их связи с тяжестью заболевания. С учетом этого целью нашего исследования стало изучение состояния функции почек у больных COVID-19 и его связи с течением болезни.
МАТЕРИАЛ И МЕТОДЫ
На базе БУ «Больница скорой медицинской помощи» Минздрава Чувашии (г. Чебоксары) выполнено ретроспективное изучение историй болезни 182 пациентов, госпитализированных с подтвержденным методом ПЦР диагнозом COVID-19, из которых 100 пациентов были выписаны домой, а 82 скончались.
Диагноз выставлялся на основании положительного результата лабораторного исследования на наличие РНК коронавируса методами амплификации нуклеиновых кислот и/или антигена SARS-CoV-2 c применением иммунохроматографического анализа вне зависимости от клинических проявлений [18]. Критериями для госпитализации считались сатурация кислорода в артериальной крови (SpO2) <95%; температура тела ≥38 °С; частота дыхательных движений (ЧДД) >22 в минуту [19].
Не включались в исследование пациенты, поступившие на лечение из другого стационара или переведенные в другой стационар, не имевшие данных о содержании креатинина и мочевины в течение года, предшествовавшего заболеванию. Все пациенты при поступлении дали информированное согласие на лечение, обследование и использование данных в научных исследованиях.
При осмотре больным измеряли SpO2, ЧДД, артериальное давление (АД), частоту сердечных сокращений (ЧСС). Проводились компьютерная томография органов грудной клетки (КТ ОГК), общий анализ крови, общий анализ мочи, исследование коагулограммы, развернутый биохимический анализ крови. Данные лабораторных исследований были проанализированы на 1, 3, 7-й дни госпитализации и на момент выписки. СКФ рассчитывалась по формуле CKD-EPI, ОПП, и его стадия определялись в соответствии с критериями KDIGO 2012 г. Лечение больных осуществлялось согласно актуальным методическим рекомендациям по лечению COVID-19 [18]. Для дифференцировки ОПП и ХБП у пациентов использовались показатели креатинина и мочевины в течение предшествующего года. Эритроцитурия и протеинурия определялись полуколичественным методом на полуавтоматическом анализаторе мочи DIRUI H-100.
Статистическая обработка данных проводилась с помощью программ STATISTICA 10.0, MedCalc 19.0 c расчетом относительного риска (ОР) летального исхода и его 95% доверительного интервала (ДИ). В связи с неправильным распределением данных при описании указывали медиану, нижнюю и верхнюю квартили – Ме {Q1–Q3}. Статистические различия (р) считались значимыми при вероятности ошибки (р) менее 0,05 и определялись с использованием критериев хи-квадрат и Манна–Уитни.
Для количественных показателей, связанных с повышенным риском смертности, был выполнен ROC-анализ с целью получения точек отсечения (cut-off) с наилучшим сочетанием чувствительности и специфичности. Для полученных точек отсечения рассчитывались ОР летальности и его 95% ДИ на сайте MedCalc [20].
РЕЗУЛЬТАТЫ
При поступлении пациенты предъявляли жалобы на кашель (97,8%), нарушение обоняния (34,1%), одышку различной степени выраженности (87,4%), нарушения сознания (22,0%), повышенную температуру (82,4%). Ряд лабораторных показателей имел прогностическую значимость в плане выживаемости. Были определены показатели, достоверно различавшиеся у умерших и выживших пациентов (табл. 1).

С помощью ROC-анализа были установлены критические значения показателей с наилучшим сочетанием чувствительности и специфичности. Затем были рассчитаны абсолютные риски летальности и ОР с 95% ДИ для выявленных показателей (табл. 2).
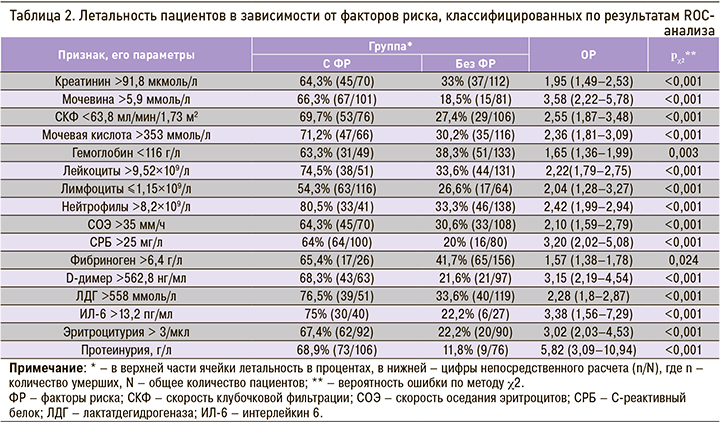
Протеинурия, начиная с уровня 0,1 г/л и выше, была выявлена у 127 пациентов (69,8%). При протеинурии <0,1 г/л летальность была минимальной – 7,8%, при протеинурии, равной 0,1 г/л, – 26,7%, при >0,1 г/л – 66,1% (р <0,001). ОР летального исхода при протеинурии >0,1 г/л составил 5,82 (ДИ: 3,09–10,94; р <0,001).
Эритроцитурия более 3 на 1 мкл была обнаружена у 92 пациентов (50,5%). Летальность при таком уровне эритроцитурии равнялась 67,4%, при меньшем уровне – 22,2%. ОР летального исхода при эритроцитурии более 3 на мкл составил 3,02 (ДИ: 2,03–4,53; p <0,001).
Значимыми факторами риска смерти в общей группе по данным ROC-анализа оказались уровень креатинина >91,8 мкмоль/л (ОР 1,95; ДИ: 1,50–2,53), уровень мочевины >5,9 ммоль/л (ОР 3,58; ДИ: 2,22–5,78), количество баллов шкале News 2 >4 (ОP 2,92; ДИ: 2,39–3,56).
На момент госпитализации ХБП была зарегистрирована у 96 из 182 пациентов (52,7%), в том числе ХБП 1 степени (ХБП-1) – у 14, ХБП-2 – у 43, ХБП-3 – у 36, ХБП-4 – у 3 человек. Среди пациентов с ХБП была выше доля людей пожилого и старческого возраста – 78,1 против 57,0% (р=0,002).
Ряд показателей был выше в группе с ХБП по сравнению с пациентами, не имевшими этого заболевания: это возраст (70,5 {61–82} против 63,5 {55–71} лет; p <0,001) и уровень интерлейкина 6 (46,88 {4,75–271,9} против 13,2 {1,80–36,7} пг/ мл; p=0,021). Также в группе ХБП был ниже уровень лимфоцитов – 0,85 {0,57–1,27} × 109/л против 1,04 {0,69–1,65} × 109/л (р=0,006).
У пациентов с ХБП потребность в кислородотерапии была более длительной – 10 {2,5–14} против 7,5 {0–11} дней у лиц без ХБП (р=0,009). Кроме того, пациентам с ХБП чаще требовалась ИВЛ (50 против 32%; р=0,013), у них чаще развивалось ОПП (25 против 9,3%; р=0,005).
Лица с ХБП имели худшую динамику показателей шкалы NEWS 2 по сравнению с лицами без ХБП. Если в 1-й день эти показатели были сопоставимы (4 {3–7} против 4 {1–7} баллов; р=0,298), то на 3-й и 7-й дни госпитализации сумма баллов в группе ХБП была выше – 4 {2–9} против 3 {0–6} баллов на 3-й день (р=0,011) и 6 {2–12} против 2 {0–7} баллов на 7-й день (р=0,007).
Летальность в группе без ХБП составила 33,7%, при ХБП-1 – 28,6%, ХБП-2 – 51,2%, ХБП-3 – 75% (р <0,001); при ХБП-4 (3 пациента) умерших не было. В последнем случае (ХБП-4) больные имели низкий риск смерти по шкале NEWS 2. В целом для пациентов с ХБП ОР смерти составил 1,64 (ДИ: 1,17–2,30; р=0,004).
ОПП было выявлено у 32 человек (17,6%), в том числе ОПП 1 стадии (ОПП-1) у 17, ОПП-2 – у 9, ОПП-3– у 6 человек. Доля пациентов с ОПП была выше среди лиц пожилого и старческого возраста по сравнению с лицами молодого и среднего возраста: 20,5 и 28% против 7,7 и 2,2% (p <0,05 во всех случаях). ОПП чаще развивалось у пациентов с ХБП: 25 против 9,3% случаев у лиц без ХБП (р=0,005).
В группе с ОПП были выше ЧДД (23 {20–24} против 19,5 {18–22}; р <0,001), доля пациентов с нарушением сознания (43,8 против 17,3%, p=0,001). Также у пациентов с ОПП была ниже сатурация кислорода в артериальной крови (93,5 {92–94,5} против 95% {94–97}; p <0,001), выше баллы по шкале NEWS 2 (7 {5–9,5} против 3 {1–6} баллов; p <0,001).
Доля пациентов с ОПП, имеющих значительное повреждение легких (более 50% поражения по КТ ОГК) была выше, чем в группе без ОПП (37,5 против 15,3%; p=0,004). При ОПП была выше доля пациентов, находящихся на кислородотерапии (84,4 против 58%; p=0,005), они чаще нуждались в ИВЛ (87,5 против 31,5%; p <0,001).
Помимо этого, у пациентов с ОПП по сравнению с лицами, не имеющими ОПП, были выше показатели интерлейкина 6 (67,8 {20,5–300} против 17 {2,25–91,47} пг/мл; p=0,03), лейкоцитов (9,31 {4,25–13,45} × 109/л против 5,65 {3,54–9,41} × 109/л; p=0,020), нейтрофилов (6,71 {2,81–11,02} × 109/л против 3,9 {2,26–7} × 109/л; p=0,030), Д-димера (1051 {279–2131} против 317 {185,6–873,8} нг/мл; p=0,006), лактатдегидрогеназы (461 {365,4–779} против 398 {270–582} ммоль/л; p=0,020).
Для группы с ОПП была характерна отрицательная динамика показателей шкалы News 2 по сравнению с группой лиц без ОПП: при поступлении – 7 {5–9,5} против 3 {1–6} баллов (p <0,001); на 3-й день – 10 {6–12} против 3 {0–7} баллов (p <0,001); на 7-й день – 12,5 {9,5–14} против 2 {1–9} баллов (p <0,001).
Летальность от новой коронавирусной инфекции у лиц без ОПП составила 35,3%, у пациентов с ОПП – 90,6% (ОР=2,57; ДИ: 2,18–3,02), причем в подгруппе с ОПП-1 этот показатель равнялся 82,4%, с ОПП-2 и ОПП-3 – 100%. Ни у одного из пациентов развитие ОПП не было непосредственной причиной смертельного исхода, не имелось показаний к заместительной почечной терапии.
Таким образом, на настоящий момент есть данные о том, что поражение почек служит предиктором неблагоприятных исходов у пациентов с COVID-19 [14–16]. В ходе проведенной оценки лабораторных показателей при поступлении был установлен повышенный риск смерти в случае воспалительных сдвигов как в общем анализе крови, так и при исследовании других показателей (лактатдегидрогеназа, С-реактивный белок, Д-димер).
Высокий уровень маркеров воспаления может говорить о тяжелых системных процессах, приводящих к летальному исходу: остром респираторном дистресс-синдроме, миокардите, ОПП. В поражении органов значительная роль принадлежит тотальной эндотелиальной дисфункции и повреждению микроциркуляторного русла, свойственных COVID-19 [4]. Об этом свидетельствуют возрастание уровня Д-димера и гиперфибриногенемия.
Из полученных результатов видно, что больные с ОПП и ХБП составляют группу повышенного риска по развитию летального исхода. У них отмечались худшие клинические и лабораторные показатели. Наличие у пациентов ХБП и ОПП характеризует более тяжелое течение COVID-19, сопровождается негативной динамикой показателей и, как следствие, высоким уровнем летальности. Прогностически неблагоприятными в плане летального исхода являются уровень СКФ <63,8 ммоль/л, креатинина >91,8 мкмоль/л, мочевины >5,9 ммоль/л.
ЗАКЛЮЧЕНИЕ
1. У пациентов с COVID-19 часто наблюдаются изменения в анализах мочи: протеинурия >0,1 г/л (69,8%) и эритроцитурия >3 в поле зрения. Наличие этих изменений повышает ОР смерти в 5,82 (ДИ: 3,09–10,94) и 3,02 (2,03–4,53) раза соответственно.
2. У пациентов с COVID-19 часто регистрируются ХБП (52,7%, в том числе 21,4% ХБП 3–4 стадий) и ОПП (17,6%, в том числе 13,2% на фоне предшествующей ХБП).
3. Факторами риска развития ОПП у больных с COVID-19 выступали наличие ХБП, пожилой и старческий возраст, факторами риска ХБП – пожилой и старческий возраст.
4. Наличие ОПП и ХБП характеризуется более выраженными клиническими проявлениями, лабораторными сдвигами, более частой потребностью в оксигенотерапии и ИВЛ, более тяжелым течением болезни.
5. ОР летального исхода увеличивается при наличии ХБП (1,64; ДИ: 1,17–2,30) и особенно сильно при ОПП (2,57; ДИ: 2,18–3,02).



