ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) являются одновременно наиболее частым диагнозом и ведущей причиной смерти у пациентов с хронической болезнью почек (ХБП) [1].
Традиционные факторы риска ССЗ, особенно артериальная гипертензия (АГ), встречаются на порядок чаще у лиц с терминальной стадией ХБП, чем в общей популяции [2]. У диализных пациентов АГ ассоциируется с повышенным риском серьезных осложнений ишемической болезни сердца (ИБС) и инсульта. Перегрузка давлением может вызывать увеличение толщины стенок левого желудочка (ЛЖ) и уменьшение объема полости, приводящие к концентрической гипертрофии ЛЖ (ГЛЖ) [3]. В то же время в терминальной стадии ХБП нарастает перегрузка объемом, которая влечет за собой увеличение объема камер сердца, ведущее к эксцентрической гипертрофии. Наличие ГЛЖ у пациентов с ХБП имеет неблагоприятное прогностическое значение в связи с развитием сердечной недостаточности, фатальных аритмий и внезапной сердечной смерти. В ряде работ показано, что показатели артериального давления (АД) по-разному могут влиять на геометрию и функцию ЛЖ [4–8]. Вместе с тем в доступной литературе представлено недостаточное количество работ с доказанными связями ремоделирования ЛЖ и параметрами 24-часового суточного мониторирования АД (СМАД), влияющих на выбор антигипертензивной терапии. В связи с этим не в полной мере решены вопросы о влиянии ригидности сосудистой стенки на распространенность ГЛЖ. Более углубленное изучение данных связей в перспективе может изменить тактику ведения пациентов с ХБП.
Цель исследования – оценка параметров СМАД у пациентов, получающих лечение программным гемодиализом, в зависимости от структурно-функционального состояния сердца.
МАТЕРИАЛ И МЕТОДЫ
Проведено наблюдательное выборочное контролируемое рандомизированное исследование 179 пациентов с ХБП 5д стадии (79 мужчин и 100 женщин). Средний возраст участников составил 56,9±12,2 лет (от 24 до 68 лет).
Программный гемодиализ выполнялся на аппаратах Fresenius-4008S (Германия) и B. Braun-Dialog+ (Германия) по 4–4,5 ч 3 раза/нед с применением полисульфоновых диализаторов. Длительность диализной терапии составила 5,7±3,5 лет. У всех пациентов достигалась приемлемая доза гемодиализа в соответствии с актуальными клиническими рекомендациями. Индекс адекватности Kt/V по мочевине был выше 1,2 и равен 1,53±0,17. Прибавка в весе составила 2086,1±776,8 кг, кондуктивность натрия – 125,9±36,7 ммоль/л, вес – 72,4±12,8 кг.
Критериями включения в исследование были длительность диализной терапии не менее одного года и наличие информированного согласия.
Для исследования показателей СМАД использовался динамический монитор АД МДП-НС-02с «Восход» (2020 г., Россия) с применением осциллометрического метода измерения АД каждые полчаса в течение дня и каждый час в течение ночи. Дневное и ночное время устанавливалось индивидуально в соответствии с обычным временем сна пациента ночью и временем пробуждения утром. Выполнялся анализ стандартных показателей СМАД и параметров ригидности артерий. Оценивалась связь показателей СМАД с параметрами эхокардиографического исследования (Эхо- КГ). Эхо-КГ выполнялось в М- и В- режимах на аппарате Midrey 7 UMT 200 (Китай, 2020 г.) импульсным датчиком P4-2s и включало измерение правого желудочка (ПЖ, среднее значение – 3,54±0,35 см), конечно-диастолического размера (КДР, 5,15±0,49 см), конечно-систолического размера (КСР, 3,5±0,61 см), конечно-диастолического объема (КДО, 129,9±29,2 мл), ударного объема (УО, 66,5±19,8 мл), фракция укорочения (FS, 32,5±4,7%), заднюю стенку ЛЖ (ЗСЛЖ, 1,15±0,17 см), межжелудочковую перегородку в диастолу (МЖП, 1,14±0,15 см), площадь поверхности тела (ППТ, 1,8±0,23 м2).
Фракция выброса ЛЖ (ФВ ЛЖ, 61,3±6,18%) определялась по способу Simpson. Расчет массы миокарда левого желудочка (ММЛЖ, 225,4 [190,4; 285,3] г) производился по методике Devereux R.B. et al.: ММЛЖ=0,8 - (1,04 -(КДР + МЖП + ЗСЛЖ)3 - КДР3) + 0,6. Для оценки ГЛЖ рассчитывались индекс ММЛЖ (ИММЛЖ, 127,4 [105,9; 156,3] г/м2), индекс относительной толщины (ИОТ, 0,45±0,08), внутренняя оболочка (1,97±0,25), фракция укорочения средних волокон (15,3±2,3%). За ГЛЖ принимались значения ИММЛЖ более 95 г/м2 у женщин и более 115 г/м2 у мужчин. Величину ИОТ рассчитывали по формуле: 2H/D = (МЖПд + ЗСЛЖд)/КДР. Применялась классификация типов ремоделирования в соответствии с российскими рекомендациями по количественной оценке структуры и функции сердца (2012).
Перед исследованием было получено разрешение локального этического комитета ФГБОУ ВО «ИГМА» Минздрава России. От каждого пациента, включенного в исследование, было получено добровольное информированное согласие.
Статистическая обработка результатов исследования проводилась общепринятыми методиками вариационной статистики с использованием прикладных программ BioStat (Primer of Biostatistics, «Практика», г. Москва, 2022, версия 7.6.5) и MicrosoftExcel 2010 (США). Для проверки нормальности распределения полученных значений применялся критерий Колмогорова–Смирнова. Большинство количественных переменных не отличалось от нормального и описывалось в виде M±SD. В случае непараметрического распределения признака данные описывали в виде Me [25%; 75%] (Me – медиана, 25 и 75 – 1-я и 3-я квартили). Корреляционные отношения оценивались с помощью рангового коэффициента корреляции Спирмена (R). Различия сравниваемых величин признавались достоверными при вероятности 95% (р <0,05) и выше.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно полученным результатам, 113 (63,1%) пациентов с ХБП 5д стадии имели превышение целевых цифр офисного систолического АД (САД) до диализа и 70 (39,1%) пациентов после гемодиализа (χ2=19,72; p <0,001). В среднем уровень САД до гемодиализа составил 135,7±17,1 мм рт. ст., диастолического АД (ДАД) – 78,5±9,0 мм рт.ст., после гемодиализа –133,2±12,8 мм и 77,7±10,5 мм рт. ст. соответственно. Уровень ДАД был повышен до диализа у 11 (6,1%) человек. После проведения этой процедуры диастолическая гипертензия не отмечалась ни у одного пациента. Это свидетельствовало об эффективной ультрафильтрации в течение гемодиализа. Тем не менее в работе Ashby D. et al. показано, что преддиализное АД больше связано с возникновением сердечно-сосудистых катастроф. В то же время при анализе параметров СМАД нами установлено, что среднесуточные индексы (СИ) САД и ДАД были повышены у 44 (24,6%) пациентов (табл. 1).
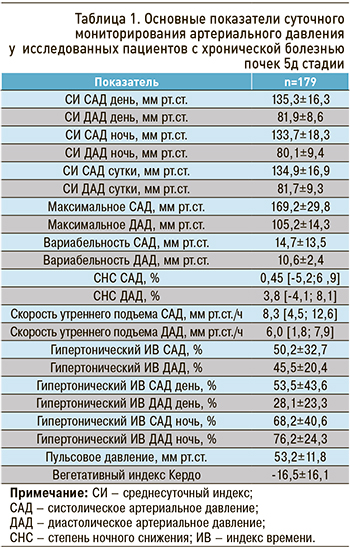
АГ по показателю СИ САД была выявлена у 53 (29,6%) пациентов в дневное время и у 95 (53,1%) в ночное (χ2=19,36; p <0,001). Также отмечено увеличение количества пациентов с повышением ДАД ночью при сравнении с дневными показателями: 65 (36,3%) против 42 (23,5%) человек (χ2= 6,45; p <0,01). Стоит отметить, что уровень САД за сутки коррелировал с офисным САД до и после процедуры гемодиализа (r=0,56, p <0,001 и r=0,46 p <0,01 соответственно). Установлена прямая связь уровня САД с весом пациента (r=0,38, p <0,05) и параметрами геометрии ЛЖ: МЖП (r=0,42, p <0,05) и ММЛЖ (R=0,39 p <0,05). В отношении уровня ДАД такой закономерности выявлено не было.
Аналогичные данные получены в работе Schneider M.P. et al. (2018), где была установлена независимая ассоциация ГЛЖ по данным магнитно-резонансной томографии с повышенной массой тела и более высоким САД [8]. Исследование показало, что концентрическое ремоделирование было связано с высоким 24-часовым САД. При этом, что интересно, было выявлено, что уровень гидратации не влияет на геометрию ЛЖ. Нами также не получена связь прибавки веса с уровнем САД и параметрами ГЛЖ.
Многие авторы констатируют связь САД с развитием ГЛЖ, но не ДАД [4, 6]. В одном из крупных исследований было продемонстрировано, что ГЛЖ имеет связь с САД в зависимости от применения препаратов, блокирующих ренин-ангитензин-альдостероновую систему [9]. В другом испытании было обнаружено удвоение риска ГЛЖ при повышении САД более 160 мм рт.ст. и индекса массы тела более 30 кг/м2 [10]. Именно АГ и ожирение, а не скорость клубочковой фильтрации (СКФ) вносят основной вклад в развитие ГЛЖ. В работе Fujii H. et al. (2019) установлено, что трансплантация почки может повлиять на регресс ГЛЖ, снижение САД и количество принимаемых препаратов [11].
В нашем исследовании максимальные уровни САД и ДАД имели связь с МЖП (r=0,33, p <0,05; r=0,36, p <0,05) и ММЛЖ (r=0,33 p <0,05; r=0,39, p <0,05). Cha R.H. et al. в 2017 г. показали, что высокие САД и ДАД связаны с ГЛЖ [12]. Другими авторами было выявлено, что у пациентов с ХБП распространенность АГ достигает 78%, а ГЛЖ – 21,4% [13]. При этом распространенность последней не отличалась у пациентов с АГ и без нее. Наше исследование доказывает, что даже при хорошо контролируемом АД распространенность ГЛЖ высока.
Вариабельность САД и ДАД была повышена у 71 (39,7%) и 60 (33,5%) пациентов соответственно. Стоит отметить, что вариабельность САД не имела связь с параметрами геометрии ЛЖ. В то же время вариабельность ДАД коррелировала с толщиной ПЖ (r=0,33; p <0,05), а также с ЗСЛЖ (r=0,35; p <0,05) и ИОТ (r=-0,33; p <0,05), что не было установлено другими исследователями. Тем не менее в работе Liu S. et al. (2022) высокий уровень ДАД был ассоциирован с меньшим базальным диаметром ПЖ [3].
В нашем исследовании у большинства пациентов, получающих лечение программным гемодиализом, наблюдалось нарушение суточного ритма АД по типу Non-dipper и Night Peaker в отношении САД (81,6%; χ2=140,2; p <0,001) и ДАД (73,2%; χ2=75,1; p <0,001; рис.). Нами установлена корреляция степени ночного снижения (СНС) САД с ППТ (r=0,41, p <0,01) и показателями геометрии ЛЖ: ЗСЛЖ (r=- 0,62, p <0,001), МЖП (r=-0,53, p <0,001), ММЛЖ (r=-0,45, p <0,01), ИММЛЖ (r=-0,55, p <0,001). Аналогичная связь получена с СНС ДАД: ЗСЛЖ (r=-0,58, p <0,01), МЖП (r=-0,52, p <0,01), ММЛЖ (r=-0,51, p <0,01), ИММЛЖ(r=-0,53, p <0,01).
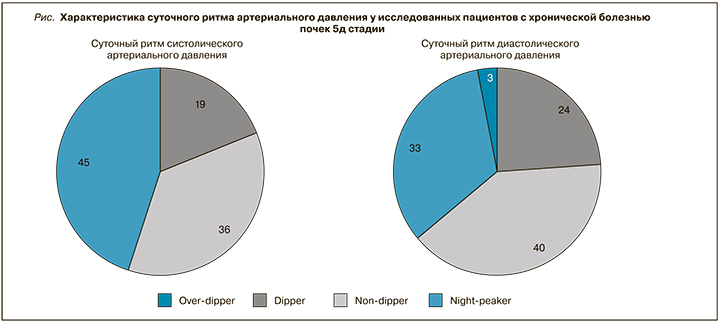
Полученные нами результаты соотносятся с данными китайских авторов Che X. et al. (2017), которые продемонстрировали, что аномальный циркадный ритм у пациентов с ХБП встречался до 75,4% и коррелировал с увеличением ИММЛЖ [14]. В то же время в обзоре Leibowitz D. (2014) было показано, что именно недипперы имеют более высокую частоту ГЛЖ при ХБП [5]. Также была отмечена связь повышенной жесткости сосудов с геометрией ЛЖ. В когортном масштабном китайском исследовании (2022) выявлена тесная ассоциация неблагоприятных почечных исходов и развитие ГЛЖ у пациентов с ночной гипертонией [15]. Основываясь на наших данных, можно предположить о необходимости более широкого применения СМАД, в том числе у лиц с «контролируемой» офисной АГ.
При анализе показателей ригидности артерий установлено, что среднее значение скорости пульсовой волны у участников исследования находилось на верхней границе допустимых значений. Этот параметр был повышен у 35 (19,6%) пациентов и коррелировал с междиализной прибавкой веса (r=0,55; p <0,001), а также с фракцией укорочения средних волокон (r=0,4; p <0,05). Ранее Sun L. et al. (2022) установили, что уровень гипергидратации связан с более высокой частотой ГЛЖ у больных ХБП [7].
Среднее значение систолического объема находилось в пределах допустимых значений (табл. 2). Тем не менее превышение данного показателя было отмечено у 110 (61,5%) пациентов, а снижение – у 29 (16,2%). Показатель систолического объема имел связь с КДР (r=0,48, p <0,01), КДО (r=0,39, p <0,05), ММЛЖ (r=0,37, p <0,05) и САД до гемодиализа (r=-0,47, p <0,01), после гемодиализа (r=-0,44, p <0,01). Согласно полученному значению индекса ригидности артерий, у большинства пациентов наблюдался умеренный риск развития ИБС (116 пациентов – 64,8%; p <0,001). Высокий риск это заболевания был отмечен у 52 (29,1%), очень высокий – у 6 (3,4%) отсутствие риска – у 5 (2,7%) человек. Индекс ригидности артерий коррелировал с МЖП (r=0,36, p <0,05), ММЛЖ (r=0,34, p <0,05) и САД после гемодиализа (r=0,39, p <0,05). Одно из ретроспективных исследований продемонстрировало, что эффективность работы миокарда, в том числе ударный (систолический) объем, уменьшается с возрастанием АД и связан с повышением ИММЛЖ [16]. При этом ГЛЖ у пациентов с ХБП характеризуется одновременным увеличением толщины и диаметра стенок с негативным воздействием на диастолическую функцию.
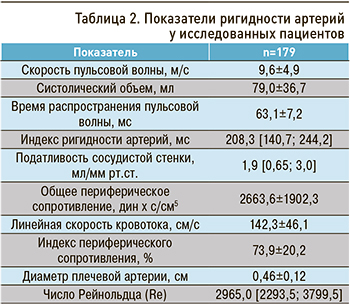
Нами обнаружено, что у всех пациентов, получающих лечение программным гемодиализом, наблюдались высокие значения числа Рейнольдса: у 29 (16,2%) пациентов турбулентность кровотока присутствовала в участках разветвления сосудов, у 150 (83,8%) – даже в прямолинейных участках. Средние значения гипертонического индекса времени (ИВ) САД и ДАД превышали нормативные значения, что может свидетельствовать о стойкой АГ, особенно в ночные часы. Гипертонический ИВ САД значимо не менялся в течение суток: днем он был повышен у 92 (51,4%), ночью – у 114 (63,7%) пациентов. Установлено, что гипертонический ИВ ДАД преобладал ночью у 168 (93,9%; χ2= 97,56; p <0,001), днем – у 81 (45,3%) пациента. Гипертонический ИВ САД и ДАД имел связь с параметрами геометрии ЛЖ преимущественно в ночные часы (табл. 3). В зарубежных публикациях приводятся данные о том, что уровень САД служит независимым фактором риска развития ГЛЖ [17] и увеличения цереброваскулярных событий [18].
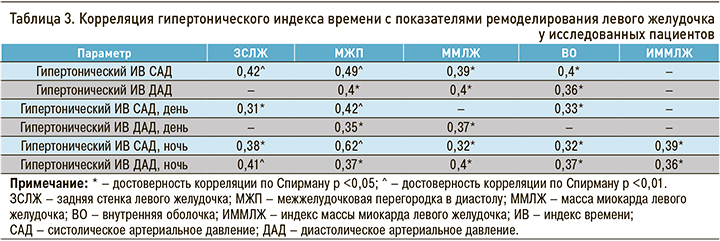
Также нами выявлено, что вариабельность САД превышала референсные значения у 71 (39,7%) участника исследования, преимущественно у лиц с повышенным уровнем СИ САД. Вариабельность ДАД была увеличена у 60 (33,5%) пациентов, в основном у респондентов с нормальными и пониженными показателями АД. Увеличение скорости утреннего подъема было установлено у 54 (31%) пациентов по САД и у 49 (27,4%) по ДАД. Нами обнаружена связь скорости утреннего подъема САД и ДАД со скоростью кровотока на процедуре гемодиализа (r=0,4, p <0,05 и r=0,4, p <0,05 соответственно). Этот параметр по ДАД имел связь с КДР (r=0,42, p <0,05), КСР (r=0,47, p <0,01), диастолическим объемом (r=0,44, p<0,01).
При оценке вегетативного статуса у пациентов с ХБП у большинства (135 человек– 75,4%) преобладала парасимпатикотония (χ2=90,5; p <0,001). При этом выраженная парасимпатикотония наблюдалась у 43 (24%) респондентов. Данный факт свидетельствует о децентрализации процессов регуляции сердечного ритма у исследованных пациентов, что может быть обусловлено торможением центральной нервной системы и хроническим стрессом. Отметим, что влияние последнего на патогенез и неблагоприятные исходы АГ приводит к необходимости учитывать его в стратегии лечения.
Установлена связь вегетативного индекса с кондуктивностью натрия в диализирущем растворе (r=0,35, p <0,01), САД до и после гемодиализа (r=- 0,45, p <0,01; r=-0,5, p <0,01), ММЛЖ (r=-0,51, p <0,001), ИММЛЖ (r=-0,44, p <0,01). Интересен тот факт, что с САД и ММЛЖ коррелировало содержание именно натрия в коже, но не гипергидратация [9].
ЗАКЛЮЧЕНИЕ
Таким образом, согласно полученным нами результатам, у большинства пациентов с ХБП 5д стадии преобладает парасимпатикотония, наблюдается умеренное увеличение ригидности артерий и нарушение суточного ритма АД по типу Non-dipper и Night Peaker. Показатели офисного АД коррелируют с дневными показателями давления при СМАД. У пациентов, получающих лечение программный гемодиализ, происходит увеличение показателей ИВ САД и ДАД в ночное время. Вегетативный индекс имел связь с САД и ИММЛЖ.
Также установлено, что показатели САД имели связь больше с показателями геометрии ЛЖ, а также с весом пациента и ППТ. В то же время уровень ДАД коррелировал с толщиной ПЖ и прибавкой веса. СНС САД и ДАД характеризовались более тесной ассоциацией с уровнем ГЛЖ, что подтверждается корреляцией геометрии ЛЖ с ИВ САД и ДАД в ночное время. Показатели ригидности артерий связаны с междиализной прибавкой веса, размерами полости ЛЖ и САД после ГД.
Следовательно, при ведении пациентов с ХБП 5д стадией требуется дифференцированный подход к терапии АГ. При наличии систолической гипертензии, помимо применения препаратов, влияющих на регресс и профилактику ремоделирования ЛЖ, необходимо обращать внимание на коррекцию веса. При диастолической гипертензии следует ориентироваться на уменьшение междиализной прибавки веса. При этом необходимо рекомендовать включение в протокол ведения всех пациентов, получающих лечение программным диализом, проведение СМАД для выявления ночной гипертонии.



